Elementos químicos
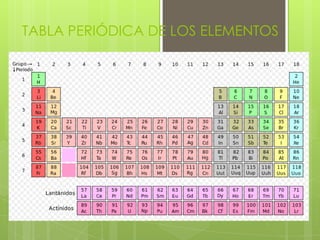
- 1. TABLA PERIÓDICA DE LOS ELEMENTOS
- 2. Hidrógeno - H Primer elemento de la tabla periódica. En condiciones normales es un gas incoloro, inodoro e insípido, compuesto de moléculas diatómicas, H2. El átomo de hidrógeno, símbolo H, consta de un núcleo de unidad de carga positiva y un solo electrón. Tiene número atómico 1 y peso atómico de 1.00797. Es uno de los constituyentes principales del agua y de toda la materia orgánica, y está distribuido de manera amplia no sólo en la Tierra sino en todo el universo. Existen 3 isótopos del hidrógeno: el protio, de masa 1, que se encuentra en más del 99.98% del elemento natural; el deuterio, de masa 2, que se encuentra en la naturaleza aproximadamente en un 0.02%, y el tritio, de masa 3, que aparece en pequeñas cantidades en la naturaleza, pero que puede producirse artificialmente por medio de varias reacciones nucleares.
- 4. Helio - He Elemento químico gaseoso, símbolo He, número atómico 2 y peso atómico de 4.0026. El helio es uno de los gases nobles del grupo O de la tabla periódica. Es el segundo elemento más ligero. La fuente principal de helio del mundo es un grupo de campos de gas natural en los Estados Unidos. El helio es un gas incoloro, inodoro e insípido. Tiene menor solubilidad en agua que cualquier otro gas. Es el elemento menos reactivo y esencialmente no forma compuesto químicos. La densidad y la viscosidad del vapor de helio son muy bajas. La conductividad térmica y el contenido calórico son excepcionalmente altos. El helio puede licuarse, pero su temperatura de condensación es la más baja de cualquier sustancia conocida. El helio fue el primer gas de llenado de globos y dirigibles. Esta aplicación continúa en la investigación de alta altitud y para globos meteorológicos. El uso principal del helio lo constituye el gas inerte de protección en soldadura autógena. Su mayor potencial lo encontramos en aplicaciones a temperaturas muy bajas. El helio es el único refrigerante capaz de alcanzar temperaturas menores que 14 K (-434ºF). El principal valor de la temperatura ultrabaja está en el desarrollo del estado de superconductividad, en el cual hay prácticamente una resistencia cero al flujo de la electricidad. Otras aplicaciones son su uso como gas presurizante en combustibles líquidos de cohetes, en mezclas helio- oxígeno para buzos, como fluido de trabajo en los reactores nucleares enfriados por gas y como gas transportador en los análisis químicos por cromatografía de gases.
- 6. Litio - Li El litio encabeza la familia de los metales alcalinos en la tabla periódica. En la naturaleza se encuentra como una mezcla de los isótopos Li6 y Li7. Es el metal sólido más ligero, es blando, de bajo punto de fusión y reactivo. Muchas propiedades físicas y químicas son tan o más parecidas a las de los metales alcalinotérreos que a las de su grupo. El principal uso industrial del litio es en forma de estearato de litio como espesante para grasas lubricantes. Otras aplicaciones importantes de compuestos de litio son en cerámica, de modo específico en la formulación de esmaltes para porcelana; como aditivo para alargar la vida y el rendimiento en acumuladores alcalinos y en soldadura autógena y soldadura para latón. El litio es un elemento moderadamente abundante y está presente en la corteza terrestre en 65 partes por millón(ppm). Esto lo coloca por debajo del níquel, cobre y tungsteno y por encima del cerio y estaño, en lo referente a abundancia. Entre las propiedades físicas más notables del litio están el alto calor específico (capacidad calorifica), el gran intervalo de temperatura de la fase líquida, alta conductividad térmica, baja viscosidad y muy baja densidad. El litio metálico es soluble en aminas alifáticas de cadena corta, como la etilamina. Es insoluble en los hidrocarburos.
- 8. Berilio - Be El berilio, metal raro, es uno de los metales estructurales más ligeros, su densidad es cerca de la tercera parte de la del aluminio. En la table de arriba se muestran algunas de las propiedades físicas y químicas importantes del berilio. El berilio tiene diversas propiedades poco comunes e incluso únicas. El principal uso del berilio metálico se encuentra en la manufactura de aleaciones berilio-cobre y en el desarrollo de materiales moderadores y reflejantes para reactores nucleares. La adición de un 2% de berilio al cobre forma una aleación no magnética seis veces más fuerte que el cobre. Estas aleaciones berilio-cobre tienen numerosas aplicaciones en la industria de herramientas ya que no producen chispas, en las partes móviles críticas de aviones, así como en componentes clave de instrumentos de precisión, computadoras mecánicas, reveladores eléctricos y obturadores de cámaras fotográficas. Martillos, llaves y otras herramientas de berilio-cobre se emplean en refinerías petroleras y otras plantas en las cuales una chispa producida por piezas de acero puede ocasionar una explosión o un incendio. El berilio tiene muchos usos en la energía nuclear porque es uno de los materiales más eficientes para disminuir la velocidad de los neutrones, así como para reflejarlos. En consecuencia, se utiliza en la construcción de reactores nucleares como moderador y soporte, o en aleaciones con elementos combustibles.
- 10. Boro - B Elemento químico, B, número atómico 5, peso atómico 10.811. Tiene tres elementos de valencia y se comporta como no metal. Se clasifica como metaloide y es el único elemento no metálico con menos de cuatro electrones en la capa externa. El elemento libre se prepara en forma cristalina o amorfa. La forma cristalina es un sólido quebradizo, muy duro. Es de color negro azabache a gris plateado con brillo metálico. Una forma de boro cristalino es rojo brillante. La forma amorfa es menos densa que la cristalina y es un polvo que va del café castaño al negro. En los compuestos naturales, el boro se encuentra como una mezcla de dos isótopos estables, con pesos atómicos de 10 y 11. Muchas propiedades del boro no están lo suficientemente establecidas en forma experimental por la pureza discutible de algunas fuentes de boro, las variaciones en los métodos y las temperaturas de preparación. El boro y sus compuestos tienen muchas aplicaciones en diversos campos, aunque el boro elemental se emplea principalmente en la industria metalúrgica. Su gran reactividad a temperaturas altas, en particular con oxígeno y nitrógeno, lo hace útil como agente metalúrgico degasificante. Se utiliza para refinar el aluminio y facilitar el tratamiento térmico del hierro maleable. El boro incrementa de manera considerable la resistencia a alta temperatura, característica de las aleaciones de acero. El boro elemental se emplea en reactores atómicos y en tecnologías de alta temperatura. Las propiedades físicas que lo hacen atractivo en la construcción de misiles y tecnología de cohetes son su densidad baja, extrema dureza, alto punto de fusión y notable fuerza tensora en forma de filamentos. Cuando las fibras de boro se utilizan en material portador o matriz de tipo epoxi (u otro plástico), la composición resultante es más fuerte y rígida que el acero y 25% más ligera que el aluminio. El bórax, Na2B4O710H2O, refinado es un ingrediente importante en ciertas variedades de detergentes, jabones, ablandadores de agua, almidones para planchado, adhesivos, preparaciones para baño, cosméticos. Talcos y papel encerado. Se utiliza también en retardantes a la flama, desinfectantes de frutas y madera, control de hierbas e insecticidas, así como en la manufactura de papel, cuero y plásticos.
- 12. Carbono - C El carbono es único en la química porque forma un número de compuestos mayor que la suma total de todos los otros elementos combinados. Con mucho, el grupo más grande de estos compuestos es el constituido por carbono e hidrógeno. Se estima que se conoce un mínimo de 1.000.000 de compuestos orgánicos y este número crece rápidamente cada año. Aunque la clasificación no es rigurosa, el carbono forma otra serie de compuestos considerados como inorgánicos, en un número mucho menor al de los orgánicos. El carbono elemental existe en dos formas alotrópicas cristalinas bien definidas: diamante y grafito. Otras formas con poca cristalinidad son carbón vegetal, coque y negro de humo. El carbono químicamente puro se prepara por descomposición térmica del azúcar (sacarosa) en ausencia de aire. Las propiedades físicas y químicas del carbono dependen de la estructura cristalina del elemento. La densidad fluctúa entre 2.25 g/cm³ (1.30 onzas/in³) para el grafito y 3.51 g/cm³ (2.03 onzas/in³) para el diamante. El punto de fusión del grafito es de 3500ºC (6332ºF) y el de ebullición extrapolado es de 4830ºC (8726ºF). El carbono elemental es una sustancia inerte, insoluble en agua, ácidos y bases diluidos, así como disolventes orgánicos. A temperaturas elevadas se combina con el oxígeno para formar monóxido o dióxido de carbono. Con agentes oxidantes calientes, como ácido nítrico y nitrato de potasio, se obtiene ácido melítico C6(CO2H)6. De los halógenos sólo el flúor reacciona con el carbono elemental. Un gran número de metales se combinan con el elemento a temperaturas elevadas para formar carburos.
- 14. Nitrógeno - N Elemento químico, símbolo N, número atómico 7, peso atómico 14.0067; es un gas en condiciones normales. El nitrógeno molecular es el principal constituyente de la atmósfera ( 78% por volumen de aire seco). Esta concentración es resultado del balance entre la fijación del nitrógeno atmosférico por acción bacteriana, eléctrica (relámpagos) y química (industrial) y su liberación a través de la descomposición de materias orgánicas por bacterias o por combustión. En estado combinado, el nitrógeno se presenta en diversas formas. Es constituyente de todas las proteínas (vegetales y animales), así como también de muchos materiales orgánicos. Su principal fuente mineral es el nitrato de sodio. Gran parte del interés industrial en el nitrógeno se debe a la importancia de los compuestos nitrogenados en la agricultura y en la industria química; de ahí la importancia de los procesos para convertirlo en otros compuestos. El nitrógeno también se usa para llenar los bulbos de las lámparas incandescentes y cuando se requiere una atmósfera relativamente inerte. El nitrógeno, consta de dos isótopos, 14N y 15N, en abundancia relativa de 99.635 a 0.365. Además se conocen los isótopos radiactivos 12N, 13N, 16N y 17N, producidos por una variedad de reacciones nucleares. A presión y temperatura normales, el nitrógeno molecular es un gas con una densidad de 1.25046 g por litro. El nitrógeno elemental tiene una reactividad baja hacia la mayor parte de las sustancias comunes, a temperaturas ordinarias. A altas temperaturas, reacciona con cromo, silicio, titanio, aluminio, boro, berilio, magnesio, bario, estroncio, calcio y litio para formar nitruros; con O2, para formar NO, y en presencia de un catalizador, con hidrógeno a temperaturas y presión bastante altas, para formar amoniaco. El nitrógeno, carbono e hidrógeno se combinan arriba de los 1800ºC (3270ºF) para formar cianuro de hidrógeno.
- 16. Oxígeno - O Elemento químico gaseoso, símbolo O, número atómico 8 y peso atómico 15.9994. Es de gran interés por ser el elemento esencial en los procesos de respiración de la mayor parte de las células vivas y en los procesos de combustión. Es el elemento más abundante en la corteza terrestre. Cerca de una quinta parte (en volumen) del aire es oxígeno. Existen equipos capaces de concentrar el oxígeno del aire. Son los llamados generadores o concentradores de oxígeno, que son los utilizados en los bares de oxígeno. El oxígeno gaseoso no combinado suele existir en forma de moléculas diatómicas, O2, pero también existe en forma triatómica, O3, llamada ozono. El oxígeno se separa del aire por licuefacción y destilación fraccionada. Las principales aplicaciones del oxígeno en orden de importancia son: 1) fundición, refinación y fabricación de acero y otros metales; 2) manufactura de productos químicos por oxidación controlada; 3) propulsión de cohetes; 4) apoyo a la vida biológica y medicina, y 5) minería, producción y fabricación de productos de piedra y vidrio. Existen equipos generadores de ozono, los cuales son usados para oxidación de materias, para ozonización de piscinas...
- 18. Flúor - F Símbolo F, número atómico 9, miembro de la familia de los halógenos con el número y peso atómicos más bajos. Aunque sólo el isótopo con peso atómico 19 es estable, se han preparado de manera artificial los isótopos radiactivos, con pesos atómicos 17 y 22, el flúor es el elemento más electronegativo, y por un margen importante, el elemento no metálico más energético químicamente. Propiedades: El flúor elemental es un gas de color amarillo pálido a temperaturas normales. El olor del elemento es algo que está todavía en duda. La reactividad del elemento es tan grande que reacciona con facilidad, a temperatura ambiente, con muchas otras sustancias elementales, entre ellas el azufre, el yodo, el fósforo, el bromo y la mayor parte de los metales. Dado que los productos de reacción con los no metales son líquidos o gases, las reacciones continúan hasta consumirlo por completo, con frecuencia con producción considerable de calor y luz. En las reacciones con los metales forma un fluoruro metálico protector que bloquea una reacción posterior a menos que la temperatura se eleve. El aluminio, el níquel, el magnesio y el cobre forman tales películas de fluoruro protector. El flúor reacciona con violencia considerable con la mayor parte de los compuestos que contienen hidrógeno, como el agua, el amoniaco y todas las sustancias orgánicas, sean líquidos, sólidos o gases. La reacción del flúor con el agua es compleja y produce principalmente fluoruro de hidrógeno y oxígeno, así como cantidades menores de peróxido de hidrógeno, difluoruro de oxígeno y ozono. El flúor desplaza otros elementos no metálicos de sus compuestos, aun aquellos muy cercanos en cuanto a actividad química. Desplaza el cloro del cloruro de sodio y el oxígeno en la sílica, en vidrio y en algunos materiales cerámicos. En ausencia de fluoruro de hidrógeno, el flúor no ataca en forma significativa al cuarzo o al vidrio, ni aun después de varias horas a temperaturas hasta de 200ºC (390ºF).
- 20. Neón - Ne Elemento químico gaseoso, símbolo Ne, con número atómico 10 y peso atómico 20.179. El neón es miembro de la familia de los gases nobles. La única fuente comercial del neón es la atmósfera terrestre, aunque se encuentran pequeñas cantidades de neón en el gas natural, en los minerales y en los meteoritos. Se usan cantidades considerables de neón en la investigación física de alta energía. Las cámaras de centelleo con que se detecta el paso de partículas nucleares se llenan de neón. El neón líquido puede utilizarse como un refrigerante en el intervalo de 25-40 K (-416 a -387ºF). También se utiliza en algunos tipos de tubos electrónicos, contadores Geiger- Müller, en lámparas probadoras de corriente eléctrica de alto voltaje. Con baja potencia eléctrica se produce luz visible en lámparas incandescentes de neón; tales lámparas son económicas y se usan como luces nocturnas y de seguridad. El neón es incoloro, inodoro e insípido; es gas en condiciones normales. El neón no forma ningún compuesto químico en el sentido general de la palabra; hay solamente un átomo en cada molécula de gas neón.
- 22. Sodio - Na lemento químico, símbolo Na, número atómico 11 y peso atómico 22.9898. Es un metal suave, reactivo y de bajo punto de fusión, con una densidad relativa de 0.97 a 20ºC (68ºF). Desde el punto de vista comercial, el sodio es el más importante de los metales alcalinos. El sodio ocupa el sexto lugar por su abundancia entre todos los elementos de la corteza terrestre, que contiene el 2.83% de sodio en sus formas combinadas. El sodio es, después del cloro, el segundo elemento más abundante en solución en el agua de mar. Las sales de sodio más importantes que se encuentran en la naturaleza son el cloruro de sodio (sal de roca), el carbonato de sodio (sosa y trona), el borato de sodio (bórax), el nitrato de sodio (nitrato de Chile) y el sulfato de sodio. Las sales de sodio se encuentran en el agua de mar, lagos salados, lagos alcalinos y manantiales minerales. El sodio reacciona con rapidez con el agua, y también con nieve y hielo, para producir hidróxido de sodio e hidrógeno. Cuando se expone al aire, el sodio metálico recién cortado pierde su apariencia plateada y adquiere color gris opaco por la formación de un recubrimiento de óxido de sodio. El sodio no reacciona con nitrógeno, incluso a temperaturas muy elevadas, pero puede reaccionar con amoniaco para formar amida de sodio. El sodio y el hidrógeno reaccionan arriba de los 200ºC (390ºF) para formar el hidruro de sodio. El sodio reacciona difícilmente con el carbono, si es que reacciona, pero sí lo hace con los halógenos. También reacciona con varios halogenuros metálicos para dar el metal y cloruro de sodio. El sodio no reacciona con los hidrocarburos parafínicos, pero forma compuesto de adición con naftaleno y otros compuestos aromáticos policíclicos y con aril alquenos. La reacción del sodio con alcoholes es semejante a la reacción del sodio con agua, pero menos rápida. Hay dos reacciones generales con halogenuros orgánicos. Una de éstas requiere la condensación de dos compuesto orgánicos que contengan halógenos al eliminar éstos. El segundo tipo de reacciones incluye el reemplazo del halógeno por sodio, para obtener un compuesto organosódico.
- 24. Magnesio - Mg Elemento químico, metálico, de símbolo Mg, colocado en el grupo IIa del sistema periódico, de número atómico 12, peso atómico 24.312. El magnesio es blanco plateado y muy ligero. Su densidad relativa es de 1.74 y su densidad de 1740 kg/m3 (0.063 lb/in3) o 108.6 lb/ft3). El magnesio se conoce desde hace mucho tiempo como el metal estructural más ligero en la industria, debido a su bajo peso y capacidad para formar aleaciones mecánicamente resistentes. Los iones magnesio disueltos en el agua forman depósitos en tuberías y calderas cuando el agua es dura, es decir, cuando contiene demasiado magnesio o calcio. Esto se puede evitar con los ablandadores de agua. Con una densidad de sólo dos tercios de la del aluminio, tiene incontables aplicaciones en casos en donde el ahorro de peso es de importancia. También tiene muchas propiedades químicas y metalúrgicas deseables que lo hacen apropiado en una gran variedad de aplicaciones no estructurales. Es muy abundante en la naturaleza, y se halla en cantidades importanes en muchos minerales rocosos, como la dolomita, magnesita, olivina y serpentina. Además se encuentra en el agua de mar, salmueras subterráneas y lechos salinos. Es el tercer metal estructural más abundante en la corteza terrestre, superado solamente por el aluminio y el hierro.
- 26. Aluminio - Al Elemento químico metálico, de símbolo Al, número atómico 13, peso atómico 26.9815, que pertenece al grupo IIIA del sistema periódico. El aluminio puro es blando y tiene poca resistencia mecánica, pero puede formar aleaciones con otros elementos para aumentar su resistencia y adquirir varias propiedades útiles. Las aleaciones de aluminio son ligeras, fuertes, y de fácil formación para muchos procesos de metalistería; son fáciles de ensamblar, fundir o maquinar y aceptan gran variedad de acabados. Por sus propiedades físicas, químicas y metalúrgicas, el aluminio se ha convertido en el metal no ferroso de mayor uso. El aluminio es el elemento metálico más abundante en la Tierra y en la Luna, pero nunca se encuentra en forma libre en la naturaleza. Se halla ampliamente distribuido en las plantas y en casi todas las rocas, sobre todo en las ígneas, que contienen aluminio en forma de minerales de alúmino silicato. Cuando estos minerales se disuelven, según las condiciones químicas, es posible precipitar el aluminio en forma de arcillas minerales, hidróxidos de aluminio o ambos. En esas condiciones se forman las bauxitas que sirven de materia prima fundamental en la producción de aluminio. El aluminio es un metal plateado con una densidad de 2.70 g/cm3 a 20ºC (1.56 oz/in3 a 68ºF). El que existe en la naturaleza consta de un solo isótopo, 2713Al. El aluminio cristaliza en una estructura cúbica centrada en las caras, con lados de longitud de 4.0495 angstroms. (0.40495 nanómetros). El aluminio se conoce por su alta conductividad eléctrica y térmica, lo mismo que por su gran reflectividad.
- 28. Silicio - Si Símbolo Si, número atómico 14 y peso atómico 28.086. El silicio es el elemento electropositivo más abundante de la corteza terrestre. Es un metaloide con marcado lustre metálico y sumamente quebradizo. Por lo regular, es tetravalente en sus compuestos, aunque algunas veces es divalente, y es netamente electropositivo en su comportamiento químico. Además, se conocen compuestos de silicio pentacoordinados y hexacoordinados. El silicio elemental crudo y sus compuestos intermetálicos se emplean como integrantes de aleaciones para dar mayor resistencia al aluminio, magnesio, cobre y otros metales. el silicio metalúrgico con pureza del 98-99% se utiliza como materia prima en la manufactura de compuestos organosilícicos y resinas de silicona, elastómeros y aceites. Los chips de silicio se emplean en circuitos integrados. Las células fotovoltaicas para la conversión directa de energía solar en eléctrica utilizan obleas cortadas de cristales simples de silicio de grado electrónico. El dióxido de silicio se emplea como materia prima para producir silicio elemental y carburo de silicio. Los cristales grandes de silicio se utilizan para cristales piezoeléctricos. Las arenas de cuarzo fundido se transforman en vidrios de silicio que se usan en los laboratorios y plantas químicas, así como en aislantes eléctricos. Se emplea una dispersión coloidal de silicio en agua como agente de recubrimiento y como ingrediente de ciertos esmaltes. El silicio natural contiene 92.2% del isótopo de masa número 28, 4.7% de silicio-29 y 3.1% de silicio-30. Además de estos isótopos naturales estables, se conocen varios isótopos radiactivos artificiales. El silicio elemental tiene las propiedades físicas de los metaloides, parecidas a las del germanio, situado debajo de él en el grupo IV de la tabla periódica. En su forma más pura, el silicio es un semiconductor intrínseco, aunque la intensidad de su semiconducción se ve enormemente incrementada al introducir pequeñas cantidades de impurezas. El silicio se parece a los metales en su comportamiento químico. Es casi tan electropositivo como el estaño y mucho más positivo que el germanio o el plomo. De acuerdo con este carácter más bien metálico, forma iones tetrapositivos y diversos compuestos covalentes; aparece como un ion negativo sólo en unos pocos siliciuros y como un constituyente positivo de oxiácidos o aniones complejos.
- 30. Fósforo - P Símbolo P, número atómico 15, peso atómico 30.9738. El fósforo forma la base de gran número de compuestos, de los cuales los más importantes son los fosfatos. En todas las formas de vida, los fosfatos desempeñan un papel esencial en los procesos de transferencia de energía, como el metabolismo, la fotosíntesis, la función nerviosa y la acción muscular. Los ácidos nucleicos, que entre otras cosas forman el material hereditario (los cromosomas), son fosfatos, así como cierto número de coenzimas. Los esqueletos de los animales están formados por fosfato de calcio. Cerca de tres cuartas partes del fósforo total (en todas sus formas químicas) se emplean en Estados Unidos como fertilizantes. Otras aplicaciones importantes son como relleno de detergentes, nutrientes suplementarios en alimentos para animales, ablandadores de agua, aditivos para alimentos y fármacos, agentes de revestimiento en el tratamiento de superficies metálicas, aditivos en metalurgia, plastificantes, insecticidas y aditivos de productos petroleros. De casi 200 fosfatos minerales diferentes, sólo uno, la fluoropatita, Ca5F(PO4)3, se extrae esencialmente de grandes depósitos secundarios originados en los huesos de animales y que se hallan en el fondo de mares prehistóricos, y de los guanos depositados sobre rocas antiguas. La investigación de la química del fósforo indica que pueden existir tantos compuestos basados en el fósforo como los de carbono. En química orgánica se acostumbra agrupar varios compuestos químicos dentro de familias llamadas series homólogas.
- 32. Azufre - S Elemento químico, S, de número atómico 16. Los isótopos estables conocidos y sus porcentajes aproximados de abundancia en el azufre natural son éstos: 32S (95.1%); 33S (0.74%); 34S (4.2%) y 36S (0.016%). La proporción del azufre en la corteza terrestre es de 0.03-0.1%. Con frecuencia se encuentra como elemento libre cerca de las regiones volvánicas (depósitos impuros). Propiedades: Los alótropos del azufre (diferentes formas cristalinas) han sido estudiados ampliamente, pero hasta ahora las diversas modificaciones en las cuales existen para cada estado (gas, líquido y sólido) del azufre elemental no se han dilucidado por completo. El azufre rómbico, llamado también azufre y azufre alfa, es la modificación estable del elemento por debajo de los 95.5ºC (204ºF, el punto de transición), y la mayor parte de las otras formas se revierten a esta modificación si se las deja permanecer por debajo de esta temperatura. El azufre rómbico es de color amarillo limón, insoluble en agua, ligeramente soluble en alcohol etílico, éter dietílico y benceno, y es muy soluble en disulfuro de carbono. Su densidad es 2.07 g/cm3 (1.19 oz/in3) y su dureza es de 2.5 en la escala de Mohs. Su fórmula molecular es S8. El azufre monoclínico, llamado también azufre prismático y azufre beta, es la modificación estable del elemento por encima de la temperatura de transición y por debajo del punto de fusión. El azufre fundido se cristaliza en prismas en forma de agujas que son casi incoloras. Tiene una densidad de 1.96 g/cm3 (1.13 oz/in3) y un punto de fusión de 119.0ºC (246.7ºF). Su fórmula molecular también es S8.
- 34. Cloro - Cl lemento químico, símbolo Cl, de número atómico 17 y peso atómico 35.453. El cloro existe como un gas amarillo-verdoso a temperaturas y presiones ordinarias. Es el segundo en reactividad entre los halógenos, sólo después del flúor, y de aquí que se encuentre libre en la naturaleza sólo a las temperaturas elevadas de los gases volcánicos. Se estima que 0.045% de la corteza terrestre es cloro. Se combina con metales, no metales y materiales orgánicos para formar cientos de compuestos. Propiedades: El cloro presente en la naturaleza se forma de los isótopos estables de masa 35 y 37; se han preparado artificialmente isótopos radiactivos. El gas diatómico tiene un peso molecular de 70.906. El punto de ebullición del cloro líquido (de color amarillo-oro) es –34.05ºC a 760 mm de Hg (101.325 kilopascales) y el punto de fusión del cloro sólido es –100.98ºC. La temperatura crítica es de 144ºC; la presión crítica es 76.1 atm (7.71 megapascales); el volumen crítico es de 1.745 ml/g, y la densidad en el punto crítico es de 0.573 g/ml. Las propiedades termodinámicas incluyen el calor de sublimación, que es de 7370 (+-) 10 cal/mol a OK; el calor de vaporización , de 4878 (+-) 4 cal/mol; a –34.05ºC; el calor de fusión, de 1531 cal/mol; la capacidad calorífica, de 7.99 cal/mol a 1 atm (101.325 kilopascales) y 0ºC, y 8.2 a 100ºC. El cloro es uno de los cuatro elementos químicos estrechamente relacionados que han sido llamados halógenos. El flúor es el más activo químicamente; el yodo y el bromo son menos activos. El cloro reemplaza al yodo y al bromo de sus sales. Interviene en reacciones de sustitución o de adición tanto con materiales orgánicos como inorgánicos. El cloro seco es algo inerte, pero húmedo se combina directamente con la mayor parte de los elementos.
- 36. Argón - Ar Elemento químico con símbolo Ar, número atómico 15 y peso atómico 39.948. El argón es el tercer miembro del grupo 0 en la tabla periódica. Los elementos gaseosos de este grupo se llaman gases nobles, inertes o raros, aunque en realidad el argón no es raro. La atmósfera de la Tierra es la única fuente de argón; sin embargo, se encuentran trazas de este gas en minerales y meteoritos. El argón constituye el 0.934% del volumen de la atmósfera de la Tierra. De él, el 99.6% es el isótopo de argón-40; el restante es argón-36 y argón-38. Existe evidencia de que todo el argón-40 del aire se produjo por la descomposición radiactiva del radioisótopo potasio-40. El argón es incoloro, inodoro e insípido. En condiciones normales es un gas pero puede licuarse y solidificarse con facilidad. El argón no forma compuestos químicos en el sentido normal de la palabra, aunque forma algunos compuestos clatratos débilmente enlazados con agua, hidroquinona y fenol. Las moléculas de argón gaseoso son monoatómicas. El uso en gran escala más antiguo del argón es en lámparas eléctricas o bombillas. El corte y soldadura de metales consume la mayor parte del argón. Los procesos metalúrgicos constituyen la aplicación de más rápido crecimiento. El argón y las mezclas de argón- kriptón se utilizan, con un poco de vapor de mercurio, para llenar lámparas fluorescentes. El argón mezclado con algo de neón se utiliza para llenar tubos fluorescentes de descarga eléctrica empleados en letreros de propaganda (parecidos a los anuncios de neón); esto se hace cuando se desea un color azul o verde en lugar del color rojo del neón. El argón se utiliza también para llenar tiratrones de contadores de radiación Geiger-Müller, en cámaras de ionización con las que se mide la radiación cósmica y tubos electrónicos de varias clases. La atmósfera de argón se utiliza en la manipulación de reactivos químicos en el laboratorio y en el sellado de empaques de estos materiales.
- 38. Potasio - K Elemento químico, símbolo K, número atómico 19 y peso atómico 39.098. Ocupa un lugar intermedio dentro de la familia de los metales alcalinos después del sodio y antes del rubidio. Este metal reactivo es ligero y blando. Se parece mucho al sodio en su comportamiento en forma metálica. El cloruro de potasio se utiliza principalmente en mezclas fertilizantes. Sirve también como material de partida para la manufactura de otros compuestos de potasio (potacio). El hidróxido de potasio se emplea en la manufactura de jabones líquidos y el carbonato de potasio para jabones blandos. El carbonato de potasio es también un material de partida importante en la industria del vidrio. El nitrato de potasio se utiliza en fósforos, fuegos pirotécnicos y en artículos afines que requieren un agente oxidante. El potasio es un elemento muy abundante y es el séptimo entre todos los elementos de la corteza terrestre; el 2.59% de ella corresponde a potasio en forma combinada. El agua de mar contiene 380 ppm, lo cual significa que el potasio es el sexto más abundante en solución. Es más reactivo aún que el sodio y reacciona vigorosamente con el oxígeno del aire para formar el monóxido, K2O, y el peróxido, K2O2. En presencia de un exceso de oxígeno, produce fácilmente el superóxido, KO2. El potasio no reacciona con el nitrógeno para formar nitruro, ni siquiera a temperaturas elevadas. Con hidrógeno reacciona lentamente a 200ºC (390ºF) y con rapidez a 350-400ºC (660-752ºF). Produce el hidruro menos estable de todos los metales alcalinos.
- 40. Calcio - Ca Elemento químico, Ca, de número atómico 20; es el quinto elemento y el tercer metal más abundante en la corteza terrestre. Los compuestos de calcio constituyen 3.64% de la corteza terrestre. El metal es trimorfo, más duro que el sodio, pero más blando que el aluminio. Al igual que el berilio y el aluminio, pero a diferencia de los metales alcalinos, no causa quemaduras sobre la piel. Es menos reactivo químicamente que los metales alcalinos y que los otros metales alcalinotérreos. La distribución del calcio es muy amplia; se encuentra en casi todas las áreas terrestres del mundo. Este elemento es esencial para la vida de las plantas y animales, ya que está presente en el esqueleto de los animales, en los dientes, en la cáscara de los huevos, en el coral y en muchos suelos. El cloruro de calcio se halla en el agua del mar en un 0.15%. Los iones calcio disueltos en el agua forman depósitos en tuberías y calderas cuando el agua es dura, es decir, cuando contiene demasiado calcio o magnesio. Esto se puede evitar con los ablandadores de agua. El calcio metálico se prepara en la industria por electrólisis del cloruro de calcio fundido. Éste se obtiene por tratamiento de los minerales de carbonato con ácido clorhídrico o como un desperdicio del proceso Solvay de los carbonatos. El metal puro puede ser maquinado en torno, hilado, serrado, extruido; se le puede convertir en alambre, prensar y amartillar en placas. El calcio forma una película fina de óxido y nitruro en el aire, la cual lo protege de un ataque posterior. Se quema en el aire a temperatura elevada para producir principalmente nitruro. El metal producido en forma comercial reacciona fácilmente con el agua y los ácidos y produce hidrógeno que contiene cantidades notables de amoniaco e hidrocarburos como impurezas.
- 42. Escandio - Sc Elemento químico, símbolo Sc, número atómico 21 y peso atómico 44.956. Es el primer elemento de transición del primer periodo largo. Los isótopos del escandio son 40Sc y 51 Sc y uno correspondiente a cada valor intermedio. Excepto 45Sc, presente en la naturaleza, los isótopos se obtienen durante reacciones nucleares. El óxido y otros compuestos del escandio se emplean como catalizadores en la conversión de ácido acético en acetona, en la manufactura de propanol y en la conversión de ácidos dicarboxílicos en cetonas y compuestos cíclicos. El tratamiento con solución de sulfato de escandio es un medio económico para mejorar la germinación de semillas de muchas especies vegetales. El escandio-47 tiene una vida media adecuada para su empleo como trazador y se puede preparar sin transportador. La presencia de un 2.5- 25% de átomos de escandio en el ánodo incrementa el voltaje, la estabilidad de éste y la vida de las baterías alcalinas de níquel. El m¡neral principal del escandio es la thortveitita, que se encuentra en formaciones graníticas (pegmatita) y en algunos minerales de estaño, tungsteno y de las tierras raras. Está ampliamente distribuido en muchas partes del mundo.
- 44. Titanio - Ti Elemento químico, Ti, de número atómico 22 y peso atómico 47.90. Mientras que su comportamiento químico muestra muchas semejanzas con el del silicio y el zirconio, como un elemento del primer grupo de transición, la química de la solución acuosa, especialmente de los estados de oxidación más bajos, tiene algunas semejanzas con la del cromo y el vanadio. El principal estado de valencia es 4+, aunque también se conocen los estados 3+ y 2+, que son menos estables. El elemento arde al aire cuando se calienta para obtener el dióxido, TiO2, y cuando se combina con halógenos. Reduce el vapor de agua para formar el dióxido e hidrógeno, y reacciona de manera parecida con ácidos concentrados calientes, aunque forma el tricloruro con ácido clorhídrico. El metal absorbe hidrógeno para dar composiciones aproximadamente de TiH2, y forma el nitruro, TiN, y el carburo, TiC. Se conocen el sulfuro TiS2, así como los óxidos más bajos, Ti2O3 y TiO, y los sulfuros Ti2S3 y TiS. Se conocen sales de los tres estados de valencia. El dióxido de titanio, TiO2, se encuentra comúnmente en una forma negra o de color castaño conocida como rutilo. Las formas naturales que se encuentran menos en la naturaleza son la anatasita y la brooquita. Tanto el rutilo como la anatasita puros son de color blanco. El óxido básico negro, FeTiO3, se encuentra en forma natural como el mineral llamado ilmenita; éste es la principal fuente comercial del titanio.
- 46. Vanadio - V Elemento químico de símbolo V, número atómico 23, peso atómico 50.942. Es un metal que se utilizó inicialmente en aleaciones con hierro y acero. Varios de los compuestos de vanadio se emplean en la industria química, sobre todo en la fabricación de catalizadores de oxidación, y en la industria cerámica como agentes colorantes. El vanadio se parece a algunos otros elementos de transición en que forma muchos compuestos que con frecuencia son complejos por su valencia variable. Tiene al menos tres estados de oxidación, 2+, 3+ y 5+. Es anfótero, principalmente básico en los estados de oxidación bajos y ácido en los altos. Forma derivados de radicales más o menos bien definidos, tales como VO2+ y VO3+. En su forma pura es blando y dúctil. Puede trabajarse en caliente y frío fácilmente, pero debe calentarse en una atmósfera inerte o al vacío a causa de que se oxida rápido a temperaturas por encima del punto de fusión de su óxido. El metal retiene muy bien su fuerza a temperaturas elevadas. La resistencia del vanadio a los ácidos clorhídrico y sulfúrico es notable y resiste el ataque del agua salada aereada mejor que la mayor parte de los aceros inoxidables. Sin embargo, el vanadio no resiste al ácido nítrico.
- 48. Cromo - Cr Elemento químico, símbolo Cr, número atómico 24, peso atómico 51.996; metal que es de color blanco plateado, duro y quebradizo. Sin embargo, es relativamente suave y dúctil cuando no está tensionado o cuando está muy puro. Sus principales usos son la producción de aleaciones anticorrosivas de gran dureza y resistentes al calor y como recubrimiento para galvanizados. El cromo elemental no se encuentra en la naturaleza. Su mineral más importante por abundancia es la cromita. Es de interés geoquímico el hecho de que se encuentre 0.47% de Cr2O3 en el basalto de la Luna, proporción que es de 3-20 veces mayor que el mismo espécimen terrestre. Existen cuatro isótopos naturales del cromo, 50Cr, 52Cr, 53Cr, 54Cr, Se han producido diversos isótopos inestables mediante reacciones radioquímicas. El más importante es el 51Cr, el cual emite rayos gamma débiles y tiene un tiempo de vida media aproximadamente de 27 días. El cromo galvanizado y pulido es de color blanco azuloso brillante. Su poder reflejante es 77% del de la plata. Sus propiedades mecánicas, incluyendo su dureza y la resistencia a la tensión, determinan la capacidad de utilización. El cromo tiene una capacidad relativa baja de forjado, enrollamiento y propiedades de manejo. Sin embargo, cuando se encuentra absolutamente libre de oxígeno, hidrógeno, carbono y nitrógeno es muy dúctil y puede ser forjado y manejado. Es difícil de almacenarlo libre de estos elementos.
- 50. Manganeso - Mn Elemento químico, símbolo Mn, de número atómico 25 y peso atómico 54.938. Es uno de los metales de transición del primer periodo largo de la tabla periódica; se encuentra entre el cromo y el hierro. Tiene propiedades en común con ambos metales. Aunque poco conocido o usado en su forma pura, reviste gran importancia práctica en la fabricación de acero. El manganeso se oxida con facilidad en el aire para formar una capa castaña de óxido. También lo hace a temperaturas elevadas. A este respecto su comportamiento es más parecido a su vecino de mayor número atómico en la tabla periódica ( el hierro), que al de menor número atómico, el cromo. El manganeso es un metal bastante reactivo. Aunque el metal sólido reacciona lentamente, el polvo metálico reacciona con facilidad y en algunos casos, muy vigorosamente. Cuando se calienta en presencia de aire u oxígeno, el manganeso en polvo forma un óxido rojo, Mn3O4. Con agua a temperatura ambiente se forman hidrógeno e hidróxido de manganeso(II), Mn(OH)2. En el caso de ácidos, y a causa de que el manganeso es un metal reactivo, se libera hidrógeno y se forma una sal de manganeso(II). El manganeso reacciona a temperaturas elevadas con los halógenos, azufre, nitrógeno, carbono, silicio, fósforo y boro. En sus muchos compuestos, presenta estados de oxidación de 1+ hasta de 7+. Los estados de oxidación más comunes son 2+, 4+ y 7+. Todos los compuestos, excepto los que contienen MnII, son intensamente coloridos. Por ejemplo, el permanganato de potasio, KmnO4, produce soluciones acuosas que son de color rojo púrpura; el manganato de potasio, K2MnO4, produce soluciones de color verde intenso.
- 52. Hierro - Fe Elemento químico, símbolo Fe, número atómico 26 y peso atómico 55.847. El hierro es el cuarto elemento más abundante en la corteza terrestre (5%). Es un metal maleable, tenaz, de color gres plateado y magnético. Los cuatro isótopos estables, que se encuentran en la naturaleza, tienen las masas 54, 56, 57 y 58. Los dos minerales principales son la hematita, Fe2O3, y la limonita, Fe2O3.3H2O. Las piritas, FeS2, y la cromita, Fe(CrO2)2, se explotan como minerales de azufre y de cromo, respectivamente. El hierro se encuentra en muchos otros minerales y está presente en las aguas freáticas y en la hemoglobina roja de la sangre. La presencia del hierro en el agua provoca precipitación y coloración no deseada. Existen técnicas de separación del hierro del agua. El uso más extenso del hierro (fierro) es para la obtención de aceros estructurales; también se producen grandes cantidades de hierro fundido y de hierro forjado. Entre otros usos del hierro y de sus compuestos se tienen la fabricación de imanes, tintes (tintas, papel para heliográficas, pigmentos pulidores) y abrasivos (colcótar). Exiten varias forma alotrópicas del hierro. La ferrita es estable hasta 760ºC (1400ºF). El cambio del hierro B comprende principalmente una pérdida de permeabilidad magnética porque la estructura de la red (cúbica centrada en el cuerpo) permanece inalterada. La forma alotrópica tiene sus átomos en arreglos cúbicos con empaquetamiento cerrado y es estable desde 910 hasta 1400ºC (1670 hasta 2600ºF).
- 54. Cobalto - Co Elemento químico metálico, Co, con número atómico de 27 y un peso atómico de 58.93. El cobalto se parece al hierro y al níquel, tanto en estado libre como combinado. Se encuentra distribuido con amplitud en la naturaleza y forma, aproximadamente, el 0.001% del total de las rocas ígneas de la corteza terrestre, en comparación con el 0.02% del níquel. Se halla en meteoritos, estrellas, en el mar, en aguas dulces, suelos, plantas, animales y en los nódulos de manganeso encontrados en el fondo del océano. Se observan trazas de cobalto en muchos minerales de hierro, níquel, cobre, plata, manganeso y zinc; pero los minerales de cobalto importantes en el comercio son los arseniuros, óxidos y sulfuros. El cobalto y sus aleaciones son resistentes al desgaste y a la corrosión, aun a temperaturas elevadas. Entre sus aplicaciones comerciales más importantes están; la preparación de aleaciones para uso a temperaturas elevadas, aleaciones magnéticas, aleaciones para máquinas y herramientas, sellos vidrio a metal y la aleación dental y quirúrgica llamada vitallium. Las plantas y los animales necesitan cantidades pequeñas de cobalto. Su isótopo radiactivo producido artificialmente, cobalto-60, se utiliza mucho en la industria, la investigación y la medicina. El cobalto es ferromagnético y se parece al hierro y al níquel, en su dureza, resistencia a la tensión, capacidad de uso en maquinaria, propiedades térmicas y comportamiento electroquímico. Al metal no lo afectan el agua ni el aire en condiciones normales, y lo atacan con rapidez el ácido sulfúrico, el ácido clorhídrico y el ácido nítrico; pero el ácido fluorhídrico, el hirdróxido de amonio y el hidróxido de sodio lo atacan lentamente. El cobalto presenta valencias variables y forma iones complejos y compuestos colerados, como hacen todos los compuestos de transición. La tabla siguiente resume sus propiedades.
- 56. Níquel - Ni Símbolo Ni, número atómico 28, metal duro, blanco plateado, dúctil y maleable. La masa atómica del níquel presente en la naturaleza es 58.71. El níquel tiene cinco isótopos naturales con masas atómicas de 58, 60, 61, 62, 64. También se han identificado siete isótopos radiactivos, con números de masa de 56, 57, 59, 63, 65, 66 y 67. La mayor parte del níquel comercial se emplea en el acero inoxidable y otras aleaciones resistentes a la corrosión. También es importante en monedas como sustituto de la plata. El níquel finamente dividido se emplea como catalizador de hidrogenación. El níquel es un elemento bastante abundante, constituye cerca de 0.008% de la corteza terrestre y 0.01% de las rocas ígneas. En algunos tipos de meteoritos hay cantidades apreciables de níquel, y se piensa que existen grandes cantidades en el núcleo terrestre. Dos minerales importantes son los sulfuros de hierro y níquel, pentlandita y pirrotita (Ni, Fe)xSy; el mineral garnierita, (Ni, Mg)SiO3.nH2O, también es importante en el comercio. El níquel se presenta en pequeñas cantidades en plantas y animales. Está presente en pequeñas cantidades en el agua de mar, el petróleo y en la mayor parte del carbón. El níquel metálico es fuerte y duro (3.8 en la escala de Mohs), Cuando está finamente dividido, es de color negro. La densidad del níquel es 8.90 veces la del agua a 20ºC (68ºF); se funde a 1455ºC (2651ºF) y hierve a 2840ºC (5144ºF); es sólo moderadamente reactivo. Resiste la corrosión alcalina y no se inflama en trozos grandes, pero los alambres muy finos pueden incendiarse. Está por encima del hidrógeno en la serie electroquímica; se disuelve con lentitud en ácidos diluidos liberando hidrógeno. En forma metálica es un agente reductor fuerte.
- 58. Cobre - Cu Elemento químico, de símbolo Cu, con número atómico 29; uno de los metales de transición e importante metal no ferroso. Su utilidad se debe a la combinación de sus propiedades químicas, físicas y mecánicas, así como a sus propiedades eléctricas y su abundancia. El cobre fue uno de los primeros metales usados por los humanos. La mayor parte del cobre del mundo se obtiene de los sulfuros minerales como la calcocita, covelita, calcopirita, bornita y enargita. Los minerales oxidados son la cuprita, tenorita, malaquita, azurita, crisocola y brocantita. El cobre natural, antes abundante en Estados Unidos, se extrae ahora sólo en Michigan. El grado del mineral empleado en la producción de cobre ha ido disminuyendo regularmente, conforme se han agotado los minerales más ricos y ha crecido la demanda de cobre. Hay grandes cantidades de cobre en la Tierra para uso futuro si se utilizan los minerales de los grados más bajos, y no hay probabilidad de que se agoten durante un largo periodo. El cobre es el primer elemento del subgrupo Ib de la tabla periódica y también incluye los otros metales de acuñación, plata y oro. Su átomo tiene la estructura electrónica 1s22s22p63s23p63d104s1. El bajo potencial de ionización del electrón 4s1 da por resultado una remoción fácil del mismo para obtener cobre(I), o ion cuproso, Cu+, y el cobre(II), o ion cúprico, Cu2+, se forma sin dificultad por remoción de un electrón de la capa 3d. El peso atómico del cobre es 63.546. tiene dos isótopos naturales estables 63Cu y 65Cu. También se conocen nueve isótopos inestables (radiactivos). El cobre se caracteriza por su baja actividad química. Se combina químicamente en alguno de sus posibles estados de valencia. La valencia más común es la de 2+ (cúprico), pero 1+ (cuproso) es también frecuente; la valencia 3+ ocurre sólo en unos cuantos compuestos inestables.
- 60. Zinc - Zn Elemento químico de símbolo Zn, número atómico 30 y peso atómico 65.37. Es un metal maleable, dúctil y de color gris. Se conocen 15 isótopos, cinco de los cuales son estables y tienen masas atómicas de 64, 66, 67, 68 y 70. Cerca de la mitad del zinc común se encuentra como isótopo de masa atómica 64. Los usos más importantes del zinc los constituyen las aleaciones y el recubrimiento protector de otros metales. El hierro o el acero recubiertos con zinc se denominan galvanizados, y esto puede hacerse por inmersión del artículo en zinc fundido (proceso de hot- dip), depositando zinc electrolíticamente sobre el artículo como un baño chapeado (electrogalvanizado), exponiendo el artículo a zinc en polvo cerca de su punto de fusión (sherardizing) o rociándolo con zinc fundido (metalizado). El zinc es uno de los elementos menos comunes; se estima que forma parte de la corteza terrestre en un 0.0005-0.02%. Ocupa el lugar 25 en orden de abundancia entre los elementos. Su principal mineral es la blenda, marmatita o esfalerita de zinc, ZnS. Es un elemento esencial para el desarrollo de muchas clases de organismos vegetales y animales. La deficiencia de zinc en la dieta humana deteriora el crecimiento y la madurez y produce también anemia. La insulina es una proteína que contiene zinc. El zinc está presente en la mayor parte de los alimentos, especialmente en los que son ricos en proteínas. En promedio, el cuerpo humano contiene cerca de dos gramos de zinc. El zinc puro y recientemente pulido es de color blanco azuloso, lustroso y moderadamente duro (2.5 en la escala de Mohs). El aire húmedo provoca su empañamiento superficial, haciendo que tenga color gris. El zinc puro es dúctil y maleable pudiéndose enrollar y tensar, pero cantidades pequeñas de otros metales como contaminantes pueden volverlo quebradizo. Se funde a 420ºC (788ºF) y hierve a 907ºC (1665ºF). Su densidad es 7.13 veces mayor que la del agua, ya que un pie cúbico (0.028m3) pesa 445 Ib (200 Kg).
- 62. Galio - Ga Elemento químico, símbolo Ga, número atómico 31 y peso atómico 69.72. lo descubrió Lecoq de Boisbaudran en Francia en 1875. Tiene un gran intervalo de temperatura en el estado líquido, y se ha recomendado su uso en termómetros de alta temperatura y manómetros. En aleación con plata y estañó, el galio suple en forma adecuada la amalgama en curaciones dentales; también sirve para soldar materiales no metálicos, incluyendo gemas o amtales. El arseniuro de galio puede utilizarse en sistemas para transformar movimiento mecánico en impulsos eléctricos. Los artículos sintéticos superconductores pueden prepararse por la fabricación de matrices porosas de vanadio o tántalo impregnados con hidruro de galio. El galio ha dado excelentes resultados como semiconductor para uso en rectificadores, transistores, fotoconductores, fuentes de luz, diodos láser o máser y aparatos de refrigeración. El galio sólido parece gris azulado cuando se expone a la atmósfera. El galio líquido es blanco plateado, con una superficie reflejante brillante. Su punto de congelación es más bajo que el de cualquier metal con excepción del mercurio (-39ºC o -38ºF) y el cesio (28.5ºC u 83.3ºF). El galio es semejante químicamente al aluminio. Es anfótero, pero poco más ácido que el aluminio. La valencia normal del galio es 3+ y forma hidróxidos, óxidos y sales. El galio funde al contacto con el aire cuando se calienta a 500ºC (930ºF). Reacciona vigorosamente con agua hirviendo, pero ligeramente con agua a temperatura ambiente. Las sales de galio son incoloras; se preparan de manera directa a partir del metal, dado que la purificación de éste es más simple que la de sus sales.
- 64. Germanio - Ge Elemento químico, metálico, gris plata, quebradizo, símbolo Ge, número atómico 32, peso atómico 72.59, punto de fusión 937.4ºC (1719ºF) y punto de ebullición 2830ºC (5130ºF), con propiedades entre el silicio y estaño. El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millon (ppm). El germanio se halla como sulfuro o está asociado a los sulfuros minerales de otros elementos, en particular con los del cobre, zinc, plomo, estaño y antimonio. El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales. A temperatura ambiente hay poca indicación de flujo plástico y, en consecuencia, se comporta como un material quebradizo. El germanio es divalente o tetravalente. Los compuestos divalentes (óxido, sulfuro y los halogenuros) se oxidan o reducen con facilidad. Los compuestos tetravalentes son más estables. Los compuestos organogermánicos son numerosos y, en este aspecto, el germanio se parece al silicio. El interés en los compuestos organogermánicos se centra en su acción biológica. El germanio y sus derivados parecen tener una toxicidad menor en los mamíferos que los compuestos de estaño o plomo. Las propiedades del germanio son tales que este elemento tiene varias aplicaciones importantes, especialmente en la industria de los semiconductores. El primer dispositivo de estado sólido, el transistor, fue hecho de germanio. Los cristales especiales de germanio se usan como sustrato para el crecimiento en fase vapor de películas finas de GaAs y GaAsP en algunos diodos emisores de luz. Se emplean lentes y filtros de germanio en aparatos que operan en la región infrarroja del espectro. Mercurio y cobre impregnados de germanio son utilizados en detectores infrarrojos; los granates sintéticos con propiedades magnéticas pueden tener aplicaciones en los dispositivos de microondas para alto poder y memoria de burbuja magnética; los aditivos de germanio incrementa los amper-horas disponibles en acumuladores.
- 66. Arsénico - As Elemento químico, cuyo símbolo es As y su número atómico, 33. El arsénico se encuentra distribuido ampliamente en la naturaleza (cerca de 5 x 10-4% de la corteza terrestre). Es uno de los 22 elementos conocidos que se componen de un solo nucleido estable, 7533As; el peso atómico es de 74.922. Se conocen otros 17 nucleidos radiactivos de As. Existen tres alótropos o modificaciones polimórficas del arsénico. La forma a cúbica de color amarillo se obtiene por condensación del vapor a muy bajas temperaturas. La b polimórfica negra, que es isoestructural con el fósforo negro. Ambas revierten a la forma más estable, la l , gris o metálica, del arsénico romboédrico, al calentarlas o por exposición a la luz. La forma metálica es un conductor térmico y eléctrico moderado, quebradizo, fácil de romper y de baja ductibilidad. Al arsénico se le encuentra natural como mineral de cobalto, aunque por lo general está en la superficie de las rocas combinado con azufre o metales como Mn, Fe, Co, Ni, Ag o Sn. El principal mineral del arsénico es el FeAsS (arsenopirita, pilo); otros arseniuros metálicos son los minerales FeAs2 (löllingita), NiAs (nicolita), CoAsS (cobalto brillante), NiAsS (gersdorfita) y CoAs2 (esmaltita). Los arseniatos y tioarseniatos naturales son comunes y la mayor parte de los minerales de sulfuro contienen arsénico. La As4S4 (realgarita) y As4S6 (oropimente) son los minerales más importantes que contienen azufre. El óxido, arsenolita, As4O6, se encuentra como producto de la alteración debida a los agentes atmosféricos de otros minerales de arsénico, y también se recupera de los polvos colectados de los conductos durante la extracción de Ni, Cu y Sn; igualmente se obtiene al calcinar los arseniuros de Fe, Co o Ni con aire u óxigeno. El elemento puede obtenerse por calcinación de FeAsS o FeAs2 en ausencia de aire o por reducción de As4O6 con carbonato, cuando se sublima As4.
- 68. Selenio - Se Elemento químico, símbolo Se, número atómico 34 y peso atómico 78.96. Sus propiedades son semejantes a las del telurio. La abundancia de este elemento, ampliamente distribuido en la corteza terrestre, se estima aproximadamente en 7 x 10-5% por peso, encontrándose en forma de seleniuros de elementos pesados y, en menor cantidad, como elemento libre en asociación con azufre elemental. Sus minerales no se encuentran en suficiente cantidad para tener utilidad, como fuente comercial del elemento, y por ello los minerales de sulfuro de cobre seleníferos son los que representan la fuente primaria. Los empleos más importantes del selenio son el proceso de fotocopiado xerográfico, la decoloración de vidrios teñidos por compuestos de hierro, y también se usa como pigmento en plásticos, pinturas, barnices, vidrio y cerámica y tintas. Su utilización en rectificadores ha disminuido por el mayor empleo del silicio y el germanio en esta aplicación. El selenio se emplea también en exposímetros fotográficos y como aditivo metalúrgico que mejora la capacidad de ciertos aceros para ser maquinados. El selenio arde en el aire con una flama azul para dar dióxido de selenio, SeO2. El elemento también reacciona directamente con diversos metales y no metales, entre ellos el hidrógeno y los halógenos. Los ácidos no oxidantes, no reaccionan con el selenio; pero el ácido nítrico, el ácido sulfúrico concentrado y los hidróxidos alcalinos fuertes lo disuelven. El único compuesto importante del selenio con hidrógeno es el seleniuro de hidrógeno, H 2Se, gas venenoso incoloro e inflamable con un olor desagradable, gran toxicidad y estabilidad térmica menor que la del sulfuro de hidrógeno. Disuelto en agua, el seleniuro de hidrógeno puede precipitar muchos iones de metales pesados como seleniuros muy poco solubles. Los compuestos orgánicos con enlaces C-Se son muchos e incluyen desde simples selenoles, RSeH; ácido selenénico, RseOH; haluros organil selénicos, RSeX; seleniuros diorganílicos y diseleniuros, R2Se y R2Se2, hasta moléculas que exhiben actividad biológica, como los selenoaminoácidos y los selenopéptidos.
- 70. Bromo - Br Elemento químico, Br, número atómico 35 y peso atómico 79.909, por lo común existe como Br2; líquido de olor intenso e irritante, rojo oscuro y de bajo punto de ebullición, pero de alta densidad. Es el único elemento no metálico líquido a temperatura y presión normales. Es muy reactivo químicamente; elemento del grupo de los halógenos, sus propiedades son intermedias entre las del cloro y las del yodo. Los estados de valencia más estables de las sales de bromo son 1- y 5+, aunque también se conocen 1+, 3+ y 7+. Dentro de amplios límites de temperatura y presión, las moléculas en el líquido y el vapor son diatómicas Br2, con un peso molecular de 159.818. Hay dos isótopos estables (79Br y 81Br) que existen en la naturaleza en proporciones casi idénticas, de modo que el peso atómico es de 79.909. Se conocen también varios radioisótopos. La solubilidad del bromo en agua a 20ºC (68ºF) es de 3.38 a/100 g (3.38 oz/100 oz) de solución, pero ésta se incrementa fuertemente en presencia de sus sales y de ácido bromhídrico. La capacidad de este elemento inorgánico para disolverse en disolventes orgánicos es de importancia considerable en sus reacciones. A pesar de que la corteza terrestre contiene de 1015 a 1016 toneladas de bromo, el elemento está distribuido en forma amplia y se encuentra en concentraciones bajas en forma de sales. La mayor parte del bromo recuperable se halla en la hidrosfera. El agua de mar contiene en promedio 65 partes por millón (ppm) de bromo. Las otras fuentes principales en Estados Unidos son salmueras subterráneas y lagos salados, con producción comercial en Michigan, Arkansas y California. Muchos bromuros inorgánicos tienen uso industrial, pero los orgánicos tienen una aplicación más amplia. Gracias a la facilidad de reacción con compuestos orgánicos, y a la fácil eliminación o desplazamiento posterior, los bromuros orgánicos se han estudiado y utilizado como intermediarios químicos. Además, las reacciones del bromo son tan limpias que pueden emplearse en el estudio de mecanismos de reacción sin la complicación de reacciones laterales. La capacidad del bromo para unirse a posiciones poco usuales de las moléculas orgánicas tiene un valor adicional como herramienta de investigación.
- 72. Kriptón - Kr Elemento químico gaseoso, símbolo Kr, número atómico 36 y peso atómico 83.80. El kriptón es uno de los gases nobles. Es un gas incoloro, inodoro e insípido. Su principal aplicación es el llenado de lámparas eléctricas y aparatos electrónicos de varios tipos. Se utilizan ampliamente mezclas de kriptón- argón para llenar lámparas fluorescentes. La única fuente comercial de kriptón estable es el aire, aunque se encuentran trazas en minerales y meteoritos. Una mezcla de isótopos estables y radiactivos de kriptón se produce en reactores nucleares a partir de uranio por fisión de neutrones, lenta. Se estima que aproximadamente 2 x 10- 8% del peso de la Tierra es kriptón. El kriptón se encuentra también fuera de nuestro planeta.
- 74. Rubidio - Rb Elemento químico de símbolo Rb, número atómico 37 y peso atómico 85.47. El rubidio es un metal alcalino, reactivo, ligero y de bajo punto de fusión. La mayor parte de los usos de rubidio metálico y de sus compuestos son los mismos que los del cesio y sus compuestos. El metal se utiliza en la manufactura de tubos de electrones, y las sales en la producción de vidrio y cerámica. El rubidio es un elemento bastante abundante en la corteza terrestre y está presente hasta en 310 partes por millón (ppm). Por su abundancia ocupa un lugar justamente por debajo del carbono y el cloro y por encima del flúor y del estroncio. El agua de mar contiene 0.2 ppm de rubidio, concentración que (aunque baja) es el doble de la concentración de litio. El rubidio es semejante al cesio y al litio en que está integrado en minerales complejos; no se encuentra en la naturaleza como sales simples de halogenuros, como ocurre con el sodio y el potasio. Tiene una densidad de 1.53 g/cm3 (95.5 lb/ft3), un punto de fusión de 38.9ºC (102ºF) y un punto de ebullición de 688ºC (1270ºF). Es tan reactivo con oxígeno que puede arder espontáneamente con este elemento puro. El metal pierde el brillo muy rápidamente al aire, forma un recubrimiento de óxido y puede arder. Los óxidos que se producen son una mezcla de Rb2O, Rb2O2 y RbO2. El metal fundido se inflama espontáneamente al aire. El rubidio reacciona violentamente con agua o hielo a temperaturas por debajo de –100ºC (- 148ºF). Reacciona con hidrógeno para formar un hidruro, uno de los hidruros alcalinos menos estables. No reacciona con nitrógeno. Con bromo o cloro, el rubidio reacciona vigorosamente con formación de flama. Se pueden preparar compuestos organorrubídicos con técnicas parecidas a las que se utilizan con el sodio y el potasio.
- 76. Estroncio - Sr Elemento químico, símbolo Sr, de número atómico 38 y peso atómico 87.62. El estroncio es el menos abundante de los metales alcalinotérreos. La corteza de la Tierra contiene el 0.042% de estroncio, y este elemento es tan abundante como el cloro y el azufre. Los principales minerales son la celestita, SrSO4, y la estroncianita, SrCO3. El nitrato de estrocio se emplea en pirotecnia, señalamiento de vías férreas y en fórmulas de balas trazadoras. El hidróxido de estroncio forma con cierto número de ácidos orgánicos jabones y grasas de estructura estable, resistentes a la oxidación y a la descomposición en una amplia gama de temperaturas. El estroncio es divalente en todos sus compuestos, que son, al igual que el hidróxido, el fluoruro y el sulfato, totalmente solubles. El estroncio es un formador de complejos más débiles que el calcio, formando unos cuantos oxi-complejos débiles con tartratos, citratos, etc.
- 78. Itrio - Y Símbolo Y, número atómico 39 y peso atómico 88.906, que se asemeja mucho a los elementos de tierras raras. El isótopo estable 89Y constituye el 100% del elemento natural, que casi siempre se encuentra asociado a las tierras raras y con frecuencia se clasifica como una de ellas. El itrio metálico absorbe hidrógeno, y cuando en aleaciones llega a una composición de YH2, se parece mucho a los metales. De hecho, en ciertos niveles de composición la aleación es mejor conductora de la electricidad que el metal puro. El itrio forma la matriz de los fósforos de itrio y europio activados, que emiten una luz brillante y roja clara cuando son excitados por electrones. La industria de la televisión utiliza esos fósforos en la manufactura de pantalla de televisión. El itrio se utiliza comercialmente en la industria metálica para aleaciones y como "atrapador" para eliminar oxígeno e impurezas no metálicas de otros metales. Para las propiedades del metal y sus sales.
- 80. Zirconio - Zr Elemento químico de símbolo, Zr, número atómico 40 y peso atómico 91.22. Se encuentran en la naturaleza los siguientes isótopos: 90, 91, 94 y 96. El zirconio es uno de los elementos más abundantes y está ampliamente distribuido en la corteza terrestre. Es muy reactivo químicamente y sólo se halla combinado. En la mayor parte de las reacciones se enlaza con oxígeno en preferencia sobre otros elementos, encontrándose en la corteza terrestre sólo como el óxido ZrO2, baddeleyita, o como parte de los complejos de óxido, como el zircón, la elpidita y la eudialita. Desde el punto de vista comercial, el zircón es su mineral más importante. El zirconio y hafnio son prácticamente indistinguibles en sus propiedades químicas, y sólo se les encuentra juntos. El mayor empleo del zirconio corresponde a sus compuestos para la industria cerámica: refractarios, vidriados, barnizados, moldes fundidos y arenas abrasivas, componentes de cerámica eléctrica. La incorporación del óxido de zirconio al vidrio incrementa significativamente su resistencia a los álcalis. El zirconio metálico se utiliza casi exclusivamente para el revestimiento de los elementos combustibles de uranio en las plantas nucleares. Otra aplicación significativa es la de los flash fotográficos. El zirconio es un metal lustroso, plateado, con una densidad de 6.49 g/cm3 a 20ºC. Se funde cerca de los 1852ºC. Se estima que su punto de ebullición es a los 3580ºC, pero ciertas observaciones sugieren que es cerca de los 8600ºC. Las energías libres de formación de sus compuestos indican que el zirconio reaccionaría sólo con cualesquiera de los no metales, excepto los gases inertes, a temperaturas comunes. En la práctica, se ha comprobado que el metal no es reactivo a la temperatura ambiente, porque se forma una capa de óxido invisible en la superficie. La capa hace que el metal sea pasivo, y permanece con brillo al aire indefinidamente. A temperaturas elevadas es muy reactivo con elementos no metálicos y muchos de los elementos metálicos, y forma compuestos sólidos y en solución.
- 82. Niobio - Nb Símbolo Nb, número atómico 41 y peso atómico 92.906. En Estados Unidos este elemento se llamó originalmente columbio. La industria metalúrgica y los metalurgistas aún utilizan este nombre antiguo. La mayor parte del niobio se usa en aceros inoxidables especiales, en aleaciones de alta temperatura y en aleaciones superconductoras como Nb3Sn. El niobio también se utiliza en pilas nucleares. Es muy inerte a todos los ácidos, menos el fluorhídrico, supuestamente por tener una película de óxido sobre la superficie. El niobio metálico se oxida lentamente en solución alcalina. Reacciona con el oxígeno y los halógenos en caliente para formar los halogenuros y el óxido en estado de oxidación V, con nitrógeno para formar NbN y con carbono para formar NbC, así como con otros elementos como arsénico, antimonio, teluro y selenio. El óxido Nb2O5, que se funde a 1520º (2768ºF), se disuelve en álcali fundido para formar un niobato complejo soluble, Nb6O198-. Los niobatos normales, entre ellos el NbO43-, son insolubles. El óxido se disuelve en ácido fluorhídrico para producir especies iónicas como NbOF52- y NbOF63-, según la concentración de los iones fluoruro e hidrógeno. El complejo fluorado mayor que puede existir en solución es NbF6-.
- 84. Molibdeno - Mo Elemento químico, símbolo Mo, con número atómico 42 y peso atómico 95.94; es uno de los elementos de transición. Metal gris plateado con una densidad de 10.2 g/cm3 (5907 oz/in3), se funde a 2610ºC (4730ºF). El molibdeno se encuentra en muchas partes del mundo, pero pocos depósitos son lo suficientemente ricos para garantizar la recuperación de los costos. La mayor parte del molibdeno proviene de minas donde su recuperación es el objetivo primario de la operación. El restante se obtiene como un subproducto de ciertas operaciones del beneficio del cobre. El molibdeno forma compuestos en los cuales presenta estados de oxidación, 0, 2+, 3+, 4+, 5+, 6+. No se ha observado como catión ionizable, pero se conocen especies catiónicas como el molibdenilo. La química del molibdeno es extremadamente compleja y, con excepción de los halogenuros y calcogenuros, son muy pocos los compuestos simples conocidos. El dióxido y el trióxido de molibdeno son los óxidos más comunes y estables; otros óxidos descritos son metaestables y, en lo esencial, son especies de laboratorio. El ácido molíbdico, H2MoO4 (o MoO3.H2O), forma una serie estable de sales normales, del tipo M22+MoO4, M2+MoO4 y M23+(MoO4)3. Se pueden formar molibdatos poliméricos o isopolimolibdatos por la acidificación de una solución de molibdato o, en algunos casos, al calentar los molibdatos normales. El peróxido de hidrógeno reacciona con varios molibdatos para formar una serie de compuestos peroxianiónicos. Otro grupo de compuestos del molibdeno son los heteropolielectrólitos, con mucho una familia fundamental de sales y ácidos libres: cada miembro contiene un anión complejo y de alto peso molecular. El molibdeno también forma halogenuros y oxihalogenuros, que representan un intervalo amplio en estabilidad y una serie de compuestos homólogos con S, Se y Te, semejantes a los óxidos.
- 86. Tecnecio - Tc Elemento químico de símbolo Tc y número atómico 43. Fue el primer elemento obtenido de manera artificial en un clclotrón. También se obtiene como el principal constituyente de los productos de fisión en un reactor nuclear o, en forma alterna, por la acción de neutrones sobre el 98Mo. El isótopo 99Tc es el más útil en la investigación química por su larga vida media: 2 x 105 años. La química del tecnecio se parece mucho a la del renio, y se han preparado algunos compuestos en muchos casos. Efectos del Tecnecio sobre la salud Se ha informado de que los acero no aleado, bajos en carbono, pueden estar protegidos efectivamente por una cantidad tan pequeña como 55 ppm de KTcO4 en agua destilada aireada a temperaturas de hasta 250oC. Esta protección contra la corrosión está limitada a los sistemas cerrados, ya que el tecnecio es radioactivo y debe estar confinado. El tecnecio 98 tiene una actividad específica de 6.2 x 108 Bq/g. Una actividad de este nivel no se puede permitir que se extienda. El tecnecio 99 es un peligroso contaminante y debe ser manejado en una caja de guantes.
- 88. Rutenio - Ru Elemento químico de símbolo Ru, número atómico 44 y peso atómico 101.07. El rutenio es un metal duro, blanco, manejable sólo a altas temperaturas y con dificultad. Es un excelente catalizador y se utiliza en reacciones que incluyen hidrogenación, isomerización, oxidación y reformación. Los usos del rutenio metálico puro son mínimos. Es un endurecedor eficaz para el platino y el paladio. Sus aleaciones con grandes porcentajes (30-70%) de rutenio y con otros metales preciosos han sido utilizadas para contactos eléctricos y en aplicaciones donde se requiere resistencia al agua y a la corrosión extrema como en estilográficas y pivotes de instrumentos. El rutenio es resistente a los ácidos comunes, entre ellos el agua regia, a temperaturas hasta de 100ºC (212ºF) y hasta de 300ºC (570ºF) en el caso del ácido fosfórico a 100ºC (212ºF). El rutenato de potasio, KRuO2.H2O, es soluble en agua y se utiliza en la purificación del rutenio. El tricloruro de rutenio, RuCl3, es soluble en agua pero se descompone en agua caliente; el tetróxido de rutenio es muy volátil y venenoso.
- 90. Rodio - Rh Elemento químico, de símbolo Rh, de número atómico 45 y peso atómico 102.905. El rodio es un metal blanco, duro, considerablemente menos dúctil que el platino o el paladio, pero mucho más dúctil que cualquier otro metal de este grupo. Se usa principalmente como un elemento de aleación para el platino. Es un excelente catalizador para la hidrogenación y es activo en la reformación catalítica de hidrocarburos. El rodio se emplea también en aplicaciones para contactos eléctricos. Es galvanizado fácilmente para formar superficies duras, resistentes al desgaste y de brillo permanente, utilizadas tanto en contactos eléctricos estacionarios como corredizos, en espejos y reflectores, y como acabado en joyería. El rodio es resistente a al mayor parte de los ácidos comunes, incluida el agua regia, aun a temperaturas moderadas. Lo atacan el ácido sulfúrico caliente, el ácido bromhídrico caliente, el hipoclorito de sodio y los halógenos libres a 200-600ºc (390-1110ºF). El tricloruro de rodio, RhCl3, es un compuesto rojo insoluble en agua. El trihidróxido de rodio es soluble en algunos ácidos y puede servir para producir sales de rodio. El sulfato de rodio, Rh2 (SO4)3. XH2O, es rojo o amarillo y soluble en agua.
- 92. Paladio - Pd Elemento químico, símbolo Pd, número atómico 46 y peso atómico 106.4. Es un metal blanco y muy dúctil semejante al platino, al que sigue en abundancia e importancia. El paladio soportado sobre carbono o alúmina se emplea como catalizador en ciertos procesos químicos en que intervienen reacciones de hidrogenación en fase líquida y gaseosa. Quizá el uso más frecuente del paladio puro corresponda a los contactos eléctricos para bajo voltaje. El paladio sobresale por el número de metales con que forma aleaciones y generalmente produce soluciones sólidas dúctiles. El paladio es blando y dúctil y puede fabricarse como alambres finos y placas delgadas. Calentado a temperaturas superiores a 80ºC (1472ºF), se forma un óxido opaco, PdO, ligero y adherente, que no tiende a descarapelarse ni a desprenderse. Por encima de los 800ºC (1472ºF), el óxido se disocia y se obtiene el metal brillante si se enfría rápidamente a la temperatura ambiente. El hidrógeno es absorbido fácilmente por el paladio y se difunde a un a velocidad relativamente rápida cuando se calienta. Esta propiedad se aprovecha en los purificadores de hidrógeno, que dejan pasar este gas, pero no otros. En atmósferas ordinarias, el paladio es resistente al deslustre, mas pierde esta cualidad en atmósferas contaminadas con azufre. A la temperatura ambiente, es resistente a los ácidos fluorhídrico, fosfórico, perclórico, acético, clorhídrico, y a los ácidos sulfúricos como gases, pero puede ser atacado por algunos de ellos a 100ºC (212ºF).
- 94. Plata - Ag Elemento químico, símbolo Ag, número atómico 47 y masa atómica 107.870. Es un metal lustroso de color blanco-grisáceo. Desde el punto de vista químico, es uno de los metales pesados y nobles; desde el punto de vista comercial, es un metal precioso. Hay 25 isótopos de la plata. Sus masas atómicas fluctúan entre 102 y 117. En la mayor parte de sus aplicaciones, la plata se alea con uno o más metales. La plata, que posee las más altas conductividades térmica y eléctrica de todos los metales, se utiliza en puntos de contacto eléctricos y electrónicos. También se emplea mucho en joyería y piezas diversas. Entre la aleaciones en que es un componente están las amalgamas dentales y metales para cojinetes y pistones de motores. La plata es un elemento bastante escaso. Algunas veces se encuentra en la naturaleza como elemento libre (plata nativa) o mezclada con otros metales. Sin embargo, la mayor parte de las veces se encuentra en minerales que contienen compuestos de plata. Los principales minerales de plata son la argentita, la cerargirita o cuerno de plata y varios minerales en los cuales el sulfuro de plata está combinado con los sulfuros de otros metales. Aproximadamente tres cuartas partes de la plata producida son un subproducto de la extracción de otros minerales, sobre todo de cobre y de plomo. La plata pura es un metal moderadamente suave (2.5-3 en la escala de dureza de Mohs), de color blanco, un poco más duro que el oro. Cuando se pule adquiere un lustre brillante y refleja el 95% de la luz que incide sobre ella. Su densidad es 10.5 veces la del agua. La calidad de la plata, su pureza, se expresa como partes de plata pura por cada 1000 partes del metal total. La plata comercial tiene una pureza del 999 (ley 0.999).
- 96. Cadmio - Cd Elemento químico relativamente raro, símbolo Cd, número atómico 48; tiene relación estrecha con el zinc, con el que se encuentra asociado en la naturaleza. Es un metal dúctil, de color blanco argentino con un ligero matiz azulado. Es más blando y maleable que el zinc, pero poco más duro que el estaño. Peso atómico de 112.40 y densidad relativa de 8.65 a 20ºC (68ºF). Su punto de fusión de 320.9ºC (610ºF) y de ebullición de 765ºC (1410ºF) son inferiores a los del zinc. Hay ocho isótopos estables en la naturaleza y se han descrito once radioisótopos inestables de tipo artificial. El cadmio es miembro del grupo IIb (zinc, cadmio y mercurio) en la tabla periódica, y presenta propiedades químicas intermedias entre las del zinc metálico en soluciones ácidas de sulfato. El cadmio es divalente en todos sus compuestos estables y su ion es incoloro. El cadmio no se encuentra en estado libre en la naturaleza, y la greenockita (sulfuro de cadmio), único mineral de cadmio, no es una fuente comercial de metal. Casi todo el que se produce es obtenido como subproducto de la fundición y refinamiento de los minerales de zinc, los cuales por lo general contienen de 0.2 a 0.4%. Estados Unidos, Canadá, México, Australia, Bélgica, Luxemburgo y República de Corea son fuentes importantes, aunque no todos son productores. En el pasado, un uso comercial importante del cadmio fue como cubierta electrodepositada sobre hierro o acero para protegerlos contra la corrosión. La segunda aplicación es en baterías de níquel-cadmio y la tercera como reactivo químico y pigmento. Se recurre a cantidades apreciables en aleaciones de bajo punto de fusión semejantes a las del metal de Wood, en rociadoras automáticas contra el fuego y en cantidad menor, en aleaciones de latón (laton), soldaduras y cojinetes. Los compuestos de cadmio se emplean como estabilizadores de plásticos y en la producción de cadmio fosforado. Por su gran capacidad de absorber neutrones, en especial el isótopo 113, se usa en barras de control y recubrimiento de reactores nucleares.
- 98. Indio - In Elemento químico de símbolo In, de número atómico 49, el indio tiene un número atómico relativo de 114.82. Se encuentra aproximadamente en un 0.000001% en la corteza terrestre y normalmente en concentraciones de 0.1% o menores. Se halla distribuido ampliamente en muchas minas y minerales y se recobra en gran parte de los conductos de polvo y residuos de las operaciones de procesamiento de zinc. El indio se utiliza para soldar alambre de plomo a transistores de germanio y como componente de los semiconductores intermetálicos empleados en los transistores de germanio. El arseniuro de indio, antimoniuro y fosfuro son semiconductores con propiedades especiales. Otros usos del indio se encuentran en la producción de recubrimientos para reducir la corrosión y el desgaste, en las aleaciones para sellado de vidrio y en las aleaciones dentales.
- 100. Estaño - Sn Elemento químico, de símbolo Sn, número atómico 50 y peso atómico 118.69. Forma compuesto de estaño(II) o estañoso(Sn2+) y estaño(IV) o estánico (Sn4+), así como sales complejas del tipo estanito (M2SnX4) y estanato (M2SnX6). Se funde a baja temperatura; tiene gran fluidez cuando se funde y posee un punto de ebullición alto. es suave, flexible y resistente a la corrosión en muchos medios. Una aplicación importante es el recubrimiento de envases de acero para conservar alimentos y bebidas. Otros empleos importantes son: aleaciones para soldar, bronces, pletres y aleaciones industriales diversas. Los productos químicos de estaño, tanto inorgánicos como orgánicos, se utilizan mucho en las industrias de galvanoplastia, cerámica y plásticos, y en la agricultura. El mineral del estaño más importante es la casiterita, SnO2. No se conocen depósitos de alta calidad de este mineral. La mayor parte del mineral de estaño del mundo se obtiene de depósitos aluviales de baja calidad. Existen dos formas alotrópicas del estaño: estaño blanco y estaño gris. Es estño reacciona tanto con ácidos fuertes como con bases fuertes, pero es relativamente resistente a soluciones casi neutras. En muy diversas circunstancias corrosiva, no se desprende el gas hidrógeno del estaño y la velocidad de corrosión está controlada por el suministro de oxígeno u otros agentes oxidantes; en su ausencia, la corrosión es despreciable. Se forma una película delgada de óxido estánico sobre el estaño que está expuesto al aire y esto origina una protección superficial.
- 102. Antimonio - Sb Elemento químico con símbolo Sb y número atómico 51. El antimonio no es un elemento abundante en la naturaleza; raras veces se encuentra en forma natural, a menudo como una mezcla isomorfa con arsénico: la allemonita. Su símbolo Sb se deriva de la palabra latina stibium. El antimonio se presenta en dos formas: amarilla y gris. La forma amarilla es metaestable, y se compone de moléculas Sb4, se le encuentra en el vapor de antimonio y es la unidad estructural del antimonio amarillo; la forma gris es metálica, la cual cristaliza en capas formando una estructura romboédrica. El antimonio difiere de los metales normales por tener una conductividad eléctrica menor en estado sólido que en estado líquido (como su compañero de grupo el bismuto). El antimonio metálico es muy quebradizo, de color blanco-azuloso con un brillo metálico característico, de apariencia escamosa. Aunque a temperaturas normales es estable al aire, cuando se calienta se quema en forma luminosa desprendiendo humos blancos de Sb2O3. La vaporización del metal forma moléculas de Sb4O6, que se descomponen en Sb2O3 por arriba de la temperatura de transición. El antimonio se encuentra principalmente en la naturaleza como Sb2S3 (estibnita, antimonita); el Sb2O3 (valentinita) se halla como producto de descomposición de la estibnita. Forma parte por lo general de los minerales de cobre, plata y plomo. También se encuentran en la naturaleza los antimoniuros metálicos NiSb (breithaupita), NiSbS (ulmanita) y Ag2Sb (dicrasita); existen numerosos tioantimoniatos como el Ag3SbS3 (pirargirita).
- 104. Teluro - Te Elemento químico de símbolo Te, número atómico 52 y peso atómico 127.60. Existen ocho isótopos estables del telurio. El telurio constituye aproximadamente el 10-9 % de la roca ígnea que hay en la Tierra. Se encuentra como elemento libre, asociado algunas veces con selenio, y también existe como telururo de silvanita (teluro gráfico), nagiagita (telurio negro), hessita, tetradimita, altaita, coloradoita y otros telururos de plata y oro, así como el óxido, telurio ocre. Existen dos modificaciones alotrópicas importantes del telurio elemental: la forma cristalina y la amorfa. La forma cristalina tiene un color blanco plateado y apariencia metálica. Esta forma se funde a 449.5ºC (841.6ºF). Tiene una densidad relativa de 6.24 y una dureza de 2.5 en la escala de Mohs. La forma amorfa (castaña) tiene una densidad relativa de 6.015. El telurio se quema en aire despidiendo una flama azul y forma dióxido de telurio, TeO2. Reacciona con los halógenos, pero no con azufre o selenio, y forma, entre otros productos, tanto el anión telururo dinegativo (Te2-), que se asemeja al selenuro, como el catión tetrapositivo (Te4+), que se parece al platino (IV). El telurio se utilizó inicialmente como aditivo del acero para incrementar su ductilidad, como abrillantador en electroplateados, como aditivo en catalizadores para la desintegración catalítica del petróleo, como material colorante de vidrios y como aditivo del plomo para incrementar su fuerza y resistencia a la corrosión.
- 106. Yodo - I Elemento no metálico, símbolo I, número atómico 53, masa atómica relativa 126.904, el más pesado de los halógenos (halogenuros) que se encuentran en la naturaleza. En condiciones normales, el yodo es un sólido negro, lustroso, y volátil; recibe su nombre por su vapor de color violeta. La química del yodo, como la de los otros halogenos, se ve dominada por la facilidad con la que el átomo adquiere un electrón para formar el ion yoduro, I -, o un solo enlace covalente –I, y por la formación, con elementos más electronegativos, de compuestos en que el estado de oxidación formal del yodo es +1, +3, +5 o +7. El yodo es más electropositivo que los otros halógenos y sus propiedades se modulan por: la debilidad relativa de los enlaces covalentes entre el yodo y elementos más electropositivos; los tamaños grandes del átomo de yodo y del ion yoduro, lo cual reduce las entalpías de la red cristalina y de disolución de los yoduros , en tanto que incrementa la importancia de las fuerzas de van der Waals en los compuestos del yodo, y la relativa facilidad con que se oxida éste. El yodo se encuentra con profusión, aunque rara vez en alta concentración y nunca en forma elemental. A pesar de la baja concentración del yodo en el agua marina, cierta especie de alga puede extraer y acumular el elemento. En la forma de yodato de calcio, el yodo se encuentra en los mantos de caliche de Chile. Se encuentra también como ion yoduro en algunas salmueras de pozos de petróleo en California, Michigan y Japón. El único isótopo estable del yodo es el 127I (53 protones, 74 neutrones). De los 22 isótopos artificiales (masas entre 117 y 139), el más importante es el 131I, con una vida media de 8 días; se utiliza mucho en el trabajo con trazadores radiactivos y ciertos procedimientos de radioterapia.
- 108. Xenón - Xe Elemento químico de símbolo Xe y número atómico 54. Perteece a la familia de los gases nobles. Se conocen 16 isótopos radiactivos. El xenón se utiliza para llenar cierto tipo de lámparas de destello para fotografía que producen luz con un buen equilibrio de todos los colores del espectro visible y pueden ser utilizadas 10 000 veces o más antes de quemarse. Una lámpara de arco llena con xenón da luz intensa semejante al arco de carbono; en particular es valiosa en la proyección de películas. Se encuentran trazas de xenón en minerales y meteoritos, pero la única fuente comercial de xenón es el aire. El xenón constituye 0.086 partes por millón por volumen de aire seco. Se estima que cerca del 3 x 10-9% del peso de la Tierra es xenón. También se encuentra en el exterior de nuestro planeta; se estima que existen cerca de 4 átomos de xenón por cada 1 000 000 de átomos de silicio, que es el patrón de abundancia utilizado con los elementos que hay en el Universo. El xenón es incoloro, inodoro e insípido; es un gas en condiciones normales. El xenón es el único de los gases nobles no radiactivos que forma compuestos químicos estables a la temperatura ambiente; también forma enlaces débiles con clatratos.
- 110. Cesio - Cs Elemento químico, Cs, con número atómico 55 y peso atómico de 132.905, el más pesado de los metales alcalinos en el grupo IA de la tabla periódica, a excepción del francio, miembro radiactivo de la familia de los metales alcalinos. El cesio es un metal blando, ligero y de bajo punto de fusión. Es el más reactivo de los metales alcalinos y en realidad es el menos electronegativo y el más reactivo de todos los elementos. El cesio reacciona en forma vigorosa con oxígeno para formar una mezcla de óxidos. En aire húmedo, el calor de oxidación puede ser suficiente para fundir y prender el metal. El cesio no reacciona con nitrógeno para formar nitruros, pero reacciona con el hidrógeno a temperaturas altas para producir un hidruro muy estable; reacciona en forma violenta con el agua y aun con hielo a temperaturas hasta -116ºC (-177ºF) así como con los halógenos, amoniaco y monóxido de carbono. En general, con compuestos orgánicos el cesio experimenta los mismos tipos de reacciones que los otros metales alcalinos, pero es mucho más reactivo. El cesio no es muy abundante en la corteza terrestre, hay sólo 7 partes por millón (ppm). Al igual que el litio y el rubidio, se encuentra como un constituyente de minerales complejos y no en forma de halogenuros relativamente puros, como en el caso del sodio y potasio. El litio, el rubidio y el cesio con frecuencia se hallan juntos en minerales lepidolíticos como los existentes en Rodesia. El cesio metálico se utiliza en celdas fotoeléctricas, instrumentos espectrográficos, contadores de centelleo, bulbos de radio, lámparas militares de señales infrarrojas y varios aparatos ópticos y de detección. Los compuestos de cesio se usan en la producción de vidrio y cerámica, como absorbentes en plantas de purificación de dióxido de carbono, como componentes en bulbos de radio y en microquímica. Las sales de cesio se han utilizado en medicina como agentes antishock después de la administración de drogas de arsénico. El isótopo cesio-137 está sustituyendo al colbalto-60 en el tratamiento del cáncer.
- 112. Bario - Ba Elemento químico, Ba, con número atómico 56 y peso atómico de 137.34. El bario ocupa el decimoctavo lugar en abundancia en la corteza terrestre, en donde se encuentra en un 0.04%, valor intermedio entre el calcio y el estroncio, los otros metales alcalinotérreos. Los compuestos de bario se obtienen de la minería y por conversión de dos minerales de bario. La barita, o sulfato de bario, es el principal mineral y contiene 65.79% de óxido de bario. La witherita, algunas veces llamada espato pesado, es carbonato de bario y contiene 72% de óxido de bario. El metal lo aisló por primera vez Sir Humphry Davy en 1808 por electrólisis. En la industria sólo se preparan pequeñas cantidades por reducción de óxido de bario con aluminio en grandes retortas. El metal se utiliza en aleaciones bario-niquel para alambres de bujía (el bario incrementa la capacidad de emisión de la aleación) y en el metal de Frary, que es una aleación de plomo, bario y calcio, que se usa en lugar del metal Babbitt porque puede moldearse. El metal reacciona con el agua más fácilmente que el estroncio y el calcio, pero menos que el sodio; se oxida con rapidez al aire y forma una película protectora que evita que siga la reacción, pero en aire húmedo puede inflamarse. El metal es lo bastante activo químicamente para reaccionar con la mayor parte de los no metales. El metal es dúctil y maleable; los trozos recién cortados tienen una apariencia gris-blanca lustrosa.
- 114. Lantano - La Elemento químico, símbolo La, con número atómico 57 y peso atómico 138.91. El lantano, segundo elemento más abundante del grupo de las tierras raras, es un metal. En estado natural, es una mezcla de los isótopos 138La y 139La. Se encuentra asociado con otras tierras raras en monacita, bastnasita y otros minerales. Es uno de los productos radiactivos de la fisión del uranio, el torio o el plutonio. Es el elemento más básico de las tierras raras e ingrediente importante en la manufactura del vidrio. Proporciona un alto índice de refracción al vidrio y se utiliza en la fabricación de lentes de gran calidad.
- 116. Cerio - Ce Elemento químico, Ce, número atómico 58, peso atómico 140.12. Es el elemento metálico más abundante del grupo de las tierras raras en la tabla periódica. El elemento natural está constituido de los isótopos 136Ce, 138Ce, 140Ce y 142Ce. El 142Ce radiactivo tiene una vida media de 5 x 1015 años. El cerio se encuentra mezclado con otras tierras raras en muchos minerales, en particular en monacita y blastnasita y también se halla entre los productos de la fisión de uranio, torio y plutonio. Aunque la valencia común del cerio es 3, forma también una serie de compuestos tetravalentes y es la única tierra rara que existe como ion tetravalente en solución acuosa. Aunque en alta pureza se le puede separar de las otras tierras raras por métodos de intercambio iónico, por lo general se separa químicamente aprovechando su estado tetravalente.
