Proteinas
- 1. ESTRUCTURA DE LAS PROTEINAS
- 2. ¿QUÉ SON LAS PROTEÍNAS? • Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno polímeros lineales construídos a partir de monómeros llamados aminoácidos, que bajo condiciones fisiológicas tienen una estructuratridimensional definida. (Creighton 2000)
- 3. ENZIMAS CATALIZADORES BIOLÓGICOS Aumente la rapidez o velocidad de una reacción química o sea, la velocidad de formación del producto.
- 4. • Los AMINOÁCIDOS son los precursores moleculares de las proteínas y tienen una estructura común. (Voet, 2004) (Creighton 2000)
- 5. Carbono α: Centro quiral • Ópticamente activos: Porque pueden rotar la luz polarizada en un plano. ACTIVIDAD OPTICA: poseen una asimetría tal que no pueden superponerse sobre su imagen en el espejo. • LóD • Las proteínas contienen aminoácidos de tipo L. (Voet, 2004)
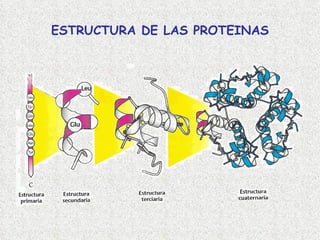
- 7. ESTRUCTURA PRIMARIA: FORMACIÓN DE UN ENLACE PEPTÍDICO Una cadena polipeptídica consiste en una cadena lineal de aminoácidos unidos por enlaces peptídicos. (Creighton 2000)
- 8. ESTRUCTURA SECUNDARIA Se refiere al ordenamiento espacial de los aminoácidos que se encuentran cerca en la secuencia. Los aminoácidos, a medida que van siendo enlazados durante la sintesis de proteínas y gracias a la capacidad de giro de sus enlaces, adquieren una disposición espacial estable, la estructura secundaria (Creighton 2000)
- 9. • α- hélice: Esta estructura se forma al enrollarse helicoidalmente sobre sí misma la estructura primaria. Se debe a la formación de enlaces de hidrógeno entre el -C=O de un aminoácido y el - NH- del cuarto aminoácido que le sigue. (Creighton 2000; Voet, 2004)
- 10. • Forma-β Los aminoácidos forman una cadena en forma de zigzag, denominada disposición en lámina plegada. (Creighton 2000; Voet, 2004)
- 11. ESTRUCTURA TERCIARIA Es su disposición espacial; es decir, el plegamiento de los elementos estructurales secundarios, junto con las disposiciones espaciales de sus cadenas, esto es, el arreglo tridimensional de todos los aminoácidos)
- 12. La estructura terciaria informa sobre la disposición de la estructura secundaria de un polipéptido al plegarse sobre sí misma originando una conformación globular. Esta conformación globular se mantiene estable gracias a la existencia de enlaces entre los radicales R.
- 13. ESTRUCTURA CUATERNARIA Las cadenas polipeptídicas se pueden ensamblar en estructuras de múltiples subunidades. (se presenta en proteínas que contienen más de una cadena polipeptídica, conocidas como subunidades) (Creighton 2000)
- 14. La FUNCIÓN de una proteínas es directamente dependiente de su estructura tridimensional. Por lo tanto, LA ESTRUCTURA DICTA LA FUNCIÓN Determina la especificidad de interacción con otras moléculas, Determina su función, Determina su estabilidad y tiempo de vida media
- 15. DESNATURALIZACIÓN • Consiste en la pérdida de la estructura terciaria, por romperse los puentes que forman dicha estructura. • La mayoría de las proteínas biológicas pierden su función biológica cuando están desnaturalizadas, por ejemplo, las enzimas pierden su actividad catalítica, porque los sustratos no pueden unirse más al sitio activo, y porque los residuos del aminoácido implicados en la estabilización de los sustratos no están posicionados para hacerlo. (Cueto et all., 2007)
- 16. Los agentes que provocan la desnaturalización de una proteína se llaman agentes desnaturalizantes. 1. la polaridad del disolvente, 2. la fuerza iónica, 3. el pH, 4. la temperatura. Desnaturalización de la estructura trimimensional con urea y reducción de puentes disulfuro con 2-mercaptoetanol. (Cueto et all., 2007)
- 17. •La polaridad del disolvente: La polaridad del disolvente disminuye cuando se le añaden sustancias menos polares que el agua como el etanol o la acetona. Con ello disminuye el grado de hidratación de los grupos iónicos superficiales de la molécula proteica,provocando la agregación y precipitación. •Aumento de la fuerza iónica del medio: (por adición de sulfato amónico o urea, por ejemplo) provoca una disminución en el grado de hidratación de los grupos iónicos superficiales de la proteína, ya que estos solutos (1) compiten por el agua y (2) rompen los puentes de hidrógeno o las interacciones electrostáticas, de forma que las moléculas proteicas se agregan y precipitan. (Cueto et all., 2007)
- 18. •Efecto del ph: Los iones H+ y OH- del agua afectan a la carga eléctrica de los grupos ácidos y básicos de las cadenas laterales de los aminoácidos. Esta alteración de la carga superficial de las proteínas elimina las interacciones electrostáticas que estabilizan la estructura terciaria y a menudo provoca su precipitación. •Efecto de la temperatura: Cuando la temperatura es elevada aumenta la energía cinética de las moléculas con lo que se desorganiza la envoltura acuosa de las proteínas, y se desnaturalizan. Asimismo, un aumento de la temperatura destruye las interacciones débiles y desorganiza la estructura de la proteína, de forma que el interior hidrofóbico interacciona con el medio acuoso y se produce la agregación y precipitación de la proteína desnaturalizada. (Cueto et all., 2007)
- 20. James D. Watson y Francis Crick en 1957, plantea que en el mecanismo de la síntesis de proteínas a partir del DNA, la información genética fluye en una dirección solamente según el siguiente diagrama simplificado: DNA -> RNA -> Proteína
- 21. REPLICACIÓN DEL ADN Reglas fundamentales de la replicación • SEMICONSERVATIVA: Cada una de las hebras originales de DNA sirve como molde para una hebra nueva = dos moléculas nuevas. • BIDIRRECCIONAL: Ocurre en dos sentidos, cada uno con su orquilla de replicación. • DIRECCIÓN: Las cadenas de ADN son sintetizadas en dirección 5´-3´. y una de las cadenas es semidiscontinua porque se sintetiza por trozos.
- 22. • SÍNTESIS: DNA polimerasas Requerimientos básicos: 5. Todas requieren de un molde 2. Es necesario un cebador, el cual es un segmento de cadena con un grupo 3´-hidroxilo al cual puedan añadirse nucleótidos.
- 23. EN RESUMEN….
- 24. Replicación del ADN PRIMOSOMA: Complejo proteico de separación. Helicasa y SSB REPLISOMA: Complejo proteico de elongación. Primasas y DNA ligasas.
- 25. Replicación del ADN Paso 1 Paso 2 Paso 3 O = polimerasas i y ii + O = helicasa O = polimerasa iii endonucleasa || = ADN || = ADN || = ADN () = ADN, enrollado ! ¡ = ARN ! ¡ = ARN http://www.biotech.bioetica.org/clase1-14.htm
- 26. TRANSCRIPCIÓN DEL ADN Síntesis de ARN bajo la dirección del DNA ARN pol
- 27. Elementos clave • Promotor: Secuencia de ADN requerida por la ARNpol para que esta pueda unirse al molde e iniciar el proceso de transcripción de un gen. • Codón iniciador: Codón del mRNA, generalmente con la secuencia AUG, que marca el inicio de la síntesis de una proteína. • Codón de terminación: Codón del mRNA que no codifica para ningún amino ácido y por lo tanto indica el final de la codificación para una proteína específica. Detiene el proceso de traducción en ese punto. Puede tener las siguientes secuencias: UAA, UAG, UGA.
- 28. Etapas de la transcripción: • Reconocimiento de la hebra codificante: Unión de la RNApol al promotor. • Iniciación: Síntesis de los primeros enlaces nucleotídicos o sea, la enzima elonga la cadena y deja al promotor. • Elongación: La enzima se desplaza a lo largo del ADN molde y extiende la cadena creciente de ARN. • Terminación: Reconocimiento del codón de terminación. Dependiente o independiente de Rho.
- 29. (sense strand) (coding strand) RNAp (anti-sense strand) (non-coding strand)
- 30. TERMINACIÓN INDEPENDIENTE DE Rho (intrinseca) RNA Pol. RNA Terminador 5’ RNA Pol. RNA RNA 5’ Pol. 5’ RNA
- 31. Formación de horquilla (estructura secundaria) Ricos en G-C (secuencia palindrómica dentro del RNA) 6 residuos U al 3’
- 32. TERMINACION DEPENDIENTE DE Rho (extrínseca) RNA Pol. terminación RNA 5’ r La secuencia de terminación retarda la RNA polimerasa. RNA Pol. RNA 5’ r
- 33. Help, rho hit me! RNA Pol. r RNA 5’ RNA El complejo de elongación se desintrega: Pol. separación del híbrido RNA-DNA 5’ RNA r
- 34. TRADUCCIÓN • Cada aminoácido está representado por tres nucleótidos = tripletes (64 combinaciones). • A cada triplete se le llama codon. • La correspondencia entre tripletes y aminoácidos es el código genético. • Codón de iniciación AUG (METIONINA) • Codón de terminación UAA, UAG, UGA
- 35. Componentes de la traducción • ARNm: Policistronicos (transcripcion y traducción simultaneas), un solo promotor que origina varias proteinas o monocistronica (transcripción y traducción separadas) eucariotes. 2. ARNt: Lleva el aminoácido hacia el codón exacto. Único tRNA para cada aminoácido. Es el adaptador de la molécula para la traducción.
- 36. 3. Ribosomas • Donde se localiza la síntesis de proteínas. • Son partículas formadas por RNAr y proteínas. • Son funcionales en el citosol, excepto los de mitocondrias y cloroplastos. • Constan de dos subunidades, una (LS) aproximadamente el doble que la otra (SS).
- 38. INICIACIÓN • Subunidad pequeña del ribosoma + mRNA + tRNA iniciador 2. Enlaces de ribosoma 3. Enlaces tRNA iniciador 4. Subunidad grande del ribosoma se adiciona después
- 39. ELONGACIÓN
- 40. TERMINACIÓN 1. Recae en el codón de terminación en el mRNA – UAA, UAG, UGA 2. Factor de liberación (proteina) – El agua se enlaza en lugar de otro aminoácido
- 41. ADN traducción del Trascripción y http://www.biotech.bioetica.org/clase1-14.htm