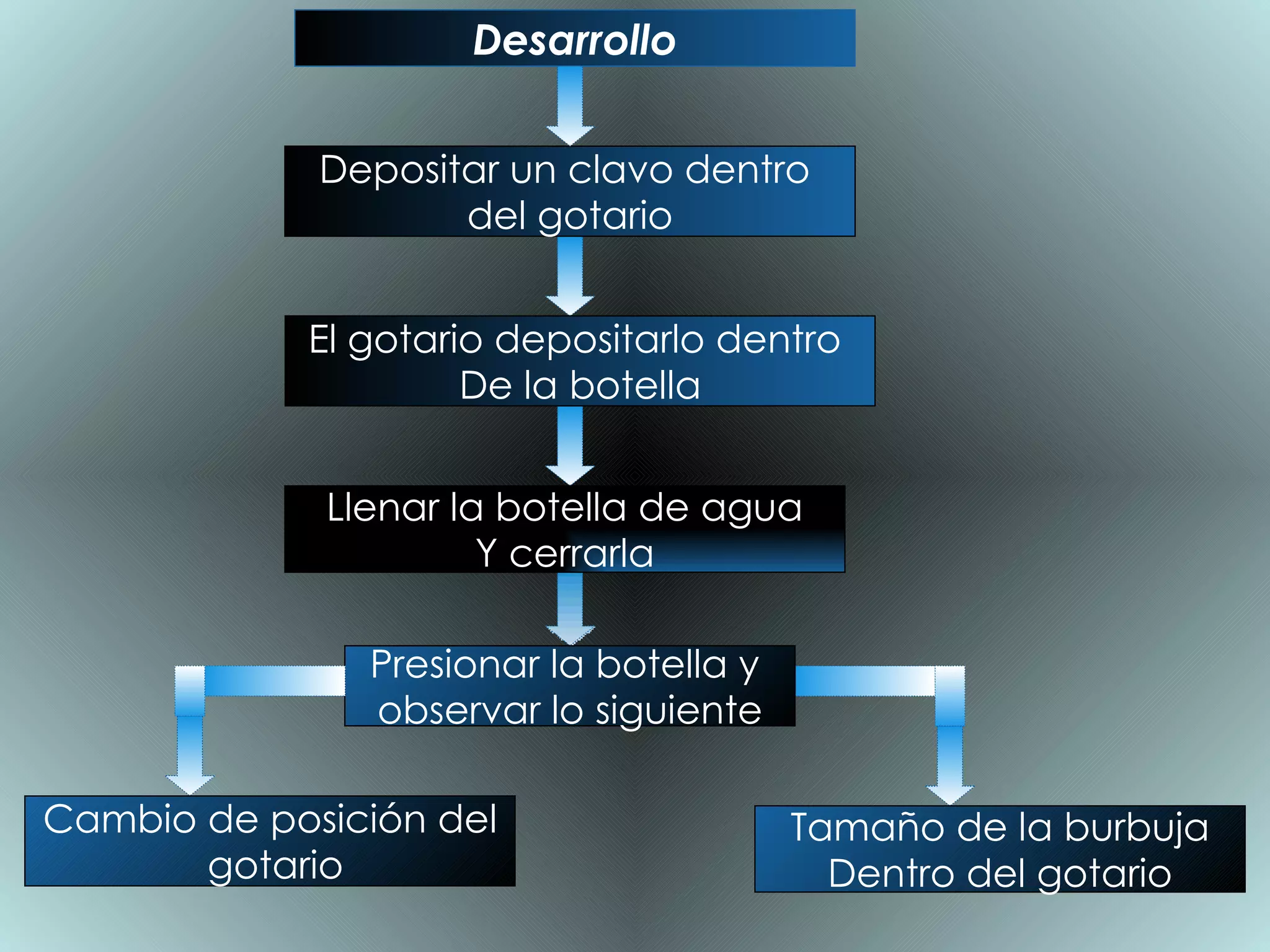
Este documento describe un experimento para establecer la relación entre el volumen y la presión de un gas, conocida como la ley de Boyle. El experimento involucró una botella de plástico con agua y un gotario con una burbuja de aire y un clavo. Al apretar la botella, la burbuja se hizo más pequeña y el gotario bajó; al soltar la botella, la burbuja recuperó su tamaño original. Esto demostró que a temperatura constante, el volumen de un gas es inversamente proporcional a la