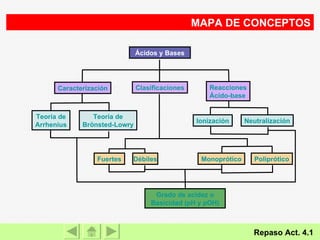
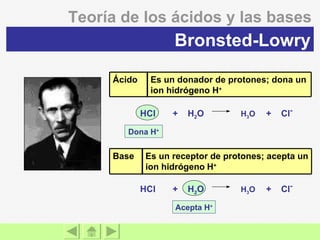
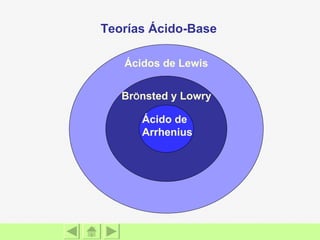
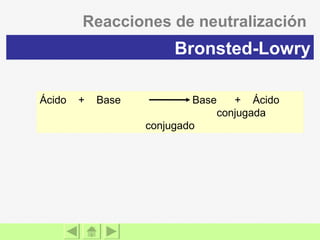
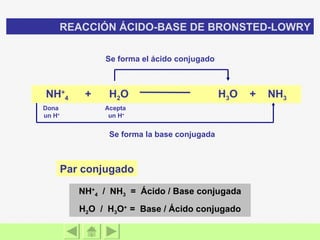
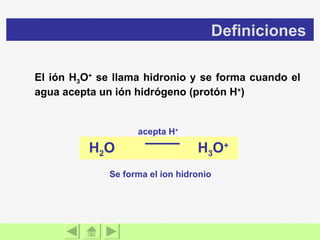
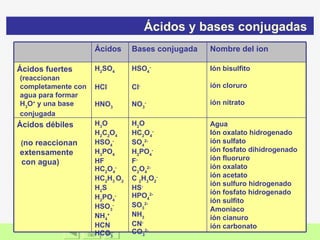
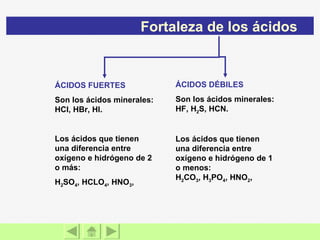
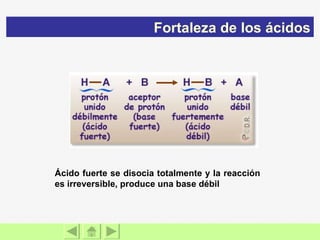
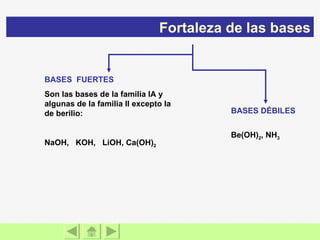
El documento presenta información sobre ácidos y bases. Explica las teorías de Arrhenius, Brönsted-Lowry y Lewis sobre ácidos y bases. También describe las características de ácidos y bases fuertes y débiles, así como reacciones como la neutralización y la ionización del agua. Incluye ejemplos de ácidos y bases comunes y donde se encuentran.
















![(H + ) (OH - ) = 1x 10 -14 Las soluciones que contienen [H + ] = 10 -7 M se denominan neutras , pues poseen la misma cantidad de [OH-] que de [H + ] . Aquellas soluciones que poseen [H + ] > 10 -7 M, se denominan ácidas Las soluciones con [H + ] < 10 -7 M, se denominan básicas . Producto iónico del agua](https://image.slidesharecdn.com/acidosybases-091103211315-phpapp02/85/Acidos-Y-Bases-29-320.jpg)
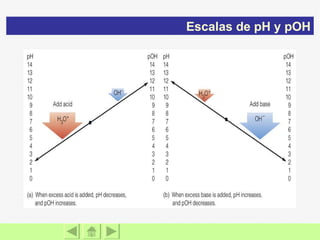
![pH = - log(H + ) pOH = - log(OH - ) pH + pOH = 14 Los valores de [H + ] para la mayoría de las soluciones son demasiado pequeños y difíciles de comparar, de ahí que Sören Sörensen en 1909 ideó una forma más adecuada de compararlas, el pH que no es mas que la forma logarítmica de expresar las concentraciones: Escalas de pH y pOH Fórmulas](https://image.slidesharecdn.com/acidosybases-091103211315-phpapp02/85/Acidos-Y-Bases-30-320.jpg)



![MC Minerva Martínez Saldaña MEC Juana Ma. Rodríguez Salas Preparatoria 9 Preparatoria 20 UANL UANL [email_address] jmrodihotmail.com Información libro de texto Producción, Diseño y Creación de material didáctico Fundamentos de Química Ralph A. Burns Créditos](https://image.slidesharecdn.com/acidosybases-091103211315-phpapp02/85/Acidos-Y-Bases-39-320.jpg)