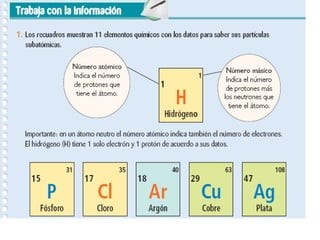
Este documento describe la evolución del modelo atómico a través del tiempo. Comienza explicando que los átomos fueron propuestos por primera vez por Demócrito en el siglo V a.C. Luego, Dalton retomó la idea en el siglo XIX y propuso su teoría atómica. Posteriormente, experimentos de Thomson y Rutherford llevaron al desarrollo de nuevos modelos. Finalmente, Bohr propuso un modelo donde los electrones giran en órbitas definidas alrededor del núcleo.