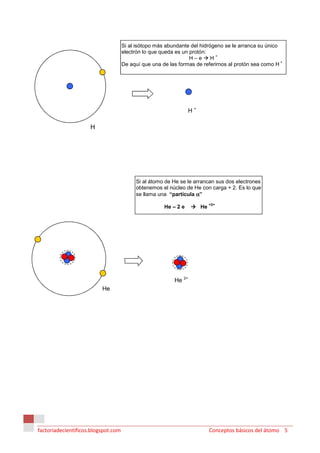
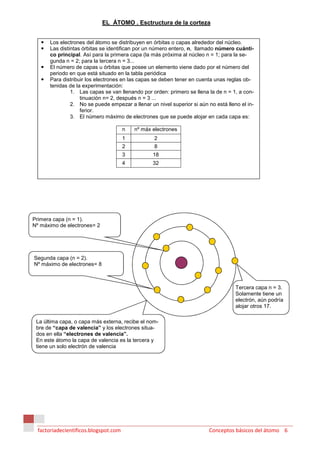
1) En la antigua Grecia, Demócrito propuso que la materia estaba compuesta de átomos indivisibles mientras que Aristóteles propuso que estaba compuesta de los cuatro elementos de aire, agua, tierra y fuego.
2) En el siglo XIX, Dalton recuperó la teoría atómica de Demócrito y Thomson propuso un modelo atómico donde los electrones orbitaban una nube positiva.
3) Los experimentos de Rutherford mostraron que los átomos tenían un núcleo denso donde se