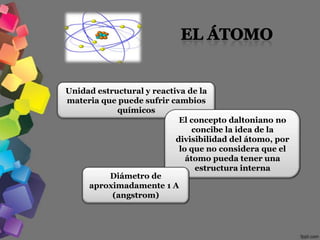
1) Los filósofos griegos Leucipo y Demócrito propusieron que la materia estaba formada por pequeñas partículas indivisibles llamadas átomos.
2) Rutherford descubrió en 1909 que los átomos no eran sólidos como se pensaba, sino que tenían un núcleo denso rodeado por electrones.
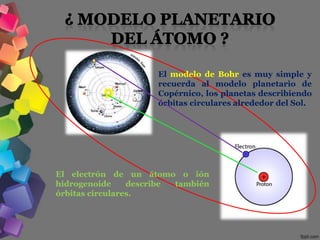
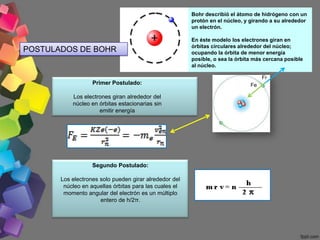
3) Bohr propuso en 1913 que los electrones orbitaban el núcleo en órbitas cuantizadas, emitiendo radiación al cambiar de órbita.