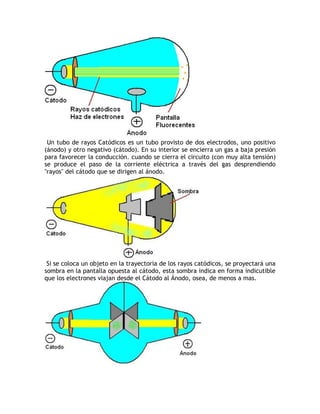
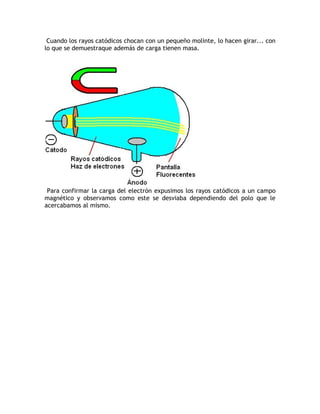
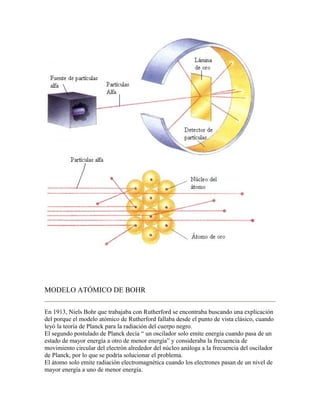
El documento describe la evolución del modelo atómico a través de la historia. 1) El modelo de Dalton propuso que los átomos son indivisibles y se combinan en proporciones definidas, pero no explicaba nuevos descubrimientos. 2) El modelo de Thomson propuso que los átomos contenían electrones dispersos en una nube positiva, explicando la formación de iones. 3) El modelo de Rutherford introdujo el núcleo atómico con carga positiva y electrones en órbitas alrededor, pero era inestable según la