Incrustar presentación
Descargar para leer sin conexión


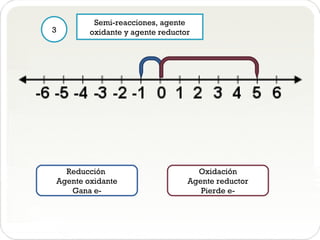



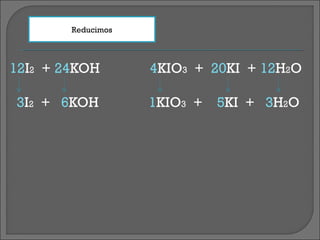
El documento presenta los pasos para balancear la ecuación química de la reacción entre yodo, hidróxido de potasio y agua. Primero se asignan los números de oxidación a cada elemento y se identifican los cambios. Luego se escriben las semi-reacciones de oxidación y reducción con los agentes oxidantes y reductores. Después se multiplican las semi-reacciones y se suman para obtener la ecuación química general balanceada. Finalmente, se reducen los coeficientes para simplificar la ecuación.






