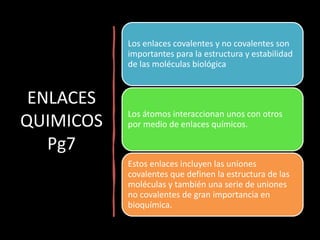
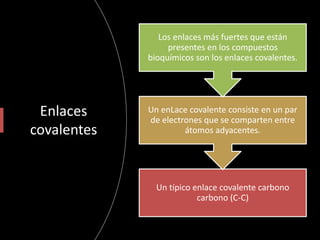
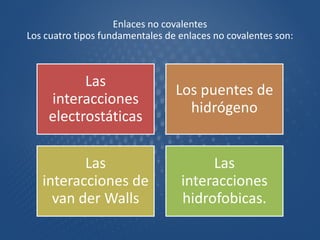
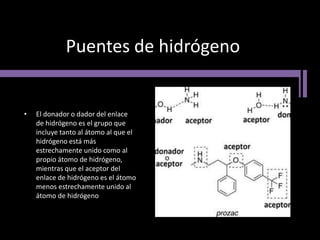
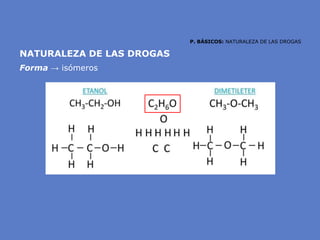
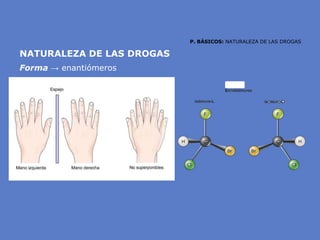
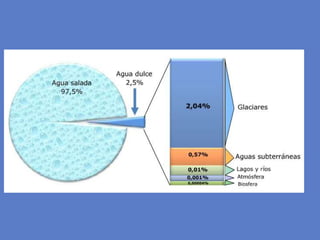
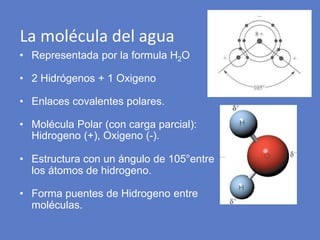
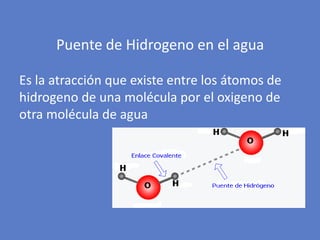
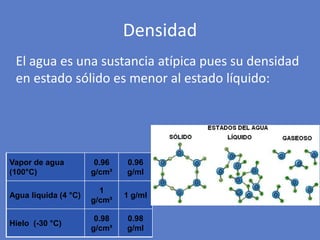
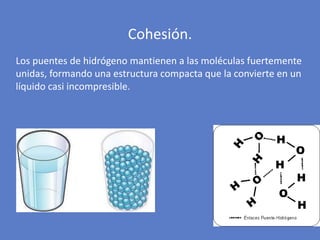
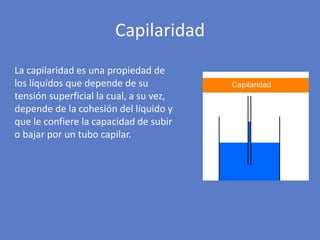
El documento aborda la importancia de los enlaces químicos, tanto covalentes como no covalentes, en la estructura y estabilidad de las moléculas biológicas, destacando el papel de los puentes de hidrógeno en la formación de estructuras como el ADN. También se detalla las propiedades físicas del agua, incluyendo su comportamiento atípico, como su alta densidad en estado líquido comparado con el sólido y su capacidad como disolvente. Finalmente, se menciona su rol crucial en procesos biológicos y climáticos debido a su elevada capacidad térmica y propiedades moleculares.