La cantidad de calor se define como la energía cedida o absorbida por un cuerpo cuando su temperatura varía. Está relacionada con el calor específico de la sustancia, que es la cantidad de calor necesaria para variar la temperatura de 1 gramo de la sustancia en 1°C. La fórmula para calcular la cantidad de calor es Q=c*m*(Tf-Ti), donde c es el calor específico, m la masa, Ti la temperatura inicial y Tf la temperatura final. Existen diversas unidades para medir el calor como Joules, Calorías y











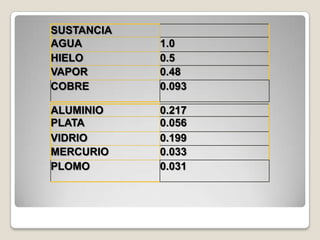


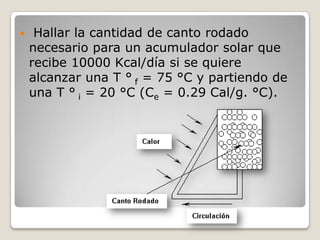

![Procedimiento y resultado:Si:Q = m.ce.(tf - ti)m = Q/[ce.(tf - ti)]m = 10000000 cal/[(0,29 cal/g.°C).(75 °C - 20 °C)]m = 10000000 cal/[(0,29 cal/g.°C).55 °C]m = 626959,24 gm = 626,96 kg](https://image.slidesharecdn.com/cantidaddecalor-110904170252-phpapp02/85/Cantidad-de-calor-18-320.jpg)