1) El documento presenta dos problemas de química relacionados con la cinética y el equilibrio químico. 2) El primer problema identifica pares ácido-base conjugados en tres equilibrios químicos. 3) El segundo problema calcula el grado de disociación y el pH de una disolución de ácido acético dada su constante de ionización.



![ANDALUCÍA / JUNIO 2000. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- A 25ºC, una disolución acuosa de un ácido débil, HA, tiene una constante de
disociación de 2,8·10-7
.
a) Calcule las concentraciones en el equilibrio, de las distintas espescies químicas
presentes en una disolución acuosa 0,1 M de HA.
b) Describa el material necesario y el procedimiento a seguir para prepara 100 ml de la
disolución anterior, si se dispone de un litro de disolución de HA 1 M.
Solución:
a) Se escribe el equilibrio de disociación del ácido HA, llamando x a la cantidad de ácido
disociada, y por tanto, a la cantidad de iones formados:
HA + H2O D A-
+ H3O+
[ ]inicial 0,1 -- --
[ ]equil 0,1 – x x x
La expresión de la constante de acidez será: Ka = ( [H+
]·[A-
] ) / [HA]
Y sustituyendo por los valores de las concentraciones de cada especie en el equilibrio, e
igualando al valor de Ka dado, se calcula x:
2,8·10-7 = x2
/ (0,1 – x)
x = 1,67·10-4
M
Luego la composición del equilibrio será:
[H3O+
] = [A-
] = 1,67·10-4
M
[HA] = 0,099 M = 0,1 M
b) Lo que se va a hacer es preparar una disolución diluída a partir de otra más concentrada.
Al diluir o concentrar una disolución, el número de equivalentes de soluto no varía, esto es:
(N·V) diluido = (N·V) concentrado](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-4-320.jpg)

![ANDALUCÍA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- a) ¿Cuál es el pH de 50 mL de una disolución de HCl 0,5 M?
b)Si añadimos agua a los 50 mL de la disolución anterior hasta alcanzar un volumen de
500 mL, ¿cuál será el nuevo pH?
c) Describa el procedimiento a seguir, y el material necesario para preparar la
disolución más diluida.
Solución:
a) El HCl es un ácido fuerte, totalmente disociado en sus iones, luego si su concentración
inicial es 0,5 M, la de los iones H+
y Cl-
será la misma:
[HCl]inicial = [H3O+
]final = [Cl-
]final = 0,5 M
Y como:
pH = -log [H3O+
]
pH = -log (0,5) = 0,3
El valor obtenido evidencia que es una disolución fuertemente ácida.
b) Si se diluye la disolución, lo que se añade es agua, luego los moles de HCl no variarán,
pero al hacerlo el volumen final, la nueva concentración será menor:
moles de HCl disolución inicial = 0,5 · 50 · 10-3
= 0,025 moles
V disolución final = 500 · 10-3
L = 0,5 L
Luego:
[HCl]final = 0,025 / 0,5 = 0,05 M
Y al ser, como ya se ha explicado, un ácido fuerte, la concentración de los iones liberados será
también 0,05 M; por lo que:
pH = - log (0,05) = 1,3
Sigue siendo una disolución ácida, aunque es menos ácida al ser más diluida.
c) Para preparar una disolución diluida a partir de otra más concentrada, basta con tomar el
volumen adecuado de la primera con una probeta, y llevarlo hasta un matraz aforado, donde
se enrasará con agua hasta completar el volumen final deseado de disolución. De este modo,
al tener los mismos moles de soluto que había en la disolución original, pero en un volumen
total mayor, la concentración final es menor.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-6-320.jpg)



![ANDALUCÍA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
Cuestión 5
5. Sabiendo que la constante de ionización del ácido acético (Ka) tiene un valor de
1,8· 10-5
, calcule:
a) El grado de disociación.
b) El pH de una disolución 0,01 M de ácido acético (CH3COOH).
Solución
Se denomina HAc al ácido acético, que es monoprótico, y está parcialmente disociado.
Se llama Ci a su concentración inicial, y "a" al grado de disociación del ácido; en el
equilibrio:
HAc + H2O Ac-
+ H3O+
[ ]inicial Ci -- --
[ ]equil. Ci · (1- a) Ci · a Ci · a
La expresión de la Ka es:
Ka = ([Ac-
]· [H3O+
]) / [HAc]
Y sustituyendo:
1,8· 10-5
=(Ci· a)2
/ Ci · (1 - a)
Operando se llega a la expresiónde al cual, en función de la Ci, se determina el valor del
grado de disociación:
Ci· a2
+ 1,8 · 10-5
· a - 1,8 · 10-5
= 0
Así, por ejemplo, para una Ci = 1 M, se tiene: a = 4,24 · 10-3
= 0,42 %
b) Se escribe de nuevo el equilibrio, llamando "x" a la cantidad de ácido disociada:
HAc + H2O Ac-
+ H3O+
[ ]inicial 0,01 -- --
[ ]equil. 0,01 - x x x](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-10-320.jpg)
![ANDALUCÍA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
La expresión de la Ka es:
Ka = ([Ac-
]· [H3O+
]) / [HAc]
Y sustituyendo:
1,8· 10-5
= x2
/ (0,01 - x)
De donde:
x = 4,24 · 10-4
M = [H3O+
]
Y como por la definición de pH se tiene:
pH = - log [H3O+
]
Se tiene que la disolución dada, es ácida, como cabía esperar, con un valor de pH:
pH = 3,37](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-11-320.jpg)
![ANDALUCÍA / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN Nº 6
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
6. – Para la reacción en equilibrio:
SOCl2 (g) ‡ SO2 (g) + Cl2 (g)
La constante Kp es igual a 2,4, a 375 K. A esta temperatura se introducen 0,050 moles de
SOCl2 en un recipiente cerrado de un litro. En el equilibrio calcule:
a) Las presiones parciales de cada uno de los gases presentes.
b) El grado de disociación del SOCl2 a esa temperatura.
Dato: R = 0,082 (atm · L) / (mol · K)
Solución:
a) y b) Se escribe el equilibrio que tienen lugar, especificando concentraciones iniciales y en
el momento del equilibrio (se hallan dividiendo moles por volumen total en litros), llamando
a al porcentaje disociado en tanto por uno:
SO2Cl2 (g) ‡ SO2 (g) + Cl2 (g)
[ ]inicial 0,05 -- --
[ ]equil. 0,05 · (1 -a) 0,05 · a 0,05 · a
Se hallan los moles totales en el equilibrio, en función de a:
n totales = 0,05 · (1 -a) + 0,05 · a + 0,05 · a = 0,05 · (1 + a)
La expresión que relaciona Kp con Kc es:
Kp = Kc · (R · T)Dn
De donde sustituyendo y despejando se tiene el valor de Kc:
2,4 = Kc · (0,082 · 375)2 - 1
Kc = 0,078
Se sustituye en la expresión de Kc:
Kc = ([SO2] · [Cl2]) / [SO2Cl2]
Kc = [0,05 · a]2
/ 0,05 · (1 - a) = 0,078
Se obtiene una ecuación de 2º grado, cuya solución válida será:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-12-320.jpg)

![ANDALUCIA / JUNIO 99. LOGSE / QUÍMICA / CINETICA Y EQUILIBRIO / OPCION
A / CUESTIÓN nº 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- a) ¿Cúal es el pH de 50 mL de una disolución 0,1 M de NaOH?
b) ¿Cuál será el pH de la disolución que resulta al añadir agua a la anterior hasta que el
volumenresultante sea diezveces mayor?
c) ¿Cuál es el pH de 100 mL de una disolución 0,01 M de HCl?
Solución:
a) Al ser una base fuerte, se encuentra totalmente disociado:
NaOH " Na+
+ OH-
De esta manera, la concentración de iones Na+
y OH-
será la misma que la de NaOH, es decir, 0,1
M.
Para calcular su pH, calcularemos antes el pOH, sabiendo que:
PH = 14 – pOH
El pOH resultante será:
pOH= -log [OH-
]= -log 0,1=1
pH= 14-1= 13
b) Si añadirmos agua, la concentración variará en funcióndel volumenañadido: si añadimos agua
hasta que el volumen sea 10 veces mayor, la concentración quedará reducida diez veces:
[NaOH]= 0,1 / 10 = 0,01 M
Analogamente al proceso anterior, hallamos el pOH primero, para despúes calcular el pH:
pOH= -log [OH-
] = -log 0,01= 2
pH= 14 – 2 = 12
c) El ácido clorhídrico es un ácido fuerte, por lo que se encontrará totalmente disociado:
HCl " H+
+ Cl-
De esta forma, la concentración de iones H+
será la misma que la concentración de HCl, es decir:
0,01 M.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-14-320.jpg)
![ANDALUCIA / JUNIO 99. LOGSE / QUÍMICA / CINETICA Y EQUILIBRIO / OPCION
A / CUESTIÓN nº 4
www.profes.net es un servicio gratuito de Ediciones SM
pH= -log [H+
]= -log 0,01 = 2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-15-320.jpg)
![ANDALUCIA / JUNIO 99. LOGSE / QUÍMICA / CINETICA Y EQUILIBRIO / OPCION
A / CUESTIÓN nº 6
www.profes.net es un servicio gratuito de Ediciones SM
6.- En un matraz de un litro de capacidad se introducen 0,387 moles de nitrógeno y 0,642
moles de hidrógeno, se calienta a 800 K y se establece el equilibrio:
N2(g) + 3H2 (g) [AM1] D 2NH3 (g)
encontrándose que se han formado 0,06 moles de amoníaco. Calcular:
a) La composición de la mezcla gaseosa en equilibrio.
b) Kc y Kp a la citada temperatura.
Dato: R= 0,082 atm·L·K-1
·mol-1
Solución:
a) Realizamos una tabla con los datos aportados por el problema:
N2 (g) + 3H2 (g) D 2NH3 (g)
Concentraciones iniciales: 0,387 0,642
Concentraciones reaccionantes: x 3x
Concentraciones en equilibrio: 0,387-x 0,642-3x 2x = 0,06
De donde se deduce que x = 0,03 moles/l
Sustituyendo, obtendremos la concentración de la mezcla gaseosa en el equilibrio:
[N2] = 0,387-0,03 = 0,357 moles/l
[H2] = 0,642-3·0,03 = 0,552 moles/l
[NH3] = 0,06 moles/l
b) Calcularemos el valor de Kc según:
Kc = [NH3]2
/ [H2]·[NH3]3
= (0,06)2
/ (0,357)·(0,552)3
= 0,06 (mol/l)-2
Para calcular Kp lo haremos según la relación que existe entre estas dos constantes:
Kp = Kc· (RT)Dn
Kp = 0,06 · (0,082 · 800)-2
= 1,394 · 10-5
atm-2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-16-320.jpg)
![ANDALUCIA / JUNIO 99. COU / QUIMICA / CINETICA Y EQUILIBRIO / OPCION A /
Nº 5.
www.profes.net es un servicio gratuito de Ediciones SM
5.- a) ¿Cuántos mL de disolución acuosa 0,1 M de NaOH hay que añadir a 100mL de
agua para que su pH sea 12?.
b) ¿Cuántos mL de disolución acuosa de HCl 0,01 M se necesitan para neutralizar
completamente la disolución básica de pH 12?.
Los volúmenes se consideran aditivos.
Solución:
a) El hidróxido sódico es una base fuerte que se disocia totalmente:
NaOH → Na+
+ OH-
Por lo tanto, moles iniciales de NaOH = moles finales de OH-
Conociendo el valor del pH = 12, calculamos la concentración final de OH-
.
pOH = 14 – pH pOH = 14-12 = 2 [OH-
] = 0,01 M
moles de OH-
en la disolución final = 0,01 · ( VNaOH + 0,1 )
moles de NaOH iniciales = 0,1 · VNaOH
Entonces: 0,01 · ( VNaOH + 0,1) = 0,1 VNaOH
Despejando, se obtiene que el volumen de NaOH 0,1 M necesario es VNaOH = 11,1 mL
b) Reacción de neutralización, (teniendo en cuenta que tanto la base como el ácido son fuertes y
se disocian totalmente).
NaOH + HCl → NaCl + H2O
La neutralización se produce en el punto de equivalencia donde:
equivalentes de NaOH = equivalentes de HCl
NNaOH · VNaOH = NHCl · VHCl 0,1 · 11,1 = 0,01 · VHCl
El volumen de HCl 0,01 M necesario para la neutralización es: VHCl = 111 mL](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-17-320.jpg)


![ANDALUCIA / JUNIO 99. COU / QUIMICA / CINETICA Y EQUILIBRIO/ OPCION B
/ Nº 6
www.profes.net es un servicio gratuito de Ediciones SM
6.- En un matraz de 5 litros se introduce CaCO3 y se calienta a 1000K, estableciéndose el
equilibrio:
CaCO3 (s) D CaO (s) + CO2(g)
a) ¿Cuántos gramos de CaO se obtienen?
b) ¿Qué cantidad de CaCO3 se habrá transformado?
Datos: Kc = 4 · 10-2
a 1000K. Masas atómicas: C = 12; O = 16; Ca = 40.
Solución:
a) CaCO3 (s) D CaO (s) + CO2 (g)
Inicial Co _ _
Equilibrio Co – x x x
Kc = [CO2]
En la constante de equilibrio sólo aparece el dióxido de carbono, porque es el único gas de
este equilibrio heterogéneo.
x = 4 · 10-2
M
[CaO] = [ CO2] en el equilibrio, por lo tanto los moles de CaO serán:
Moles de CaO = (4 · 10-2
M) · 5 L= 0,2 moles
Los gramos de CaO obtenidos son = 0,2 moles · 56 g/mol = 11,2 g
b) La cantidad de moles de carbonato de calcio transformados, según la estequiometría de la
reacción, serán los mismos que se han formado de óxido de calcio.
Gramos de CaCO3 transformados = 0,2 moles · 100 g/mol = 20 g](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-20-320.jpg)

![ANDALUCÍA / SEPTIEMBRE 00. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCION A / CUESTIÓN 6
www.profes.net es un servicio gratuito de Ediciones SM
6.- Para el equilibrio I2 (g) + H2(g) ⇔ 2HI(g), la constante de equilibrio Kc es 54,8 a la
temperatura de 425 'C. Calcule: a) Las concentraciones de todas las especies en el
equilibrio si se calientan, a la citada temperatura, 0,60 moles de HI y 0,10 moles de H2 en
un recipiente de un litro de capacidad. b) El porcentaje de disociación del HI.
Solución:
a) Es un equilibrio homogéneo en fase gas:
Co = n0 / V
Como el volumen del sistema es 1 litro, las concentraciones coinciden con las cantidades
molares.
2HI ⇔ I2 + H2
c.inicial 0,6 - 0,1
c.reaccionante 2x
c.equilibrio 0,6-2x x 0,1+x
La expresión de Kc según la L.A.M. es:
Kc = [I2]·[ H2] / [HI]2
Kc= x · (0,1+x) / (0,6-2x)2
= 54,8
Resolviendo la ecuación, se obtiene: x1 = 0,28 y x2= 0,31
El segundo valor se desprecia ya que resultaría una concentración de HI negativa en el
equilibrio.
Por lo tanto, las concentraciones en equilibrio serán:
[HI] = 0,6 – 2·0,28 = 0,04 mol/L
[I2 ] = 0,28 mol/L
[H2] = 0,1 + 0,28 = 0,38 mol/L
b) El grado de disociación (α) del HI, se calcula como el cociente entre el número de moles
disociados y el número de moles totales del mismo compuesto:
α = (0,6-2x) / 0,6 = 0,56 / 0,6 = 0,9333
Luego el grado de disociación del HI es de un 93,3%.
Como se puede observar se trata de un porcentaje muy alto.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-22-320.jpg)



![ANDALUCÍA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- La constante Kb del NH3 es igual a 1,8·10-5
a 25ºC. Calcule:
a) La concentración de las especies iónicas en una disolución 0,2 M de amoníaco.
b) El pH de la disolución y el grado de disociación del amoníaco.
Solución.
a) La disolución del amoníaco es el hidróxido de amonio, que es una base débil, disociada
parcialmente.
Se denomina x a la concentración de base disociada, y por tanto, de iones liberados:
NH4OH ‡ NH4
+
+ OH-
[ ]inicial 0,2 -- --
[ ]equilibrio 0,2 – x x x
La expresión de la constante de equilibrio es la siguiente:
Kb = ([OH-
] · [NH4
+
]) / [NH4OH]
Luego sustituyendo las concentraciones en el equilibrio por sus valores correspondientes, se
tiene:
Kb = x2
/ (0,2 – x)
1,8·10-5
= x2
/ (0,2 – x)
De donde:
x = 1,88·10-3
M
Por lo tanto, en el equilibrio, se tiene:
[NH4OH] = 0,198 M
[OH-
] = [NH4
+
] = 1,88·10-3
M
b) Como se tiene una disolución básica, se define:
pOH = -log [OH-
]
pOH = 2,72](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-26-320.jpg)
![ANDALUCÍA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
Y como, por el producto iónico del agua se relacionan pH y pOH, se calcula:
pH = 14 – pOH
pH = 11,3
El grado de disociación se representa con la letra griega a, e indica lo que se halla disociada
una especie, en tanto por uno.
El equilibrio de disociación del amoníaco, en función de a, quedaría:
NH4OH ‡ NH4
+
+ OH-
[ ]inicial 0,2 -- --
[ ]equilibrio 0,2· (1 – a) 0,2· a 0,2· a
Y como de comparar las expresiones en el equilibrio se tiene:
x = 0,2 · a
Y además ya se ha calculado:
x = 1,88·10-5
Se determina:
a = 9,4·10-3
= 0,94 %](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-27-320.jpg)
![ANDALUCÍA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
Cuestión 4
4. a) El pH de una disolución de un ácido monoprótico (HA) de concentración 5· 10-3
M es 2, 3. ¿Se trata de un ácido fuerte o débil? Razone la respuesta.
b) Explique si el pH de una disolución acuosa de NH4Cl es mayor, menor o igual a
siete.
Solución:
a) Se escribe el equilibrio de disociación del ácido, y con el valor de pH dado, se determina la
concentración de protones; si coincide con la concentración inicial de ácido, se puede hablar
de un ácido fuerte, pues estaría totalmente disociado en sus iones:
HA + H2O A-
+ H3O+
[ ]inicial 5 · 10-3
-- --
[ ]equil. 5 · 10-3
- x x x
pH = - log [H3O+
] = 2,3
De donde:
[H3O+
] = 5 · 10-3
= [HA ]inicial
Luego el ácido dado es fuerte.
b) Una sal en disolución está totalmente disociada en sus iones:
NH4Cl τ NH4
+
+ Cl-
Estos iones, a su vez, reaccionan con el agua:
Cl-
+ H2O τ HCl + OH-
Pero el ácido formado es fuerte, y está disociado en sus iones completamente, luego los
protones del ácido, junto con los OH-
del medio, darían un pH neutro.
NH4
+
+ H2O NH4OH + H+
Se forma una base débil, disociada sólo parcialmente, luego el pH de la disolución de la sal
vendrá dado por los H+,
generados en la hidrólisis de los iones amonio, por lo que será de
carácter ácido.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-28-320.jpg)




![CATALUÑA / JUNIO 98.COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN B / Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- Si la constante del producto de solubilidad del cloruro de plomo es 1,7⋅10-5
a) Indicar que se entiende por solución saturada. ( 0,5 ptoS)
b) Calcula la solubilidad del cloruro de plomo en mol/L . (0,75 ptos)
c) Calcula el volumen de solución saturada que se puede preparar con 1,0 g de cloruro de
plomo (II). (0,75 ptos)
Datos: Masas atómicas: Pb = 207; Cl = 35,5
Solución:
a) Disolución saturada es la disolución de una sustancia cuya concentración es la de equilibrio, con parte
de sustancia no disuelta. Es decir aquella cuya concentración coincide con el limite de la solubilidad.
b) Equilibrio de solubilidad:
PbCl2(s) D Pb2+
(aq) + 2Cl-
(aq)
Las concentraciones de cada ión seran:
[Pb2+
] = S; [Cl-
] = 2S
Por lo que sustituyendo en la expresión de Ks:
(
teniendo en cuenta el Pm de PbCl2 = 278 g/mol), la solubilidad será:
S = 1,6⋅10–2
mol/L · 278 g/mol = 4,5 g / L
c) Como en 1L se disuelven 4,5 g de esta sal, el volumen de disolución saturada que se puede preparar
con 1 g de PbCl2 será:
1 g / (4,5 g/L) = 0,22 L
Lmol
Ks
SSSSKs /106,1
4
107,1
4
;4)2( 23
5
332 −
−
?=
?
====](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-33-320.jpg)

![ANDALUCÍA/JUNIO 98. LOGSE/ QUÍMICA/ CINÉTICA YEQUILIBRIO/ OPCIÓN A/
Nº6
www.profes.net es un servicio gratuito de Ediciones SM
6.-Para la reacción:
SbCl5(g) SbCl3(g)+Cl2(g)
Kp, a la temperatura de 182ºC, vale 93,32.10-2
. En un recipiente de 0,40 litros se
introducen 0,2 moles de pentacloruro y se eleva la temperatura a 182ºC hasta que se
establece el equilibrio anterior. Calcule:
a) La concentración de las especies presentes en el equilibrio.
b) La presión de la mezcla gaseosa.
Datos: R = 0,082 atm · l / mol · K
Solución 6:
SbCl5(g) ↔ SbCl3(g)+Cl2(g)
ni 0,2
nr x x x
neq. 0,2-x x x
∆n=2-1=1
Kp=Kc(RT)∆ n
; 9,32 ⋅ 10-2
= Kc · (0,082 · 455) ; Kc = 2,498 ⋅ 10-3
mol/l
Kc =
SbCl3[ ]⋅ Cl2[ ]
SbCl5[ ]
2,5 ⋅10
−3
=
x
0,4
⋅
x
0,4
0,2 − x
0,4
x = 1,37.10-2
moles
[SbCl5] = (0,2-x) / 0,4 = 0,47mol/l
[SbCl3] = [Cl2] = x / 0,4 = 0,034mol/l
PT ·V = n T · R · T (ecuación de los gases ideales)
Siendo nT = 0,2 + x = 0,213 moles](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-35-320.jpg)


![ANDALUCÍA/ SEPTIEMBRE 98. LOGSE/ QUÍMICA/ CINÉTICA Y EQUILIBRIO/
OPCIÓN A/ Nº6
www.profes.net es un servicio gratuito de Ediciones SM
6.- Se tienen dos disoluciones, una obtenida disolviendo 0,6 g de hidróxido de sodio en 100
mL de agua y otra de ácido sulfúrico 0,25 M.
a) ¿Cuál es el pH de cada disolución?
b) ¿Qué pH tendrá una disolución obtenida al mezclar 50 mL de cada una?
Datos:Masa atómicas: H=1; O=16; Na=23
Solución 6:
a) Mm(NaOH)= 1+16+23= 40
0150
40
60
′=
′
==
Mm
m
n moles de NaOH M = 0,015 / 0,1 = 1,5 · 10-3
mol/l
NaOH → Na+
+ OH-
[OH-
] = 1,5 · 10-3
mol/l
pOH= -log[OH-
] = 2,82 ; pH = 14-pOH = 14 – 2,82 = 11,18
H2SO4 + H 2O → 2H30+
+ SO4
2-
(se supone total disociación)
[H2SO4] = 0,25 M
[H30+
] = 2 · 0,25 = 0,5 M; pH= -log[H30+
] = 0,3
b) Entre el ácido y la bases fuertes tiene lugar una reacción de neutralización:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Con cada mol de iones hidronio reacciona un mol de iones oxhidrilo:
H30+
+ OH-
→ H2O
n H30+
= V· M = 0,05 · 0,50 = 0,025 = 2,5 · 10-2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-38-320.jpg)
![ANDALUCÍA/ SEPTIEMBRE 98. LOGSE/ QUÍMICA/ CINÉTICA Y EQUILIBRIO/
OPCIÓN A/ Nº6
www.profes.net es un servicio gratuito de Ediciones SM
n OH-
= V· M = 0,05 · 1,5 ·10-3
= 7,5 · 10-5
Luego quedarán sin neutralizar 2,49 ·10-5
moles de iones H30+
.
pH= -log[H30+
] = 1,60](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-39-320.jpg)
![COMUNIDAD DE ARAGÓN /JUNIO 2004. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN 1 / CUESTIÓN 3
3) En una valoración ácido-base se valora un ácido débil (HA) con una base fuerte
(BOH). Al llegar al punto final razone sobre la veracidad de las siguientes afirmaciones:
a) Sólo se han neutralizado parte de los iones OH-
de la base.
b) El pH en el punto de equivalencia es 7
c) Se han gastado los mismos moles de ácido que de base.
(1,5 puntos)
SOLUCIÓN CUESTIÓN 3 (OPCIÓN 1)
a) Falsa, han reaccionado todos iones OH-
de la base, pero la sal formada se hidroliza
con el agua y el anión A-
, del ácido débil, reacciona nuevamente con el agua
produciendo iones OH-
:
HA + BOH BA + H2O
BA → A-
+ B+
A-
+ H2O HA + OH-
b) El pH en el punto de equivalencia será mayor de 7, debido a la reacción de hidrólisis de
la sal y posterior reacción del anión A-
con el agua. El pH se calcula a partir de la
constante de hidrólisis del ácido débil conjugado (HA):
A-
+ H2O HA + OH-
pOH = -log [OH-
], pH = 14 - pOH
c) Verdadera, la estequiometría de la reacción indica que cada mol de ácido reacciona con
un mol de la base.
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-40-320.jpg)

![COMUNIDAD DE ARAGÓN /JUNIO 2004. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN 1/ CUESTIÓN 4
c
c
0,11M 0,11M
K = ;
0,06M 0,06M
K =3,36
i
i
H2 CO2 CO H2O
Concentraciones
iniciales 0,06 M 0,06 M
0,11M+ 0,4moles/5 l
0,19 M 0,11M
Concentraciones
en el equilibrio 0,06 M + x 0,06 M + x 0,19 M - x 0,11M - x
Aplicando la ley de acción de masas:
( )( )
( )( )
( )( )
( )
c 2
0,19 - x 0,11 - x 0,19 - x 0,11 - x
K = , 3,36=
0,06 + x 0,06 + x 0,06 + x
Resolviendo nos queda una ecuación de segundo grado en x: 2,36x2
+ 0,7032x - 8,9.10-3
.
Cuya solución es: x = 0,012 M.
Las nuevas concentraciones de todas las especies en el equilibrio son:
[H2] = 0,072 M
[CO2] = 0,072 M
[CO] = 0,178 M
[H2O] = 0,098 M
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-42-320.jpg)

![COMUNIDAD DE ARAGÓN /SEPTIEMBRE/ 2004/ LOGSE / QUÍMICA / CINÉTICA
Y EQUILIBRIO / OPCIÓN 1/CUESTIÓN 5
OPCIÓN 1.
Cuestión 5.
Calcule el pH de la disolución que resulta cuando se añaden 0,8 litros de ácido acético 0,25 M
a 0,2 litros de hidróxido de sodio 1,0 M. Ka (ácido acético) = l,8xl0-5
(2,5 puntos)
SOLUCION CUESTIÓN 5 (OPCIÓN 1)
La reacción entre el ácido acético y el hidróxido de sodio es:
CH3COOH + NaOH → CH3COONa + H2O
La estequiometría de la reacción nos indica que el ácido y la base reaccionan mol a mol:
Moles de CH3COOH 0,8 L x 0,25 M = 0,2 moles de ácido acético.
Moles de NaOH, 0,2 L x 1 M = 0,2 moles de hidróxido de sodio
Por lo tanto, se consumen totalmente ambos reactivos obteniéndose 0,2 moles de acetato de
sodio.
La concentración del CH3COONa será:
0,2 moles
0,2 M
0,8 L + 0,2 L
=
El acetato de sodio en disolución acuosa se hidroliza totalmente:
CH3COONa → CH3COO-
+ Na+
El ión acetato, al ser una base débil, reacciona con el agua estableciéndose el siguiente
equilibrio:
CH3COO-
+ H2O CH3COOH + OH-
La disolución tendrá por lo tanto carácter básico y para calcular el pH de la misma, primero
tendremos que saber cual es la concentración de OH-
en el equilibrio.
CH3COO-
H2O CH3COOH OH-
Concentraciones
iniciales
0,2 M _ 0 0
Concentraciones
en el equilibrio
0,2 - x x x
La constante de equillibrio es:
[ ] -
3
b -
3
CH COOH OH
K =
CH COO
⎡ ⎤⎣ ⎦
⎡ ⎤⎣ ⎦
El problema nos da como dato la Ka de ácido acético, pero podemos calcular la Kb del ión
acetato, ya que ambas constantes están relacionadas con el producto iónico del agua (Kw = 1.
10-14
) a través de la siguiente ecuación: b a wK .K = K
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-44-320.jpg)




![COMUNIDAD DE ARAGÓN /SEPTIEMBRE/ 2004/ LOGSE / QUÍMICA / CINÉTICA
Y EQUILIBRIO / OPCIÓN 2/CUESTIÓN 5
OPCIÓN 2.
Cuestión 5. En un reactor de 2,5 litros se introducen 72 g de SO3. Cuando se alcanza el
equilibrio
SO3(g) SO2(g) + ½ O2(g)
a 200°C, se observa que la presión total en el interior del recipiente es 18 atmósferas.
Calcule Kc y Kp para el equilibrio anterior a 200°C.
Masas atómicas: Azufre = 32; oxígeno = 16.
R = 0,082 atm.l/mol.K
(2,5 puntos)
SOLUCIÓN CUESTIÓN 5 (OPCIÓN 2)
Se trata de un equilibrio homogéneo en fase gaseosa, en la que se introducen:
3
3 3
1
72 0,9
80
mol SO
g SO moles SO
g
× =
En el equilibrio:
Equilibrio 3 2SO (g) O (g) + ½ O (g)S 2
Nº de Moles iniciales 0,9 0 0
Nº de Moles en el equilibrio 0,9 –X moles X moles X/2 moles
Concentraciones en el equilibrio 0,152 moles/L 0,208 moles 0,1040 moles/L
Para este equilibrio el valor de KC es:
[ ]
1/ 2
1/2
2 2
3
/ 2
[ ] 2,5 2,5
0,9
2,5
C
X X
SO O L L
K
XSO
L
⎛ ⎞ ⎛ ⎞
×⎜ ⎟ ⎜ ⎟
⎝ ⎠ ⎝ ⎠= =
⎡ ⎤ ⎛ ⎞−⎣ ⎦ ⎜ ⎟
⎝ ⎠
, para poder calcular Kc, necesitamos conocer X.
Para calcular X, utilizamos que cuando se alcanza el equilibrio a 200 ºC, la presión total en el
recipiente es de 18 atmósferas. Teniendo en cuenta que se consideran gases perfectos:
T TP V n RT= , siendo nT, el número total de moles en el equilibrio.
nT = (0,9-X) + (X) + (X/2) = 0,9 + X/2,
Sustituyendo en la ecuación anterior.
( )( )(0,9 ) 0,082 · / · 473
2
18
2,5
T T
T
P V n RT
X
moles atm L K mol K
P a
L
=
⎛ ⎞
+⎜ ⎟
⎝ ⎠= = tm
Resolviendo la ecuación anterior, se obtiene que X = 0,52 moles y las concentraciones en el
equilibrio son:
[SO3] = 0,152 moles/L¸[SO2] = 0,208 moles/L y [O2] = 0,1040 moles/L. Sustituyendo en la
ecuación de Kc:
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-49-320.jpg)
![COMUNIDAD DE ARAGÓN /SEPTIEMBRE/ 2004/ LOGSE / QUÍMICA / CINÉTICA
Y EQUILIBRIO / OPCIÓN 2/CUESTIÓN 5
[ ] ( ) ( )
( )
1/2 1/ 2
2 2 1/ 2
3
[ ] 0,208 0,104
0,44( / )
0,152
C
SO O
K m
SO
×
= = =
⎡ ⎤⎣ ⎦
oles L
Para calcular Kp, utilizamos la relación entre Kc y Kp:
( ) n
P CK K RT ∆
=
Siendo ∆n la variación en el número de moles, que en este caso es:
∆n = (1/2 + 1) – 1 = ½
Sustituyendo se obtiene Kp
1/ 2 1/2 1/ 2
( ) 0,44( / ) [(0,082 · / · )(473 )] 2,748( .)n
P CK K RT moles L atm L K mol K atm∆
= = =
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-50-320.jpg)


![ARAGÓN / JUNIO 00. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
OPCION I / EJERCICIO 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- Se tienen dos disoluciones 0,10 M, una de hidróxido de sodio y otra de amoniaco.
Calcule el pH de cada una de estas disoluciones y comente las diferencias obtenidas.
Kb (amoniaco) = 1,8·10-5
(2,5 puntos)
Solución:
Disolución 0,1 M de NaOH
El hidróxido sódico es una base fuerte, que se disocia completamente en disolución acuosa:
NaOH → Na+
+ OH-
Como la concentraciónde los iones OH-
que provienen de la base es mucho mayor a la que
proviene del equilibrio del agua, esta última es despreciable y el pH lo calcularemos a partir
de los iones OH-
que provienen de la base.
pH = - log [H+
]
A partir del equilibrio iónico del agua Kw = [H+
]·[OH-
] = 10-14
Aplicando logaritmos a esta expresión resulta:
14 = pH + pOH
pH = 14 – pOH
Conocemos la [OH-
] que coincide con la concentración inicial de hidróxido, ya que este se
disocia completamente, entonces:
pOH = -log (0,1) = 1
pH = 14 – 1 = 13
Disolución 0,1 M de NH3 cuya K = 1,8·10-5
, es una base débil.
Equilibrio de disociación básica: NH3 + H2O • NH4
+
+ OH-
Aplicando la constante de basicidad Kb = [NH4
+
]·[OH-
] / [NH3]
NH3 + H2O • NH4
+
+ OH-](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-53-320.jpg)
![ARAGÓN / JUNIO 00. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
OPCION I / EJERCICIO 5
www.profes.net es un servicio gratuito de Ediciones SM
Inicialmente: 0,1 mol/L --- ---
Reacciona: x --- ---
Se forma: --- x x
Equilibrio: 0,1 – x x x
Sustituyendo en la ecuación anterior : 1,8·10-5
= x · x / 0,1 – x = x2
/ 0,1 – x
x2
+ 1,8·10-5
x – 1,8·10-6
= 0
Resolviendo esta ecuación de segundo grado, obtenemos dos valores para x = [OH-
]
x1 = -1,35·10-3
que no tiene sentido químico, ya que una concentración no puede ser negativa.
x2 = 1,3·10-3
si tiene sentido.
Entonces [OH-
] = 1,3·10-3
mol/L
pOH = -log[OH-
] = - log (1,3·10-3
) = 2,9
pH = 14 – pOH
pH = 14 – 2,9 = 11,1](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-54-320.jpg)


![ARAGÓN / JUNIO 00. COU / QUIMICA / CINETICA Y EQUILIBRIO / OPCION I /
EJERCICIO 7
www.profes.net es un servicio gratuito de Ediciones SM
7.- Se tienen dos disoluciones 0,10 M, una de hidróxido de sodio y otra de amoniaco.
Calcule el pH de cada una de estas disoluciones y comente las diferencias obtenidas.
Kb (amoniaco) = 1,8·10-5
(2,5 puntos)
Solución:
Disolución 0,1 M de NaOH
El hidróxido sódico es una base fuerte, que se disocia completamente en disolución acuosa:
NaOH → Na+
+ OH-
Como la concentraciónde los iones OH-
que provienen de la base es mucho mayor a la que
proviene del equilibrio del agua, esta última es despreciable y el pH lo calcularemos a partir
de los iones OH-
que provienen de la base.
pH = - log [H+
]
A partir del equilibrio iónico del agua Kw = [H+
]·[OH-
] = 10-14
Aplicando logaritmos a esta expresión resulta:
14 = pH + pOH
pH = 14 – pOH
Conocemos la [OH-
] que coincide con la concentración inicial de hidróxido, ya que este se
disocia completamente, entonces:
pOH = -log (0,1) = 1
pH = 14 – 1 = 13
Disolución 0,1 M de NH3 cuya K = 1,8·10-5
, es una base débil.
Equilibrio de disociación básica: NH3 + H2O • NH4
+
+ OH-
Aplicando la constante de basicidad Kb = [NH4
+
]·[OH-
] / [NH3]](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-57-320.jpg)
![ARAGÓN / JUNIO 00. COU / QUIMICA / CINETICA Y EQUILIBRIO / OPCION I /
EJERCICIO 7
www.profes.net es un servicio gratuito de Ediciones SM
NH3 + H2O • NH4
+
+ OH-
Inicialmente: 0,1 mol/L --- ---
Reacciona: x --- ---
Se forma: --- x x
Equilibrio: 0,1 – x x x
Sustituyendo en la ecuación anterior : 1,8·10-5
= x · x / 0,1 – x = x2
/ 0,1 – x
x2
+ 1,8·10-5
x – 1,8·10-6
= 0
Resolviendo esta ecuación de segundo grado, obtenemos dos valores para x = [OH-
]
x1 = -1,35·10-3
que no tiene sentido químico, ya que una concentración no puede ser negativa.
x2 = 1,3·10-3
si tiene sentido.
Entonces [OH-
] = 1,3·10-3
mol/L
pOH = -log[OH-
] = - log (1,3·10-3
) = 2,9
pH = 14 – pOH
pH = 14 – 2,9 = 11,1](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-58-320.jpg)
![ARAGÓN / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN 1 /
CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- Se preparan 100 ml de una disolución de amoniaco, diluyendo con agua 2 ml de
amoniaco del 30,0% en peso y de densidad 0,894 g / ml. Calcular:
a) La concentración de la disolución diluida.
b) El pH de la disolución.
Datos: Masas atómicas: N = 14 ; O = 16 ; H = 1.
Kb (amoniaco) = 1,8·10-5
Solución:
a) La disolución del amoníaco es el hidróxido de amonio, que es una base débil, disociada
parcialmente.
Con la densidad y la riqueza, se calcula la masa real de soluto presente en la disolución, y a
partir de ella y con su masa atómica, su molaridad y normalidad:
Masa de NH4OH = 894 g / L · (30 / 100) = 268,2 g/L
M = 268,2 / 35 = 7,66 mol/L
N = M · valencia = 7,66 eq/L
A partir de esta disolución, cuya concentración se acaba de hallar, conociendo el volumen
tomado y el volumen final al que se llega, se determina la concentración de la disolución
final:
(N · V) c = (N · V) d
7,66 · 2 = Nd · 100
De donde se tiene:
Nd = 0,15 eq/L
b) Se denomina x a la concentración de base disociada, y por tanto, de iones liberados:
NH4OH ‡ NH4
+
+ OH-
[ ]inicial 0,15 -- --
[ ]equilibrio 0,15 – x x x](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-59-320.jpg)
![ARAGÓN / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN 1 /
CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
La expresión de la constante de equilibrio es la siguiente:
Kb = ([OH-
] · [NH4
+
]) / [NH4OH]
Luego sustituyendo las concentraciones en el equilibrio por sus valores correspondientes, se
tiene:
Kb = x2
/ (0,15 – x)
1,8·10-5
= x2
/ (0,15 – x)
De donde:
x = 1,63·10-3
M
Por lo tanto, en el equilibrio, se tiene:
[OH-
] = [NH4
+
] = 1,63·10-3
M
Como se tiene una disolución básica, se define:
pOH = -log [OH-
]
pOH = 2,78
Y como, por el producto iónico del agua se relacionan pH y pOH, se calcula:
pH = 14 – pOH
pH = 11,2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-60-320.jpg)



![ARAGÓN / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN 1 /
CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN 1
CUESTIÓN 1
1.- En dos vasos, A y B, se tienen dos disoluciones de la misma concentración. El vaso A
contiene 25 mL de una disolución de NaOH y el vaso B 25 mL de una disolución de
amoniaco. Las dos disoluciones se van a valorar con una disolución HCl. Indique
razonadamente si son verdaderas o falsas las siguientes cuestiones:
a) Las dos disoluciones básicas tienen el mismo pH inicial.
b) Las dos disoluciones necesitan el mismo volumen HCl para su valoración.
c) En el punto de equivalencia el pH de la valoración de B es 7.
d) En las dos disoluciones se cumple que en el punto de equivalencia [H+
] =[OH-
].
Kb(amoniaco) = 1,8 · 10- 5
Solución:
a) Es falso, el NaOH es una base fuerte, totalmente disociada en sus iones, luego la
concentración final de iones será la inicial de base:
NaOH t Na+
+ OH-
[inicial] Co -- --
[final] -- Co Co
Mientras que el NH4OH es una base débil y sólo se disocia parcialmente, reaccionando "x"
moles / L del total (Co):
NH4OH ‡ NH4
+
+ OH-
[inicial] Co -- --
[final] Co - x x x
b) Verdadero, ambas son bases con un único grupo OH-
, luego necesitarán los mismo
protones para neutralizarse, y formar la sal correspondiente y agua.
NaOH + HCl t NaCl + H2O
NH4OH + HCl t NH4Cl + H2O
c) Falso, pues la sal formada se disocia completamente, y los iones, al proceder de una base
débil, se hidrolizan, desprendiendo protones, el pH será menor que 7:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-64-320.jpg)

![ARAGÓN / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN 1
/ CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN 1
CUESTIÓN 5
Una mezcla de 2,5 moles de nitrógeno y 2,5 moles de hidrógeno se coloca en un reactor
de 25,0 litros y se calienta a 400 ºC. En el equilibrio a reaccionado el 5% del nitrógeno.
Calcule:
a) Los valores de las constantes de equilibrio Kc y Kp, a 400 ºC.
b) Las presiones parciales de los gases en el equilibrio.
R = 0,082 atm · L / (mol · K)
Solución:
a) El equilibrio dado es el siguiente, en el que se especifican las concentraciones iniciales y en
el momento de dicho equilibrio:
Las Concentraciones iniciales se hallan dividiendo los moles indicados entre el volumen total
del reactor:
[inicial N2] = [inicial H2] = 2,5 / 25 = 0,1 M
Y se denomina grado de disociación, expresado en %, a la fracción que reacciona, en este
caso es del 5% = 0,05.
N2 (g) + 3 H2 (g) ‡ 2 NH3 (g)
[inicial] 0,1 0,1 --
[equilibrio] 0,1 · (1 - 0,05) 0,1 · (1 - 3 · 0,05) 2 · 0,1 · 0,05
La expresión de Kc es:
Kc = [NH3]2
/ ([N2] · [H2]3
)
Y sustituyendo por las concentraciones en le equilibrio:
Kc = (2 · 0,1 · 0,05)2
/ ((0,1 · (1 - 0,05) · (0,1 · (1 - 3 · 0,05))3
) = 6,7 · 105
La relación entre Kc y Kp es la siguiente, luego el valor de Kp será:
Kp = Kc · (R · T) Dn
Donde Dn es la diferencia entre los moles de productos gaseosos y los de reactivos gaseosos:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-66-320.jpg)

![ARAGÓN / JUNIO98. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN 1 /
Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- a) Tenemos un indicador acido-base cuya forma no disociada HA es incolora, y su
forma ionica A-
es roja. Indique razonadamente que cambio de color se observara en la
valoración de ácido Clorhídrico con hidróxido de sodio si se utiliza el indicador anterior.
(1 punto.)
b) Explique si el pH de las disoluciones acuosas de los siguientes compuestos será mayor,
menor o igual a 7: Cloruro de amonio, amoniaco, Cloruro de potasio y acetato de sodio.
(1 punto.)
Solución:
a) Los indicadores son ácidos o bases débiles que toman diferente tonalidad según se
encuentren en medio ácido o básico, es decir, en su forma molecular o en su forma disociada.
En nuestro caso, el equilibrio de disociación del indicador es:
HA + H2O ⇔ A-
+ H3O+
Según el principio de Le Chatelier, el equilibrio se desplazará hacia la derecha o hacia la
izquierda según sea el pH del medio.
Hasta llegar al punto de equivalencia, en el medio existirán los iones procedentes del HCl que
se valora, por lo que el pH será ácido (aunque cada vez menos). El equilibrio de disociación
estará desplazado hacia la formación de HA y H2O por el efecto del ion común.
El indicador estará en su forma molecular y la disolución será incolora. Hasta que se añada
NaOH por encima del punto de equivalencia. Entonces, los OH-
reaccionarán con los H3O+
. El
equilibrio de disociación del indicador se desplazará hacia la derecha para mantener constante
[H3O+
]. El indicador se encontrará su forma disociada y la disolución tomara color rojo.
b) NH4Cl: Al producirse la disociación de la sal se origina el ion Cl-
y el
ion NH4
+
. El ion Cl-
, al proceder de un ácido fuerte (HCl), no reaccionará con el agua,
mientras que el ion NH4
+
, por proceder de una base débil, producirá una reacción de hidrólisis
ácida con el agua. Por tanto, pH < 7 .
La reacción será: NH4
+
+ 2 H2O ⇔ NH4OH + H3O+
NH3: Este compuesto es una base débil, por lo que originará pH > 7.
La reacción con el agua es: NH3 + H2O ⇔ NH40H + OH-
KCl: Es una sal que procede de un ácido fuerte (HCl) de una base fuerte (KOH). Al
producirse la disociación de la sal, se originan Cl-
y K+
, que no reaccionarán con el agua. El
pH de la disolución resultante será de 7.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-68-320.jpg)






![ARAGÓN / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN 1 / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- Cuando a 50 ml de una disolución 0,10 M de un ácido monoprótico débil, cuya
constante de disociación vale 3,5·10-8
, se le añaden 450 ml de agua, calcule:
a) La variación del grado de disociación del ácido.
b) La variación del pH de la disolución.
Solución:
Se escribe el equilibrio de disociación del ácido débil dado, y se escribe la concentración
inicial del problema, y esa misma concentración menos “x”, que es lo que se ha disociado en
el equilibrio:
HA + H2O D A-
+ H3O+
[ ]inicial 0,1 -- --
[ ]equilibrio 0,1 – x x x
La expresión de la constante de equilibrio para un ácido débil será:
Ka = ([A-
] · [H3O+
]) / [HA]
3,5·10-5
= x2
/ (0,1 – x)
De donde se tiene:
x = 5,91·10-5
M
Y por lo tanto, y atendiendo a las definiciones de grado de disociación (a ) y de pH, se
determinan:
0,1 ·a = 5,91·10-5
a = 5,91·10-4
= 0,059%
pH = -log [H3O+
]= -log (0,1 · 5,91·10-4
) = 4,2
Como era de esperar, es una disolución con carácter ácido (pH < 7).
Lo que se hace al añadir agua a los 50 ml de disolución de ácido es diluirla, por lo que se
determina la concentración de la disolución final:
(N · V)c = (N · V)d
50 · 0,1 = Nd · (450 + 50)
Nd = 0,01 N](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-75-320.jpg)
![ARAGÓN / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN 1 / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
Se procede del mismo modo, pero con el nuevo valor de concentración:
HA + H2O D A-
+ H3O+
[ ]inicial 0,01 -- --
[ ]equilibrio 0,01 – x x x
Ka = ([A-
] · [H3O+
]) / [HA]
3,5·10-5
= x2
/ (0,01 – x)
De donde se tiene:
x = 1,87·10-5
M
Y por lo tanto:
0,01 · a = 1,87·10-5
a = 1,87·10-3
= 0,187%
pH = -log [H3O+
]= -log (0,01 · 1,87· 10-3
) = 4,7
Como era de esperar resulta una disolución con carácter ácido (pH < 7), pero menos algo
menos ácida que la disolución original por el efecto de la dilución.
Luego ya se puede responder a las dos cuestiones planteadas:
a) La variación del grado de disociación será un cierto aumento:
1,87·10-3
- 5,9·10-4
= 1,28·10-3
= 0,128%
b) La variación del pH será un aumento:
4,7 – 4,2 = 0,5](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-76-320.jpg)
![ARAGÓN / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN 1 / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- Se desean preparar 500 ml de una disolución de amoníaco 1,20 M a partir de una
disolución de amoníaco del 27,3 % en peso y de 0,900 g /ml de densidad. Calcule:
a) El volumen que hay que tomar de la disolución del 27,3 %.
b) El pH de la disolución preparada de amoníaco.
Kb (amoníaco) = 1,8 · l0-5
. Masas atómicas: nitrógeno = 14; hidrógeno = 1.
Solución:
El amoníaco en disolución es el hidróxido de amonio: NH4OH
Se determina la molaridad con la densidad, riqueza y masa molecular, considerando volumen
un litro:
M = (900 · (27,3 / 100) ) / 35 = 7,02 mol/L
Como sólo tiene un grupo OH, coinciden molaridad y normalidad:
N = 7,02 eq/L
a) Se va a diluir esta disolución de mayor concentración, para obtener 500 mL de otra 1,20 N:
Nº equivalentes diluida = nº equivalentes concentrada
(N· V) d = (N · V) c
Por lo que:
7,02· Vc = 1,20 · 500
V c = 85,5 mL del NH4OH concentrado harán falta.
b) Se trata de una base débil, que se disocia parcialmente, según:
NH4OH NH4
+
+ OH-
[ ]inicial 1,20 -- --
[ ]equilibrio 1,20 - x x x
Se ha llamado "x" a la cantidad de base disociada.
Se sustituye en la expresión de Kb, y se halla "x":](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-77-320.jpg)
![ARAGÓN / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN 1 / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
Kb = ([NH4
+
]· [OH-
]) / [NH4OH]
De donde:
x = 4,24 · 10-3
M
Y como:
pOH = - log [OH-
] = 2,37
De donde se obtiene:
pH = 14 - pOH
pH = 11,63
Como era de esperar es un pH básico.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-78-320.jpg)



![ARAGÓN / SEPTIEMBRE 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN 1 / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN 1
CUESTIÓN 5
Se dispone d una botella de ácido acético de densidad 1,05 g / mL y riqueza en masa
99,2%.
a) Calcule el volumen que hay que tomar de esta disolución para preparar 500 mL de
disolución de ácido acético 1,0 M.
b) Calcule el pH de la disolución preparada.
Masas atómicas: C = 12 ; 0 = 16 ; H = 1
Ka (ácido acético) = 1,8 · 10– 5
.
Solución:
a) Se determinan los gramos de acético puro presentes en la disolución (haciendo uso de la
densidad y la riqueza dadas), y con ellos, la molaridad:
masa de acético puro = 1050 · (99,2 / 100) = 1041,6 g
moles de acético puro = 1041,6 / 60 = 17,36 moles
M de 1 L de disolución de acético = 17,36 M
Al diluir una disolución se cumple:
nº equivalentes concentrada = nº equivalentes diluida
O lo que es lo mismo:
(N · V) c = (N · V) d
Para el caso dado, se pide el volumen de la disolución anterior (la concentrada) necesario para
preparar 0,5 L de otra más diluida, concretamente 1 M; luego:
17,36 · Vc = 1 · 0,5
De donde:
Vc = 0,0288 L = 28,8 mL harían falta
b) Es un ácido débil, luego estará parcialmente disociado:
HAc + H2O t Ac-
+ H3O+
[inicial] 1 -- --](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-82-320.jpg)
![ARAGÓN / SEPTIEMBRE 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN 1 / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
[equilibrio] 1 - x x x
La expresión de la constante de equilibrio, será:
Kc = ([Ac-
] · [H3O+
]) / [HAc]
Y sustituyendo su valor, dado en el enunciado, se despeja la cantidad disociada, "x":
1,8 · 10-5
= x2
/ (1 - x)
Ya se tiene:
x = 4,24 · 10-3
M
Y por definición:
pH = - log · [H3O+
] = - log 4,24 · 10-3
= 2,37
Como era de esperar, es un disolución ácida, de pH menor que 7.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-83-320.jpg)
![ARAGON / SEPTIEMBRE 98.LOGSE / QUIMICA / CINETICA Y EQUILIBRIO/
OPCION 1 / Nº 1.
www.profes.net es un servicio gratuito de Ediciones SM
1.- En el proceso de preparación del metanol:
CO(g) + 2H2 ⇔ CH3OH(g) ∆H<0
a) Indique las condiciones de presión y temperatura (altas o bajas) que más favorezcan
la obtención del metanol.
b) Escriba la expresión de la constante Kp y explique cómo variará esta constante al
aumentar la temperatura.
Solución:
a) Según el principio de Le Chatelier, que dice que si se modifica una condición de un sistema
en equilibrio químico, el sistema evoluciona oponiéndose al cambio.
Como la reacción es exotérmica, una temperatura baja favorecería la formación del metanol.
Como el incremento de moles es Dn = -1, un aumento de presión desplazaría la reacción hacia
la derecha, por lo que la presión debe ser baja.
b) Expresión de la constante Kp
[ ]
[ ][ ]2
22
3
HCO
OHCH
Kp =
Un incremento de la temperatura provocará una disminución en la Kp ya que disminuiría la
concentración de productos.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-84-320.jpg)



![CANTABRIA / JUNIO 00.LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /OPCION
I / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
I-2.- En un recipiente cerrado vacío de 2 litros se introduce una cantidad de carbonato
de plata. Se eleva la temperatura a 110ºC y el carbonato de plata se descompone según el
equilibrio:
Ag2CO3 (s) • Ag2O (s) + CO2 (g)
Cuando se alcanza el equilibrio se han descompuesto 176,6 mg de carbonato de plata.
Calcular:
a) (1 punto) El valor de Kp y Kc para el equilibrio a 110ºC.
b) (0,5 puntos) La presión total en el equilibrio.
c) (0,5 puntos) El peso de dióxido de carbono en el equilibrio.
DATOS: Masas atómicas: C = 12; O = 16; Ag = 108, R = 0,082 atm·L/K·mol
Solución:
a) Reacción de descomposición: Ag2CO3 (s) • Ag2O (s) + CO2 (g)
Inicialmente: C0 -- --
Se descompone: x -- --
Se forman: -- x x
Equilibrio: C0 – x x x
El nº de moles de carbonato de plata descompuestos es :
nº de moles = m (g) / Mm
nº de moles = 176,6 / 276 = 6,39·10-4
moles
Por lo tanto la concentración x será:
[x] = nº de moles / V(L) = 6,39·10-4
/ 2 = 3,19·10-4
mol/L
A partir de la Ley de Acción de Masas, en cuya ecuación sólo intervienen las sustancias
gaseosas (ya que los sólidos tienen actividad 1), obtenemos el valor de Kc.
Kc = [CO2]
Kc = 3,19·10-4
Dado que la relación entre Kp y Kc es:
Kp = Kc · (RT)∆n](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-88-320.jpg)


![CANTABRIA / JUNIO 00. SELECTIVIDAD / QUIMICA / CINETICA Y EQUILIBRIO
/ OPCION I./ PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- En un recipiente cerrado y vacío de 10 litros se ponen en contacto 4,4 g de dióxido de
carbono con carbono sólido a 850ºC y se establece el equilibrio:
C (s) + CO2 (g) • 2CO (g)
El valor de Kc para este equilibrio a 850ºC es de 0,153. Calcular:
a) (0,5 puntos) El valor de Kp para este equilibrio a 850ºC
b) (1 punto) La presión total en el equilibrio.
c) (0,5 puntos) La presión parcial del monóxido de carbono en el equilibrio.
d) (0,5 puntos) El peso de dióxido de carbono en el equilibrio.
DATOS: Masas atómicas: C = 12; O = 16.
R = 0,082 atm·L/K·mol.
Solución:
a) Existe una fórmula que relaciona Kc con Kp
Kp = Kc · (RT)∆n
Sustituyendo los datos del problema:
Kc = 0,153; R = 0,082 atm·L/K·mol; T = 25+273 = 298 K; ∆n = 2-1 = 1 , se obtiene:
Kp = 0,153 · ( 0,082 · 298 ) = 14,089
b) Para calcular la presión total en el equilibrio, es necesario conocer el nº de moles gaseosos
en el equilibrio heterogéneo, que los calculamos a partir de la expresión de Kc:
Reacción: C (s) + CO2 (g) • 2 CO (g)
n iniciales 0,1
n reaccionantes x
n equilibrio 0,1 – x 2x
Kc = [CO]2
/ [CO2] =
10/)1,0(
)10/2( 2
x
x
−
0,153 = 4x2
/ 1-10x
4x2
+ 1,53x – 0,153 = 0
Resolviendo esta ecuación de segundo grado, salen dos soluciones, una de ellas es negativa
por lo que no tiene sentido químico.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-91-320.jpg)

![CANTABRIA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
CUESTIÓN D
www.profes.net es un servicio gratuito de Ediciones SM
D. La descomposición del hidrogenocarbonato sódico tiene lugar según el equilibrio:
2 NaHCO3 (s) Na 2CO3 (s) + CO2 (g) + H2O (g) DDHº =129 KJ
Contestar razonadamente:
a) [0.5 puntos] ¿Favorece la descomposición un aumento de la temperatura?
b) [0.5 puntos] ¿Favorece la descomposición un aumento de la presión?
c) [0.5 puntos ¿Favorece la descomposición la adición de más hidrogenocarbonato
sódico?
d) [0.5 puntos] ¿Favorece la descomposición la retirada de dióxido de carbono y vapor
de agua?
Solución:
Si en un equilibrio se introduce alguna modificación externa (temperatura, presión o
concentraciones), el equilibrio evolucionará en el sentido en que se oponga al cambio
provocado.
a) Un aumento de temperatura, hace que el sistema tienda a absorber energía, desplazándose
en el sentido en que la reacción sea endotérmica, que es precisamente de izquierda a derecha,
favoreciendo pues la descomposición.
b) Un aumento de presión, hace que el equilibrio se desplace en el sentido en que haya menos
moles, para que se mantenga P·V = cte; luego se desplazará hacia la izquierda, que no es el
sentido que favorece la descomposición.
c) Si se adiciona más reactivo, el equilibrio no se altera pues es una especie sólida.
d) La retirada de los productos de la reacción, fomenta el incremento de su producción, luego
sí se favorece la descomposición.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-93-320.jpg)
![CANTABRIA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN I / PROBLEMA Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
Opción de problemas I
I-2. En un recipiente cerrado de 0,5 litros, en el que se ha hecho el vacío, se introducen
2,3 gramos de tetraóxido de dinitrógeno, y a la temperatura de 35 ºC se alcanza el
equilibrio:
N2O4 (g) 2 NO2 (g)
El valor de Kc para este equilibrio a 35ºC es 0,01. Calcular:
a) El valor de Kp para este equilibrio a 35ºC.
b) El grado de disociación del tetraóxido de dinitrógeno.
c) La presión total en el equilibrio.
DATOS: Masas atómicas: N = 14; O =16.
R= 0,082 atm· L/mol· K.
Solución:
Se conoce la masa de N2O4 utilizada en la reacción, luego se determinan sus moles, y con
ellos y el volumen total, la concentración inicial:
Moles de N2O4 = 2,3 / 92 = 0,025 moles
[N2O4] inicial = 0,025 / 0,5 = 0,05 M
El equilibrio dado es:
N2O4 2 NO2
[ ]inicial 0,05 --
[ ]equil. 0,05 - x 2 · x
a) La expresión que relaciona Kc y Kp es:
Kp = Kc · (R· T)Dn
Donde Dn es la diferencia entre los moles de productos gaseosos, y los moles de los reactivos
gaseosos.
En el equilibrio dado Dn = 1 ; luego Kp = Kc· R· T = 0,01 · 0,082· 308 = 0,252](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-94-320.jpg)
![CANTABRIA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN I / PROBLEMA Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
b) Se ha llamado "x" a la cantidad (en moles / L) de productos formada).
Sustituyendo en la expresión de la Kc, se determina el valor de "x":
Kc = [NO2]2
/ [N2O4] = 0,01
De donde:
0,01 = (2 · x)2
/ (0,05 - x)
Y así se tiene:
x = 0,01 M
Luego en el equilibrio se tendrá:
[NO2]=2· x = 0,02 mol/L
[N2O4] = 0,05 - x = 0,04 mol/L
Otra forma de expresar las concentraciones en el equilibrio es en función del grado de
disociación, a:
N2O4 2 NO2
[ ]inicial 0,05 --
[ ]equil. 0,05 · (1 - a) 0,05 · 2· a
Se toma el caso del producto, y se iguala esta expresión en función de a con la anterior, en
función de "x", de valor ya conocido, llegando a:
0,05· 2· a = 2 · x = 0,02 M
De donde se obtiene:
a = 0,2 = 20 % de disociación.
c) Como se tiene una mezcla de gases, se cumple:
Ptotal· V total = n totales · R· T](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-95-320.jpg)

![CANTABRIA / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN II / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN II
PROBLEMA 2
2. En un recipiente cerrado y vacío de 400 mL se introducen 1,280 g de bromo y 2,032 g
de yodo. Se eleva la temperatura a 150 ºC y se alcanza el equilibrio:
Br2 (g) + I2 (g) ‡ 2 BrI (g)
El valor de Kc a 150ºC es 280. Calcular:
a) El valor de Kp a 150ºC.
b) La presión total en el equilibrio.
c) Los gramos de yodo en el equilibrio.
DATOS: Masas atómicas: Br = 80; I = 127
R = 0,082 atm · L / mol · K
Solución:
a) Se escribe la expresión que relaciona Kp y Kc:
Kp = Kc · (R · T)Dn
Donde Dn = moles productos gases - moles reactivos gases
Luego par este caso:
Kp = 280 · (0,082 · 423)2 - 2
= 280
b) Se recurre al equilibrio, en el que se escriben las concentraciones iniciales ( moles / V
total), y en ele equilibrio, llamando "x" a la cantidad disociada:
moles de Br2 = 1,280 / (80 · 2) = 8 · 10-3
moles
[Br2] = 8 · 10-3
/ 0,4 = 0,02 M
moles de I2 = 2,032 / (127 · 2) = 8 · 10-3
moles
[I2] = 8 · 10-3
/ 0,4 = 0,02 M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-97-320.jpg)
![CANTABRIA / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN II / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
Br2 (g) + I2 (g) ‡ 2 BrI (g)
[ ]inicial 0,02 0,02 --
[ ]equilibrio 0,02 - x 0,02 - x 2 · x
La expresión de Kc es:
Kc = [BrI]2
/ ([Br2] · [ I2 ])
Kc = (2 · x)2
/ (0,02 - x)2
= 280
De donde se tiene:
x = 0,017 M
Para hallar la P total, se calculan los moles totales en el equilibrio, y se utiliza la ecuación de
los gases ideales:
n totales = 2 · (0,02 - 0,017) + 2 · 0,017 = 0,04 moles
P · V = n · R · T
P total = (0,04 · 0,082 · 423) / 0,4 = 3,46 atm
c) Los gramos de yodo en el equilibrio se obtienen a partir de la concentración en el equilibrio
de dicho bromo:
[I2] = 0,02 - 0,017 = 3 · 10-3
M = moles / 0,4
moles I2 = 1,2 · 103
moles
masa I2 = 1,2 · 103
· 254 = 0,3048 g](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-98-320.jpg)



![CANTABRIA / JUNIO 99. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN I / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
n HCl = Va · Ma = 0,248 · 0,05 = 0,0124 moles
Como hay un exceso de NaOH y al ser este un electrolito fuerte se cumple que:
0,015 - 0,0124 = 2,6 · 10-3
mol (en 0,1 L)
[OH-
] = n / V = (2,6 · 10-3
) / 0,1 = 2,6 · 10–2
M
pOH = -log [OH-
] = - log (2,6 · 10-2
) = 1,59
pH = 12,41
d) El HCl diluido contiene 0,248 mol/L por lo tanto en 50 mL tendrá:
n = V · M = 0,248 · 0,5 = 0,0124 moles HCl
Según la ecuación se necesitarán los mismos moles de NaOH ( 0,3 M) para su neutralización,
es decir, 0,0124 moles.
V = n / M = 0,0124 / 0,3 = 41,3 · 10-3 L = 41,3 mL](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-102-320.jpg)
![CANTABRIA / SEPTIEMBRE 00. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
OPCION I / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
I-2.- En un recipiente cerrado y vacío de 5 litros se introducen 5,08 g de yodo. Se eleva la
temperatura a 900 ºC y se alcanza el equilibrio:
I2 (g) • 2 I (g)
El valor de Kc para este equilibrio a 900ºC es de 5,2·10-4
. Calcular:
a) (0,5 puntos) El valor de Kp para el equilibrio a 900ºC.
b) (1 punto). El grado de disociación del yodo.
c) (0,5 puntos) La presión parcial del yodo sin disociar en el equilibrio.
DATOS: Masas atómicas: I = 127. R = 0,082 atm L / K mol.
Solución:
a) La relación entre Kc y Kp es la siguiente:
Kp = Kc·(RT)∆n
Sustituyendo los valores: Kc = 5,2·10-4
R = 0,082 atm·L / K·mol ∆n = 2 – 1 = 1
T = 900 + 273 = 1173 K, se obtiene:
Kp = 5,2·10-4
· ( 0,082 · 1173)1
= 5,0·10-2
b) Equilibrio de disociación: I2 (g) • 2 I (g)
inicialmente C0 --
se disocia αC0 --
se forma -- 2αC0
equilibrio C0(1-α) 2αC0
Aplicando la ley de acción de masas Kc = [I]2
/[I2] :
5,2·10-4
= (2αC0)2
/ C0(1-α) = 4 α2
C0 / (1-α)
La C0 se calcula con los datos del problema: C0 = nº moles / V(L)
nº moles = m(g) / Mm = 5,08 / 254 = 0,02 moles
C0 = 0,02 / 5 = 4·10-3
moles/L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-103-320.jpg)


![CANTABRIA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
CUESTIÓN D
www.profes.net es un servicio gratuito de Ediciones SM
D. a) [0.5 puntos ] Definir los conceptos de ácido y base según la teoría de Arrhenius.
b) [0.5 puntos] Indicar como esta formada una disolución reguladora de pH.
c) [ 1 punto ] Indicar razonadamente las disoluciones reguladoras de pH que pueden
prepararse con las siguientes disoluciones acuosas: Acido clorhídrico; ácido sulfúrico;
ácido acético (etanoico); ácido metanoico; cloruro sódico; sulfato sódico; acetato
(etanoato) sódico y metanoato sódico.
DATOS. Acido acético (etanoico): Ka = 2.10-5
. Acido metanoico: Ka = 1,7.10-4
.
Solución:
a) Según la teoría de Arrhenius, un ácido es una sustancia que en disolución acuosa es capaz
de ceder protones:
HCl τ H+
+ Cl-
Y una base, sería toda sustancia que en disolución acuosa, se disocia dando iones OH-
:
NaOH τ Na-
+ OH-
b) Una disolución reguladora o amortiguadora, está formada por un ácido débil y su base
conjugada, o bien por una base débil y su ácido conjugado; de modo que pequeñas adiciones
de ácido o base fuertes no modifican sensiblemente su pH.
c) Teniendo en cuenta los datos dados, se deduce que de los 4 ácidos, solamente dos son
débiles, los 2 que presentan constante de disociación: el acético y el metanoico. Por ello, y
dada la definición de disolución reguladora anterior, sólo estos dos ácidos, con sus
correspondientes bases conjugadas: acetato sódico y metanoato sódico, las podrán formar.
Así, se tendrían:
Acido acético / acetato sódico.
Ácido metanoico / metanoato sódico.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-106-320.jpg)
![CANTABRIA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN II / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
II-2. En un recipiente cerrado y vacío de 2 litros se introducen 2,62 g de cloruro de
nitrosilo NOCl. Se eleva la temperatura a 350º C y cuando se establece el equilibrio:
NOCl (g) NO (g) + 1/2 Cl2 (g)
La presión en el recipiente es de 1,33 atm. Calcular:
a)[1,5 puntos] El valor de Kc y Kp para este equilibrio a 350 ºC.
b) [0,5 puntos] La concentración molar de cloro en el equilibrio.
DATOS: Masas atómicas: N = 14; O = 16; Cl = 35,5.
R=0,082 atm·L/ mol·K.
Solución:
a) Se determinan, en primer lugar, los moles de NOCl contenidos en la masa que se da como
dato:
Moles NOCl = 0,04 moles
Se escribe de nuevo el equilibrio, especificando los moles de cada especie presentes, tanto
inicialmente como en ele momento del equilibrio, llamando “x” a los moles de reactivo que
han reaccionado entonces:
NOCl (g) NO (g) + 1/2 Cl2 (g)
Moles iniciales 0,04 -- --
Moles equilibrio 0,04 - x x 1/2 · x
Y se escribe la expresión de la constante de equilibrio en función de las concentraciones, Kc,
en la que se introducen las concentraciones de las tres especies presentes en el equilibrio
(moles / volumen del recipiente):
Kc = ([NO] · [Cl2]1/2
) / [NOCl]
Kc = 0,16
Y ahora, con la expresión que relaciona Kc con la constante en función de las presiones
parciales, Kp, se halla el valor de ésta:
Kp = Kc · (R · T)Dn
Siendo: Dn = (1 + 1/2) – 1
Kp = 1,17](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-107-320.jpg)
![CANTABRIA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN II / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
b) Para determinar la concentración molar de cloro en el equilibrio, se debe conocer el valor
de “x”, es decir, de los moles de NOCl que reaccionan, dando lugar tanto a cloro como a
monóxido de nitrógeno.
Para ello, y puesto que todas las especies son gases, se recurre al la ecuación de los gases
perfectos:
P · V = n · R · T
Donde “n” representa los moles totales en el equilibrio, esto es:
n = (1,33 · 2) / (0,082 · 623) = 0,052 moles
n = 0,04 – x + x + 1/2·x
Igualando ambas expresiones, se tiene:
x = 0,024 moles
Luego, los moles de cloro en el equilibrio serán:
Moles de Cl2 = 0,012 moles
Y su concentración molar, el resultado de dividir estos moles entre el volumen del recipiente:
[Cl2] = 0,012 / 2 = 6 · 10-3
M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-108-320.jpg)

![CANTABRIA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / CUESTIÓN D
www.profes.net es un servicio gratuito de Ediciones SM
CUESTIÓN D
D. a) Según la teoría de Bönsted-Lowry cuanto más fuerte es un ácido, su base
conjugada ¿será más fuerte o más débil? Explícalo.
b)En una disolución acuosa la concentración molar de iones hidrógeno se multiplica por
10. ¿Cómo varía el pH? Razónese.
Solución:
a) Según Brönsted, una especie ácida es aquella que en disolución tiende a ceder protones,
mientras que las bases tendrán tendencia a captarlos:
HA + H2O A-
+ H3O+
Ha es la especie que actúa como ácido, luego si es un ácido fuerte, será que la tendencia a
perder el protón es muy alta, es decir, el equilibrio está muy desplazado hacia la derecha;
mientras que la base, A-
, no tenderá a captar el protón, y será muy débil.
b) La expresión del pH es la siguiente:
pH = - log [H3O+
]
Una disolución es tanto más ácida cuanto mayor sea su concentración de protones, lo que da
lugar a valores de pH más bajos.
Luego si la concentración de protones se hace más grande, la disolución será más ácida, y el
pH menor.
Concretamente, para el caso pedido, si la concentración de protones se multiplica por 10, el
pH quedará reducido en una unidad; por ejemplo:
[H3O+
] = 0,01 M pH = 2
Nueva [H3O+
] = 0,01 · 10 = 0,1 M pH = 1](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-110-320.jpg)
![CANTABRIA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN II / PROBLEMA Nº 1
www.profes.net es un servicio gratuito de Ediciones SM
Opción de problemas II
II-1. En un recipiente cerrado de 0,2 litros, en el que se ha hecho el vacío, se introducen
1,28 gramos de yoduro de hidrógeno. Se eleva la temperatura a 400 ºC y se alcanza el
equilibrio:
HI (g) 1/2 I2 (g) + 1/2 H2 (g)
El valor de Kc para este equilibrio a 400ºC es 0,13. Calcular:
a) El valor de Kp para este equilibrio a 400ºC.
b) El grado de disociación del yoduro de hidrógeno.
c) Los gramos de yodo en el equilibrio.
DATOS: Masas atómicas H =1; I =127.
R= 0,082 atm · L / mol · K.
Solución:
Se conoce la masa de HI utilizada en la reacción, luego se determinan sus moles, y con ellos y
el volumen total, la concentración inicial:
Moles de HI = 1,28 / 128 = 0,01 moles
[HI] inicial = 0,01 / 0,2 = 0,05 M
El equilibrio dado es:
HI 1/2 I2 + 1/2 H2
[ ]inicial 0,05 -- --
[ ]equil. 0,05 - x 1/2 · x 1/2 · x
a) La expresión que relaciona Kc y Kp es:
Kp = Kc · (R· T)Dn
Donde Dn es la diferencia entre los moles de productos gaseosos, y los moles de los reactivos
gaseosos.
En el equilibrio dado Dn = 0, luego Kp = Kc = 0,13.
b) Se ha llamado "x" a la cantidad (en moles / L) de productos formada).](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-111-320.jpg)
![CANTABRIA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN II / PROBLEMA Nº 1
www.profes.net es un servicio gratuito de Ediciones SM
Sustituyendo en la expresión de la Kc, se determina el valor de "x":
Kc = ([I2]1/2
· [H2]1/2
) / [HI] = 0,13
De donde:
0,13 = [(1/2 · x)1/2
· (1/2· x)1/2
] / (0,05 - x)
Y así se tiene:
x = 0,0103 M
Luego en el equilibrio se tendrá:
[I2]= [H2] = 1/2 · x = 5,16 · 10-3
M
[HI] = 0,05 - x = 0,0397 M
Otra forma de expresar las concertaciones en el equilibrio es en función del grado de
disociación, a:
HI 1/2 I2 + 1/2 H2
[ ]inicial 0,05 -- --
[ ]equil. 0,05 · (1 - a) 0,05 · 1/2· a 0,05 · 1/2· a
Se toma el caso de uno de los productos, y se iguala esta expresión en función de a con la
anterior, en función de "x", de valor ya conocido, llegando a:
0,05· 1/2· a = 1/2 · x = 5,16 · 10-3
M
De donde se obtiene:
a = 0,2064 = 20,64 % de disociación.
c) Conocida la concentración de yodo en el equilibrio, y con el volumen total, se determinan
los moles de yodo en el equilibrio, y luego su masa:
[I2]equil. = 5,16 · 10-3
M
Moles de I2 en el equilibrio = 5,16 · 10-3
· 0,2 = 1,032 · 10-3
moles
Masa de I2 en el equilibrio = 1,032 · 10-3
· 127· 2 = 0,262 g](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-112-320.jpg)


![CANTABRIA / SEPTIEMBRE 02. LOGSE / QUÍMICA / ESTEQUIOMETRÍA
/ OPCIÓN II / PROBLEMA Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
[NaOH] sobra = 2,5 · 10-3
/ (0,025 + 0,010) = 0,0714 M
La disolución tendrá carácter básico.
2ª Mezcla: NaOH + HCl de la 2ª disolución:
No hay ningún reactivo en exceso, los dos reaccionan completamente, luego el resultado es
una disolución neutra, pues se forma una base procedente de ácido y base fuertes.
3ª Mezcla: NaOH + HCl de la 3ª disolución:
Reactivo en exceso = HCl
Moles de HCl sobran = 0,015 - 0,0125 = 2,5 · 10-3
[HCl] sobra = 2,5 · 10-3
/ (0,025 + 0,025) = 0,05 M
La disolución será ácida.
A continuación, aplicando las definiciones de pH y de pOH (y la relación entre ellos), según
corresponda, se determinan los valores de pH pedidos, que coincidirán con lo supuesto según
el reactivo en exceso:
pH = - log [H3O+
]
pOH = - log [OH-
]
pH + pOH = 14
Las concentraciones de H3O+
y de OH-
coinciden con las concentraciones de HCl y NaOH
sobrantes, respectivamente, pues ambas son especies fuertes, es decir, completamente
disociadas en sus iones:
1ª Mezcla:
[NaOH] sobra = [OH-
]en disolución = 0,0714 M
pOH = 1,14
pH = 12,85
Es un pH correspondiente a una disolución básica, como ya se había previsto.
2ª Mezcla: pH = 7, al haber justificado que ambos reactivos se consumen por completo.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-115-320.jpg)
![CANTABRIA / SEPTIEMBRE 02. LOGSE / QUÍMICA / ESTEQUIOMETRÍA
/ OPCIÓN II / PROBLEMA Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
3ª Mezcla:
[HCl] sobra = [H3O+
] en disolución = 0,05 M
pH = 1,3
Es, pues, una disolución ácida, tal y como se había razonado.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-116-320.jpg)
![CATALUÑA / SEPTIEMBRE 98.COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE
4 / PROBLEMA Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Se mezclan 2 cm3
de ácido clorhídrico 2 M con 5 cm3
de ácido nítrico 0,5 M en un matraz
de 250 cm3
y se enrasa con agua destilada.
a) ¿Cuáles serán las concentraciones de los iones cloruro, nitrato y protones en la
disolución resultante?
b) Mezclando la disolución anterior con 100 cm3
de una disolución de hidróxido de bario
0,25 M. Calcular el pH de la disolución final.
Solución:
a) El volumen final de la disolución es 250 cm3
= 0,250 L
Como inicialmente se tiene: 2 cm3
de HCl 2 M y 5 cm3
de HNO3 0,5 M, hay que calcular los moles
de cada uno de los ácidos inicialmente.
Moles de HCl = M · V = 2 · 0,002 = 0,004 moles
Moles de HNO3 = M · V = 0,5 · 0,005 = 0,0025 moles
Estos dos ácidos son fuertes y se disocian totalmente de modo que:
HCl + H2O → H3O+
+ Cl-
HNO3 + H2O → H3O+
+ NO3
-
Por lo tanto, en el equilibrio tendremos tantos moles de Cl-
como moles iniciales teníamos de HCl, y
tantos moles de NO3
-
como moles iniciales de HNO3. Los moles de H3O+
, serán la suma de los que
provienen de cada uno de los ácidos.
Moles de Cl-
= 0,004 moles
Moles de NO3
-
= 0,0025 moles
Moles de H3O+
= 0,004 + 0,0025 = 0,0065 moles
Sabiendo que el volumen final son 0,250 L, se calcula la concentración de cada uno de los iones
anteriores.
M = nº moles / V(L)
[Cl-
] = 0,004 / 0,250 = 0,016 mol / L
[NO3
-
] = 0,0025 / 0,250 = 0,010 mol / L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-117-320.jpg)
![CATALUÑA / SEPTIEMBRE 98.COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE
4 / PROBLEMA Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
[H3O+
] = 0,0065 / 0,250 =0,026 mol / L
b) Al mezclar la disolución anterior con 100cm3
de Ba(OH)2 0,25 M, estamos variando el volumen (
Vfinal = 0,350 L ) por lo que variaran las concentraciones calculadas en el apartado anterior.
El Ba(OH)2 es una base fuerte y se disocia totalmente:
Ba(OH)2 → Ba2+
+ 2 OH-
Moles de Ba(OH)2 = 0,25 · 0,1 = 0,025 moles
Por la estequiometria de la reacción:
Moles de Ba2+
= 0,025 moles
Moles de OH-
= 2 · 0,025 = 0,050 moles
Los iones OH-
que provienen de esta disociación reaccionan con los iones H3O+
de la disolución
ácida anterior, del siguiente modo:
OH-
+ H3O+
D 2H2O
Sabemos que la constante del equilibrio iónico de agua es Kw = 10-14
.Lo que tenemos ahora es la
reacción inversa, por lo que K = 1 / 10-14
= 1014
, que es una constante muy alta, y nos
indica que el equilibrio está totalmente desplazado a la derecha. Es decir la reacción tendrá
lugar hasta que uno de los reacctivos (el limitante) se agote.
[OH-
] = 0,050 moles / 0,350 L = 0,143 mol / L
[H3O*
] = 0,0065 moles / 0,350 L = 0,018 mol / L
Como la reacción entre ellos es 1:1, el reactivo limitante es el H3O+
, por lo tanto:
OH-
+ H3O+
→ 2 H2O
Inicialmente: 0,143 0,018
Finalmente: 0,143 – 0,018 = 0,125 -
[OH-
] = 0,125
pOH = -log [OH-
] = 0,90](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-118-320.jpg)

![CANTABRIA/ SEPTIEMBRE 98. LOGSE/ QUÍMICA/CINÉTICA Y EQUILIBRIO/
PROBLEMAS /OPCIÓN A / Nº4
www.profes.net es un servicio gratuito de Ediciones SM
4.- En un recipiente cerrado de 5 litros en el que se ha hecho el vacío, se introducen 7,1
g de cloro y 13,75 g de tricloruro de fósforo. Se calienta a 250ºC y se alcanza el
equilibrio:
Cl2(g) + PCl3(g) PCl5(g)
El valor de Kc para este equilibrio a 250ºC es 24. Calcular:
a) El valor de Kp para este equilibrio a 250ºC.
b) La presión total y la presión parcial de cada gas en el equilibrio.
Datos: Masas atómicas: P = 31; Cl = 35,5.
Solución:
Cl2(g) + PCl3(g)↔ PCl5(g)
Si Kc= 24 (mol/l)-1
Kp = Kc · (R · T)∆ n
∆n (g) = 1-2 = -1
Kp= 24 · ((250 + 273 ) · 0,082)-1
Kp = 0,5596 atm-1
b) Si se han introducido 7,1 g de cloro, los moles iniciales serán:
n0 = masa (g)/ masa molecular = 7,1/71 = 0,1 moles iniciales de Cl2
n0 = masa (g)/ masa molecular = 13,75/137,5 = 0,1 moles iniciales de PCl3
Cl2(g) + PCl3(g) ↔ PCl5(g)
n0 0,1 0,1
nre x x
neq 0,1-x 0,1-x x
Para hallar x:
Kc = [ PCl5 ]/ [ PCl3 ]·[ Cl2 ]
Kc = ( x / 5 ) / ((0,1-x)/5 ))2
= 24](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-120-320.jpg)

![CASTILLA-LA MANCHA/ JUNIO 00. LOGSE / QUÍMICA / CINETICA Y
EQUILIBRIO / OPCION A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- La fornamida se descompone en amoniaco y monóxido de carbono según el siguiente
equilibrio: HCONH2 (g) D NH3 (g) + CO(g)
En un matrazde 5litros se introducen inicialmente 2,5 moles de HCONH2(g) . Al calentar
a 130ºC se establece el equilibrio anterior , cuya constante Kc a esa temperatura vale
4,8mol/l. Calcula :
a) El grado de disociación
b) El valor de Kp a esa temperatura.
c) La presión total de la mezcla en equilibrio.
(Datos R=0,082 atm*l/k*mol)
Solución:
a) Se trata de un equlibrio homogéneo en fase gas. Se confecciona con los datos del enunciado
la siguiente tabla de concentraciones:
Co = no / V = 2,5 / 5 = 0,5 M
HCONH2 (g) D NH3 (g) + CO(g)
Co 0,5
Cr x
Ceq 0,5 – x x x
Aplicando la ley del equilibrio químico (LAM) se tiene:
Kc = [NH3] · [CO] / HCONH2
4,8 = (x · x) / (0,5-x)
x = 0,456 mol/L
El grado de disociación se obtiene a partir de la concentración reaccionante x:
x = Co · a
a = x / Co = 0,456 / 0,5 = 0,912
Por tanto el grado de disociaciónes muy elevado, del orden del 91,2 %.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-122-320.jpg)

![CASTILLA-LA MANCHA/ JUNIO 00. LOGSE / QUÍMICA / CINETICA Y
EQUILIBRIO / OPCION A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Se mezclan 250 cm3
de una disolución de hidróxido de calcio 0,1 molar con 125 cm3
ce
ácido clorhídrico 0,75 molar.
a) ¿ Cómo se llama la reacción que se produce entre ambas especies?.
b) ¿Que especie , ácido o base , queda en exceso?.
c) ¿Cuál es el pH de la disolución resultante?.
Solución:
a) Se trata de un proceso ACIDO-BASE . Ambas especies son ácido y base de Arrhenius.
En las reacciones ácido-base se forma una sal y agua como subproducto, y al proceso se le
denomina neutralización:
Ca(OH)2 + 2 HCl " CaCl2 + 2 H2O
b) Según la estequiometría por cada mol de Ca(OH)2 reaccionan 2 moles de HCl . Luego
tenemos que averiguar la cantidad en moles de cada sustancia que tenemos, para así deducir
cuál se encuentra en exceso:
Base Ca(OH)2
n = M · V = 0,1· 0,25 = 0,025 moles de Ca(OH)2
Ácido HCl
n = M · V = 0,75 · 0,125 = 0,093 moles de HCl
Según la estequiometría la proporción reaccionante es:
HCl / Ca(OH)2 = 2 / 1
Si suponemos que reacciona todo el hidróxido de calcio, necesitaríamos de clorhidrico:
2 / 1 = x / 0,025
x = 0,05 moles
Luego el HClse encuentra en exceso.
Exceso HCl = 0,093 - 0,05 = 0,043 moles
c) Para expresar la acidez o basicidad de una disolución se emplea el concepto de pH:
pH = - log [H3O+
]
En medio acuoso tanto el ácido como la base, al ser fuertes, estan totalmente disociados.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-124-320.jpg)
![CASTILLA-LA MANCHA/ JUNIO 00. LOGSE / QUÍMICA / CINETICA Y
EQUILIBRIO / OPCION A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
Ca(OH)2 " Ca2+
+ 2 OH-
HCl + H2O " Cl-
+ H3O+
De manera que según la estequiometría inicialpor cada mol de hidróxido calcico se disocian2
moles de iones OH-
. Por otra parte, esta cantidad se necesita neutralizar con 2 moles de ácido
clorhidrico, que a su vez proporcionan 2 moles de iones H3O+
.
2 H3O+
+ 2 OH-
D 4 H2O
De modo que con los 0,025 moles de Ca(OH)2 se consumen en la neutralización 0,05 moles
de HCl. Luego el pH estará determinado por los iones hidronio en exceso que proporciona el
clorhídrico.
n H3O+
= 0,043 moles
La concentración de estos iones será:
[H3O+
] = n / Vtotal = 0,043 / 0,375 = 0,114 mol/L
pH = - log (0,114)
pH = 0,94](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-125-320.jpg)
![CASTILLA LA MANCHA/ JUNIO 00 . COU / QUIMICA/ CINETICA Y EQUILIBRIO/
OPCIÓN A / EJERCICIO 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- El ácido acético en una disolución 0,2 M está disociado en un 1,25.Calcular:
a) El pH de esta disolución (1 punto)
b) La constante de disolución del ácido acético (1 punto)
c) ¿Qué concentración tiene que tener el ácido acético para que se disocie en un 2,5%?.
Solución:
El ácido acético CH3-COOH (AcH) tiene una concentración 0,2 M y está disociado en un
grado de 1,25 %, lo que da el siguiente equilibrio:
Disociación del ácido acético AcH <====> Ac-
+ H+
Concentración inicial 0,2 __ __
se disocia 0,2 · 0,0125 __ __
se forma __ 0,2 · 0,0125 0,2 · 0,0125
equilibrio 0,2 · ( 1 – 0,0125) 0,2 · 0,0125 0,2 · 0,0125
a) Por lo tanto en el equilibrio el pH será:
Sabiendo que pH = -log [H+
] y como en el equilibrio conocemos esta concentración se tiene:
[H+
] = 0,2 · 0,0125 = 0,0025 mol/L
pH = - log 0,0025 = 2,6
b) La constante de disociación del ácido se halla aplicando la Ley de Acción de Masas, así
tenemos la siguiente expresión:
Ka =
[ ][ ]
[ ]AcH
HAc +−
·
Sustituyendo las concentraciones en el equilibrio en dicha expresión se obtiene:
Ka =
( )( )
( )1975,0
10·5,2·10·5,2 33 −−
= 3,16 · 10-5
c) Si queremos que el ácido se disocie un 2,5 %, conociendo ya el valor de su Ka, la
concentración se calcula a partir de la ecuación de dicha constante de disociación:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-126-320.jpg)
![CASTILLA LA MANCHA/ JUNIO 00 . COU / QUIMICA/ CINETICA Y EQUILIBRIO/
OPCIÓN A / EJERCICIO 1
www.profes.net es un servicio gratuito de Ediciones SM
Ka =
[ ][ ]
[ ]AcH
HAc +−
·
Situación del nuevo equilibrio:
Disociación del ácido acético AcH <====> Ac-
+ H+
Concentración inicial Co __ __
se disocia Co · 0,025 __ __
se forma __ Co · 0,025 Co · 0,025
equilibrio Co · ( 1 – 0,025) Co · 0,025 Co · 0,025
3,16 · 10-5
=
( )( )
)025,01·(
025,0··025,0·
−Co
CoCo
=
Co
Co
·975,0
·000625,0 2
= 6,41 ·10-4
· Co
De donde despejando Co, se obtiene una concentración inicial de ácido:
Co = 0,049 mol/L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-127-320.jpg)
![CASTILLA LA MANCHA/ JUNIO 00 .COU / QUIMICA / CINÉTICA Y EQUILIBRIO
/ OPCIÓN A / EJERCICIO 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- La solubilidad del fluoruro de bario en agua pura es 3,5 gramos/litro. Calcular:
a) El producto de solubilidad del fluoruro de bario.
b) La solubilidad del fluoruro de bario, expresada en g/L, en una disolución 1,0 M de
cloruro de bario.
Datos: masas atómicas: F = 19, Ba = 137,3
Solución:
a) Producto de solubilidad.
El fluoruro de bario es una sal BaF2, cuyo equilibrio de disociación será:
BaF2↓ • Ba2+
+ 2 F-
Equilibrio de solubilidad S S 2S
Al aplicar la Ley de Acción de Masas a este equilibrio heterogéneo:
Ks = [Ba2+
] · [F-
]2
= S · (2S)2
= 4 · S3
Sabemos que la solubilidad es 3,5 gramos / Litro, pasando este valor a moles / litro, y
sustituyendo en la expresión anterior se obtienen el valor del producto de solubilidad.
m = n · Mm
Nº de moles = m / Mm = 3,5 / (137,3 + 2· 19) = 0,0199 moles (en 1 L)
S = 0,019 mol/L
Ks = 4 · (0,0199)3
= 3,18 · 10-5
b) Solubilidad en una disoluciónde cloruro de bario.
Equilibrio de solubilidad de BaF2: BaF2↓ • Ba2+
+ 2 F-
Equilibrio de disociación del BaCl: BaCl2↓ → Ba2+
+ 2 Cl-
La concentración del cloruro de bario es 1,0 M, suponemos que esta sal soluble se disocia
completamente, por lo que en el equilibrio la concentraciones de los iones Cl-
y Ba2+
son:
[Cl-
] = 2 · 1,0 = 2,0 M
[Ba2+
] = 1,0 M
Entonces el equilibrio de solubilidad del BaF2, se ve influenciado por la concentración (extra)
de iones Ba2+
que provienen del BaCl2, es lo que se llama efecto ión-común. El producto de
solubilidad no cambia, por lo que al aumentar la concentración de iones bario, forzosamente](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-128-320.jpg)
![CASTILLA LA MANCHA/ JUNIO 00 .COU / QUIMICA / CINÉTICA Y EQUILIBRIO
/ OPCIÓN A / EJERCICIO 3
www.profes.net es un servicio gratuito de Ediciones SM
tiene que disminuir la concentración de iones fluoruro en el equilibrio, es decir la solubilidad
de la sal BaF2 disminuye.
BaF2↓ • Ba2+
+ 2 F-
Equilibrio de solubilidad S´ S´+1 2S´
Ks = 3,18·10-5
= [Ba2+
]·[F-
]2
= ( S´+1) · (2S´)2
S´+1 ≅ 1
S´ = 2,82·10-3
mol/L
nº de moles = m / Mm
m = 2,82·10-3
· 175,3 = 0,49 g (en 1 L)
S = 0,49 g/L
Como es lógico la solubilidad disminuye por efecto del ióncomún.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-129-320.jpg)
![CASTILLA LA MANCHA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- (3 puntos) En un matraz de 2 litros se introducen 2 moles de N2 y 6 moles de H2,
calentándose la mezcla hasta 327ºC. A esta temperatura se establece el equilibrio:
N2 (g) + 3 H2 (g) ‡ 2 NH3 (g)
Si la reacción tiene lugar en un 60%, calcula:
a) La concentración de cada especie en el equilibrio.
b) Las constantes Kc y Kp para ese equilibrio.
c) ¿Cómo le afecta al equilibrio un aumento de la presión? Justifica la
respuesta.(Datos: R= 0,082 atm·l / K·mol)
Solución:
Se escribe el equilibrio, especificando los moles iniciales y en el equilibrio, y a continuación,
dividiendo entre el volumen total, las concentraciones en el momento inicial y en el
equilibrio.
Se llama a al grado de disociación, es decir el porcentaje, expresado en tanto por uno, en que
transcurre la reacción:
N2 (g) + 3 H2 (g) ‡ 2 NH3 (g)
Moles iniciales 2 6 --
Moles equilibrio 2 · (1– a) 3 – 3· a 2 · a
[ ]inicial 1 3 --
[ ]equilibrio 1 - a 3 – 3 · a 2 ·a
Como se tiene como dato del problema:
a = 0,6 ( 60 %)
a) Sustituyendo y operando, se tienen las concentraciones de las tres especies en el equilibrio:
[N2] = 1 – 0,6 = 0,4 M
[H2] = 3 – 3·0,6 = 1,2 M
[NH3] = 2· 0,6 = 1,2 M
b) La expresión de Kc para el equilibrio dado es la siguiente:
Kc = [NH3]2
/ ([N2] · [H2]3
)](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-130-320.jpg)


![CASTILLA LA MANCHA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- El ácido fórmico (cuyo nombre sistemático es ácido metanoico) es un ácido débil cuya
constante de acidez vale 1,84 10-4
. Se tienen 500 mL de una disolución acuosa de ácido
fórmico en la cual éste se encuentra disociado en un 34%. Calcula:
a) La concentración inicial del ácido fórmico en la disolución.
b) Los moles de las especies HCOOH, HCOO-
y H3O+
en el equilibrio.
c) El pH de dicha disolución.
Solución:
a) Se escribe el equilibrio de disociación del ácido, llamando al grado de disociación,
expresado entanto por uno, a y Ci a la concentración inicial:
HCOOH + H2O HCOO-
+ H3O+
[ ]inicial Ci -- --
[ ]equilibrio Ci · (1 - a) Ci · a Ci · a
La expresión de la constante de acidez es:
Ka = ([HCOO-
]· [H3O+
]) / [HCOOH]
Se sustituyen los datos conocidos, y se halla la concentración inicial de ácido:
1,84 10-4
= (Ci2
· 0,342
) / (Ci · 0,66)
De donde:
Ci = 1,05 · 10-3
M
b) Con Ci, se pueden conocer todas las concentraciones en el equilibrio:
[HCOOH]equilibrio = 6,93 · 10-4
M
[HCOO-
] = [H3O+
] equilibrio = 3,57 · 10-4
M
Y como se conoce el volumen de la disolución, y se sabe la relación entre molaridad y
volumen, se hallan éstos:
M = moles soluto / V (L) disolución
V disolución = 500 mL = 0,5 L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-133-320.jpg)
![CASTILLA LA MANCHA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
Moles HCOOH equilibrio = 3,46 · 10-4
moles
Moles HCOO-
= moles H3O+
equilibrio = 1,78 · 10-4
moles
c) La definición de pH es:
pH = -log [H3O+
]
Luego en este caso:
pH = 3,44
Como era de esperar, es un valor menor que 7, que indica que la disolución es ácida.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-134-320.jpg)


![CASTILLA LA MANCHA / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN Nº 1
www.profes.net es un servicio gratuito de Ediciones SM
Moles ác. sulfúrico = 250 / 98 = 2,55 moles
Luego la molaridad será:
M = 2,55 / 125 = 0,02 M
Y la normalidad, el doble, al ser un ácido diprótico:
Na = 0,04 N
Ya se puede sustituir y averiguar el volumen de base:
(N · V)a = (N · V)b
0,04 · 125 = 2,5 · Vb
Luego:
Vb = 2,04 L
b) Se determinan los moles contenidos en los 50 mL (0,05 L) de base 2,5 M añadida en
exceso:
M = moles / V (L)
moles exceso de NaOH = 2,5 · 0,05 = 0,125 moles
Ahora, se halla la concentración que, en el volumen total (125 + 0,05 L), suponen esos moles
en exceso de base:
[OH-
]exceso = 0,125 / 125,05 = 9,99 · 10-4
M
Por definición:
pOH = - log [OH-
] = 3
Y como:
pOH + pH = 14
pH = 14 - 3 = 11
El resultado es una disolución con carácter básico.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-137-320.jpg)

![CASTILLA LA MANCHA / JUNIO 99. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
/ OPCIÓN A / CUESTIÓN nº5
www.profes.net es un servicio gratuito de Ediciones SM
5.- ¿En qué sentido se desplazará el siguiente equilibrio al aumentar la temperatura? ¿Y al
disminuir la presión?.
2 NO(g) + O2(g) " 2 NO2(g) DHº = -28,1 Kcal/mol
Solución:
Al aumentar la temperatura, el equilibrio se desplazará hacia la izquierda ya que es un proceso
exotérmico (se desprende calor). Ya que según el principio de Le Chatelier, al modificar las
condiciones en las que se encuentra un sistema, éste reaccionará en el sentido inverso al de la causa
que ha producido dicha variación.
Si disminuimos la presión, el equilibrio se desplaza hacia la izquierda ya que [AM]Dn = -1, es decir
hacia el miembro donde el volumen y, por tanto, el número de moles es mayor.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-139-320.jpg)
![CASTILLA LA MANCHA / JUNIO 99. COU / QUIMICA / CINETICA Y EQUILIBRIO
/OPCION A / Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- (3 puntos) Se ha estudiado el siguiente equilibrio 2 NOCl (g) D 2 NO (g) + Cl2 (g) a
735ºC y un volumen constante de un litro. Inicialmente en el recipiente se introdujeron dos
moles de NOCl y una vez alcanzado el equilibrio se comprobó que se había disociado en un
33%. Calcule:
a) El valor de Kc
b) Las presiones parciales de cada gas en el equilibrio y la presión total.
c) ¿Hacia qué lado se desplazará el equilibrio si aumentamos el volumen al doble?
Datos: R = 0,082 atm·L/K·mol
Solución:
a) Equilibrio 2 NOCl (g) D 2 NO (g) + Cl2 (g)
Inicialmente: (nº moles) 2 - -
Se disocian: 2α - -
Se forman: - 2α α
Equilibrio: 2-2α 2α α
Aplicando la ley de acción de masas al equilibrio:
Kc = [NO]2
·[Cl2] / [NOCl]2
Kc = (2α /V)2
· (α/V) / (2-2α/V)2
teniendo en cuenta que V = 1L
Kc = 4α2
· α / 4(1-α)2
= α3
/ (1-α)2
Como en el equilibrio se ha disociado un 33%, α = 0,33
Kc = (0,33)3
/ ( 1- 0,33)2
= 0,080
b) La presión parcial obedece a la ley de Dalton Px = PT · X, donde X es la fracción molar.
X = moles de soluto / moles totales.
Para calcular el nº total de moles, sumamos todos los moles que hay en el equilibrio:
2(1-α) + 2α + α = 2 + α = 2 + 0,33 = 2,33 moles
Para calcular la presión total, recurrimos a la ecuación de los gases ideales:
PT · V = nT · R · T
PT = nT · R · T / V PT = 2,33 · 0,082 · 1008 / 1 = 193 atm
De tal manera que la composición del equilibrio es:
PNOCl = PT · XNOCl = 193 · ( 2-2α / 2+α ); PNOCl = 193 ( 1,34 / 2,33 ) = 110,1 atm.
PNO = PT · XNO = 193 · ( 2α / 2+α ) = 54,6 atm.
PCl = PT · XCl = 193 · ( α / 2 + α ) = 27,3 atm](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-140-320.jpg)

![CASTILLA-LA MANCHA / JUNIO 00. LOGSE / QUÍMICA / CINETICA Y
EQUILIBRIO / OPCION A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Disponemos de una disolución de ácido etanoico (acético) en agua, en la que el ácido
está ionizado en un 5%. Sabiendo que su constante de acidez Ka vale 1,8*10-5
, calcula:
a) La concentración de todas las especies en equilibrio.
b)El pH de la disolución obtenida al diluirla inicial al doble de su volumen.
Solución:
a) En primer lugar escribimos la tabla de equilibrio en la cual se muestran las concentraciones
inicial, reaccionante y de equilibrio de cada uno de los componentes de la disolución acuosa:
CH3-COOH + H2O D CH3-COO-
+ H3O+
Cinic Co
CR C0 a
Ceq C0 (1-a) C0 a C0 a
(a indica el grado de disociación)
Aplicando la expresión de la constante de equilibrio se tiene:
Ka= [CH3-COO-
] · [H3O+
] / [CH3-COOH]
Ka= (C0 a)2
/ C0 (1-a)
1,8*10-5
= C0 a2
/ (1-a)
Sustituyendo a = 0,05, aproximando 1-a ϕ 1, y despejando C0 se llega a:
C0 = 7,2· 10-3
M
La concentración en equilibrio de cada uno de los componentes por lo tanto será
[CH3-COOH] = C0 (1-a) = 7,2·10-3
(1-0,05) = 6,84·10-3
M
[CH3-COO-
] = [H3O+
] = C0 a = 7,2·10-3
· 0,05 = 3,6·10-4
M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-142-320.jpg)
![CASTILLA-LA MANCHA / JUNIO 00. LOGSE / QUÍMICA / CINETICA Y
EQUILIBRIO / OPCION A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
b) Al diluir a doble volumen la concentración inicial ésta se reduce a la mitad. Luego ahora
C0´ = 3,6 ·10-3
M. Y se plantea un nuevo estado de equilibrio.
CH3-COOH + H2O D CH3-COO-
+ H3O+
Cinic C0´
CR C0´ a
Ceq C0´ (1-a) C0´ a C0´ a
La constante de equilibrio no varía:
1,8*10-5
= 3,6·10-3
a2
/ (1-a)
Despejando a y aproximando 1-a ϕ 1 se llega a:
a = 0,070 = 7 %
Luego al diluir aumenta el grado de disociación.
[H3O+
] = 3,6·10-3
· 0,07 = 2,52·10-4
M
pH = -log [H3O+
] = -log (2,52·10-4
) = 3,59](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-143-320.jpg)
![CASTILLA LA MANCHA / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / EJERCICIO 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Calcular la constante de hidrólisis, el pH y el grado de disociación de una disolución
0,1 M de NaCN. Constante del HCN = 4,93·10-10
.
Solución:
El cianuro sódico es una sal soluble que en medio acuoso está totalmente disociada.
NaCN (ac) " Na+
(ac) + CN-
(ac)
El ión CN-
es la base conjugada de un ácido débil y puede reaccionar con el agua, mediante el
siguiente equilibrio de hidrólisis básica:
CN-
(ac) + H2O D HCN + OH-
Co 0,1
Cr x
Ceq. 0,1-x x x
La constante de este equilibrio se deduce a partir del valor de Ka del HCN y del producto
iónico del agua.
Kh = Kb = Kw / Ka
Kh = 10-14
/ 4,93·10-10
Kh = 2,02 ·10-5
La ley de este equilibrio sería:
[HCN] · [OH-
]
Kh =
[HCN]
Aplicando los datos de la tabla a la constante de equilibrio:
2,02 ·10-5
= x2
/ (0,1 – x)
x = 1,41·10-3
mol/L
pOH = - log[OH-
] = - log (1,41·10-3
) = 2,85
pH = 14 – pOH = 14- 2,85 = 11,14](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-144-320.jpg)

![CASTILLA LA MANCHA / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / EJERCICIO 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Como afecta la presencia de un catalizador a:
a) DH b) La energía de activación
c) La constante de equilibrio d) La velocidad de reacción
Solución:
El catalizador es una sustancia química que en pequeñas cantidades puede modificar la
velocidad de reacción. Generalmente el catalizador no se consume, luego no es un reactivo
del proceso, y además se regenera en alguna de las etapas del mecanismo de reacción.
a) No afecta.
DH es la variación de entalpía de la reaación, o calor de reacción a P constante. Esta es una
magnitud termodinámica que indica la diferencia entre el estado energético de reactivos y
prductos, pero que nada tiene que ver con el catalizador del proceso.
b) Siafecta.
La Energía de activación (Ea) es la barrera energética que las moléculas de los reactivos
tienen que superar para realizar choques eficaces entre ellas. Dicho de otro modo, la energía
de activaciónes la diferencia energética entre el estado intermedio del complejo activado y el
estado de los reactivos.
Los catalizadores modifican la Ea de la reacción, ya que alteran el mecanismo de esta. Se
calsificanen promotores (sir rebajan Ea) e inhibidores (si aumentan Ea).
c) No afecta.
Las constantes de equilibrio Kc o Kp sólo dependen de la temperatura. Los catalizadores no
modifican el estado de equilibrio, solamente permiten que éste se alcance antes, ya que
afectan por igual al proceso directo y al inverso.
d) Siafecta.
La velocidad de reacción depende de la constante de velocidad de reacción y esta a su vez
depende de la Ea, según indica la ecuación de Arrehnius:
vr = K · [Reactivos]n
K = A · e – Ea / (RT)
Los catalizadores afectan, por tanto, a la velocidad del proceso. Los promotores aceleran la
reaccióny los inhibidores la retardan.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-146-320.jpg)
![CASTILLA LA MANCHA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- (3 puntos) Se tiene una disolución de amoniaco 0,01 N cuyo pH es 10,63. Calcula: a)
la concentración de OH-
en equilibrio; b) el grado de disociación del amoniaco; c) el
valor de la constante de basicidad del amoniaco, Kb.
Solución:
La disolución de amoníaco es el hidróxido de amonio: NH4OH, base débil, parcialmente
disociada en sus iones.
a) Se sabe que su normalidad es 0,01 N, y al ser una base con un único grupo OH-
, la
molaridad será el mismo valor: 0,01 M.
Se conoce también el pH de la disolución, con el que se puede determinar el pOH:
pH + pOH = 14
pOH = 3,37
Y por la definición de pOH, se tiene ya la concentración de grupos OH-
en el equilibrio:
pOH = - log [OH-
]
[OH-
] = 10 -3,37
= 4,26·10-4
M
b) El grado de disociación es el porcentaje, en tanto por uno, que está disociada la base, se
expresa como a.
Se escribe el equilibrio de disociación, con la concentración inicial de base y las
concentraciones de todas las especies en el equilibrio en función de a:
NH4OH ‡ NH4
+
+ OH-
[ ]inicial 0,01 -- --
[ ]equilibrio 0,01·(1 - a) 0,01·a 0,01·a
Como se conoce, por el valor de pOH calculado, la concentración de iones OH-
En el
equilibrio, se tiene:
0,01·a = 4,26·10-4
De donde:
a = 0,0426 (4,26 %)](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-147-320.jpg)
![CASTILLA LA MANCHA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
c) La expresión de la Kb será:
Kb = ([NH4
+
] · [OH-
]) / [NH4OH]
Y sustituyendo por los valores de las concentraciones, que ya son conocidos, se llega a:
Kb = 1,89·10-5](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-148-320.jpg)
![CASTILLA LA MANCHA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- (3 puntos) Para el equilibrio de disociación N2O4 (g) ‡ 2 NO2 (g), a 27ºC y 2 atm, la
constante de equilibrio Kp vale 0,17. Calcula: a) el grado de disociación del N2O4 en estas
condiciones; b) las presiones parciales de los dos compuestos en el equilibrio; c) el valor
de Kc a esa temperatura.
(Datos: R= 0,082 atm.l/K.mol)
Solución:
a) y b) Se escribe el equilibrio, expresando los moles iniciales como ni, y la cantidad de
reactivo disociada en tanto por uno (grado de disociación) como a:
N2O4 (g) ‡ 2 NO2 (g)
Moles iniciales ni --
Moles equilibrio ni·(1 – a) 2·ni·a
Luego los moles totales en el equilibrio serán:
Moles totales = ni·(1 – a) + 2·ni·a = ni·(1 + a)
Recordando las expresiones de las fracciones molares y de las presiones parciales se tiene:
x NO2 = moles NO2 / moles totales = 2· a·ni / ni·(1 + a) = 2· a / (1 + a)
P NO2 = P total · x NO2 = 2 · [2· a / (1 + a)] = 4· a / (1 + a)
x N2O4 = moles N2O4 / moles totales = ni· (1 - a) / ni·(1 + a) = (1 - a) / (1 + a)
P N2O4 = P total · x N2O4 = 2 · (1 - a) / (1 + a)
Y sustituyendo estas presiones parciales en la expresión de Kp, e igualando al valor dado
como dato, se tiene el valor de a:
Kp = (P NO2)2
/ P N2O4
Kp = 8· a2
/ (1 - a2
) = 0,17
De donde:
a = 0,14 (14 %)
Sustituyendo el valor de a en las presiones parciales:
P NO2 = 4· 0,14 / (1 + 0,14) = 0,49 atm](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-149-320.jpg)

![CASTILLA LA MANCHA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN Nº 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Una disolución con una concentración inicial 1 molar de ácido acético (etanoico) tiene
una concentración en equilibrio de ion hidronio, H3O+
, 4,2·10-3
molar. Calcula:
a) La constante de acidez Ka.
b) La concentración inicial de ácido necesaria para que el grado de disociación tenga un
valor del 10 %.
c) El pH de la disolución en este último caso.
Solución:
a) Se escribe el equilibrio de disociación del ácido, llamando al grado de disociación,
expresado en tanto por uno, a y "x" a la concentración disociada:
CH3COOH + H2O CH3COO-
+ H3O+
[ ]inicial 1 -- --
[ ]equilibrio 1 - x x x
x = 4,2·10-3
M
La expresión de la constante de acidez es:
Ka = ([CH3COO-
] · [H3O+
]) / [CH3COOH]
Se sustituyen los datos conocidos, y se halla la constante de disociación del ácido:
Ka = x2
/ (1 - x) = (4,2·10-3
)2
/ (1 - 4,2·10-3
)
Ka = 1,77 · 10-5
b) Otra forma de expresar las concentraciones en el equilibrio es en función del grado de
disociación, a:
a = 10 % = 0,10
CH3COOH + H2O CH3COO-
+ H3O+
[ ]equilibrio Ci· (1 - a) Ci · a Ci· a
Así, con el valor de a dado y la Ka, constante si la temperatura no varía, se tiene:
Ka = (Ci · a)2
/ Ci· (1 - a)
1,77 · 10-5
= Ci2
· 0,102
/ Ci · (1 - 0,10)](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-151-320.jpg)
![CASTILLA LA MANCHA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN Nº 1
www.profes.net es un servicio gratuito de Ediciones SM
Ci = 1,6 · 10-3
M
c) La definición de pH es:
pH = -log [H3O+
]
Luego en este caso:
pH = 3,8
Como era de esperar, es un valor menor que 7, que indica que la disolución es ácida.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-152-320.jpg)
![CASTILLA LA MANCHA / SEPTIEMBRE 99.COU / QUIMICA / CINETICA Y
EQUILIBRIO / OPCION A / Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.-(3 puntos ) Un recipiente de 5 litros se llena con 261 g de pentacloruro de fosforo a 300
ºC y se cierra. Cuando se alcanza el equilibrio la presión total es de 16,45 atmósferas.
Calcular
A) el grado de disociación del PCl5(g) • PCl3(g) + Cl2(g)
B) el valor de la constante Kc para este equilibrio
C) el valor de la constante Kp para este equilibrio
Datos: R=0,082 atm l/mol K. Masas atómicas P = 31; Cl = 35,5
Solución:
A) Equilibrio: PCl5 (g) • PCl3 (g) + Cl2 (g)
Calculamos los moles iniciales de pentacloruro de fosforo: n0 = m(g) / Pm
n0 (PCl5) = 261 / 208,5 = 1,25 moles
PCl5 (g) • PCl3 + Cl2
Inicialmente: (moles) 1,25 _ _
Se disocian: 1,25α _ _
Se forman: _ 1,25α 1,25α
Equilibrio: 1,25 ( 1 -α) 1,25α 1,25α
nT = 1,25 ( 1 - α ) + 1,25α + 1,25α = 1,25 (1+ α)
Dado que es un equilibrio homogéneo gaseoso, calculamos el nº de moles totales mediante la
ecuación de los gases ideales:
P·V = n·R·T
16,45 · 5 = nT · 0,082 · 573
nT = 1,75 moles totales que hay en el equilibrio.
1,25 (1 + α) = 1,75
α = 0,50 / 1,25 = 0,4 (El grado de disociación es del 40%)
B) Aplicando la ley de acción de masas al equilibrio:
Kc = [Cl2]·[PCl3] / [PCl5]
Kc = (1,25·0,4 / 5)2
/ (1,25·0,6 / 5) = 6,6·10-2
C) Para calcular Kp se aplica la ecuación que relaciona Kc y Kp
Kp = Kc·(RT)∆n
Kp = 6,6·10-2
· (0,082 · 573) = 3,1](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-153-320.jpg)



![CASTILLA LA MANCHA / JUNIO 98. COU/ CINÉTICA Y EQUILIBRIO / OPCIÓN A
/Nº3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Calcular los gramos de NH4Cl que se debe añadir a 100 ml de disolución de NH3 0,1M
para obtener una disolución de pH 9,5. Suponer que no hay variación de volumen. Dato:
Kb NH3 = 1,8·10-5
. Masas atómicas: N = 14 ; H = 1 ; Cl = 35,5.
Solución 3:
Sabemos que el pH es 9,5, por lo que el pOH será 14 − pH = 4,5
[OH−] = 10 –4,5
= 3,2 · 10-5
M
Planteamos la ecuación:
NH3 + H2O ↔ NH4+
+ OH-
Ceq 0,1 x 3,2.10−
5
Sustituyendo los valores en la expresión de la constante de basicidad , Kb se tiene:
Kb = [NH4] · [OH-
] / [NH3]
1,8. 10-5
= [NH4
+
] · 3,2.10-5
/ 0,1 [NH4
+
] = 5,4 · 10-2
M
M = n / V ; n = M · V = 5,4 · 10-2
· 0,1 = 5,4 · 10-3
moles
m = (5,4 · 10-3
) · 53,5 = 0,29 g de NH4Cl](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-157-320.jpg)



![CASTILLA Y LEÓN / JUNIO 00. LOGSE / QUÍMICA / CINETICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Calcule el pH de cada una de las siguientes disoluciones:
a) Anilina (C6H5NH2) 0,2 M.
b) Disolución de 0,30 g de hidróxido sódico en 135 ml de agua (considérese despreciable
el volumen de soluto).
Datos: Constante de ionización básica de la anilina a 25ºC, Kb = 4,27·10-10
Solución:
a) Cuando una amina se disuelve en agua, se establece el siguiente equilibrio:
C6H5NH2 + H2O D C6H5NH3
+
+ OH-
[ ]inicial 0,2 -- --
[ ] equil 0,2 – x x x
Este equilibrio viene definido por una constante, que será la de ionización básica de la
anilina:
Kb = 4,27·10-10
= x2
/ (0,2 – x)
De donde obtenemos: x = 9,7·10-6
M = [OH-
]
Por tanto: pOH = -log [OH-
] = 5
A partir de la relación pH + pOH = 14, se obtiene:
pH = 14 – 5 = 9
b) Se conoce la masa de soluto (NaOH) y el volumen de disolución en litros (que es el de
disolvente, puesto que se desprecia el volumen de soluto); con ambos datos y la masa
molecular del soluto, se puede calcular la molaridad:
M = (masa soluto / M molec) / V disoluc.
M = (0,30 / 40) / 0,135 = 0,055 M
El hidróxido de sodio es una base fuerte, que estará totalmente disociada, luego su
concentración inicial (0,055 M), será la concentración final de iones oxhidrilo:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-161-320.jpg)
![CASTILLA Y LEÓN / JUNIO 00. LOGSE / QUÍMICA / CINETICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
NaOH " Na+
+ OH-
[ ]inicial 0,055 -- --
[ ]final -- 0,055 0,055
pOH = -log [OH-
] = 1,26
pH = 14 – pOH = 14 - 1,26
pH = 12,74](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-162-320.jpg)



![CASTILLA LEÓN / JUNIO 02. LOGS E / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Calcular el grado de disociación y la molaridad de una disolución de ácido acético en
agua cuya concentración de protones es1,34· 10-3
M y la constante de disociación ácida
Ka = 1,8 · 10-5
.
Solución:
Es un ácido débil, disociado parcialmente, luego el equilibrio de disociación del ácido
quedaría:
HAc + H2O H3O+
+ Ac-
[ ]inicial Ci -- --
[ ]equilibrio Ci - x x x
x = 1,34 · 10-3
M
La expresión de Ka es:
Ka = ([H3O+
]· [Ac-
]) / [HAc]
Y sustituyendo:
Ci = 0,1 M
La relación entre el grado de disociación (a) y la Ci es:
x = Ci · a
De donde se obtiene:
a = 0,0134 = 1,34 %](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-166-320.jpg)








![CASTILLA Y LEÓN / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
Kp = [ (P total ·
X (H2)) · (P total · X (eteno)) ] / (P total · X (etano))
Kp = P total · [a / (1 + a)]2
/ [(1 - a ) / (1 + a )]
Y simplificando y sustituyendo Kp y la P total por sus valores, se llega a:
0,051 = 0,75 · a2
/ (1 - a2
)
De donde:
a = 0,252 = 25,2%](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-175-320.jpg)
![CASTILLA LEÓN / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Calcular el grado de disociación y la molaridad de una disolución de ácido acético en
agua cuya concentración de protones es1,34· 10-3
M y la constante de disociación ácida
Ka = 1,8 · 10-5
.
SOLUCIÓN
Es un ácido débil, disociado parcialmente, luego el equilibrio de disociación del ácido
quedaría:
HAc + H2O H3O+
+ Ac-
[ ]inicial Ci -- --
[ ]equilibrio Ci - x x x
x = 1,34 · 10-3
M
La expresión de Ka es:
Ka = ([H3O+
]· [Ac-
]) / [HAc]
Y sustituyendo:
Ka = (1,34 · 10-3
)2
/ (Ci - 1,34· 10-3
) = 1,8 · 10-5
De donde se tiene:
Ci = 0,1 M
La relación entre el grado de disociación (a) y la Ci es:
x = Ci · a
De donde se obtiene:
1,34· 10-3
= 0,1 · a
Y el valor del grado de disociación pedido es:
a = 0,0134 = 1,34 %](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-176-320.jpg)
![CASTILLA LEÓN / SEPTIEMBRE 03. LOGSE/ QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
2.- El COCl2 gaseoso se disocia a 1000 K según la reacción:
COC12 (g) ‡ CO (g) + Cl2 (g)
a) Calcule Kp cuando la presión de equilibrio es 1 atm y el porcentaje de disociación es
del 49,2 %.
b) Si la energía libre estándar (a 25 °C y 1 atm) del equilibrio de disociación es DGº = +
73,1 KJ, calcule las constantes Kc y Kp para el equilibrio anterior a 25 °C.
Solución:
a) Se escribe el equilibrio, llamando a los moles iniciales "ni" y expresando las cantidades
iniciales y del equilibrio en función del grado de disociación (0,492):
COCl2 ‡ CO + Cl2
Moles iniciales ni -- --
Moles equilibrio ni · (1 - 0,492) ni · 0,492 ni · 0,492
Se determinan los moles totales en el momento del equilibrio:
Moles totales = ni · (1 - 0,492) + ni · 0,492 + ni · 0,492 = 1,492 · ni
Y con ellos y el valor de presión total dado, se hallan las presiones parciales, ya que:
Pi = P total · xi
Siendo : xi = ni / n totales
Por lo que se tiene:
P COCl2 = 1 · [ni · (1 - 0,492)] / ni · 1,492 = 0,34 atm
P CO = P Cl2 = 1 · [ni · 0,492 / ni · 1,492] = 0,329 atm
Y ahora, se sustituye en la expresión de Kp, hallando su valor:
Kp = (P CO · P Cl2) / P COCl2 = 0,3292
/ 0,34 = 0,318
b) La expresión que relaciona la Kp con la energía libre de Gibbs (DGº) es:
DGº = - R · T · Ln Kp
Sustituyendo los valores conocidos, se despeja y halla la Kp pedida:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-177-320.jpg)

![CASTILLA LEÓN / SEPTIEMBRE 98. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO
/ OPCIÓN A / Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- Para la siguiente reacción: N2(g) + 3 H2(g) ⇔ 2 NH3(g)
la constante de equilibrio a una temperatura determinada vale 0,50, siendo el volumen
del recipiente donde se realiza el proceso de 2 litros. Indicar razonadamente si son
ciertas o falsas cada una de las siguientes afirmaciones:
a) Cuando los moles iniciales de cada componente son: NH3 =1,00; H2 = 0,50, N2 = 0,00;
la reacción transcurrirá hacia la derecha.
b) Cuando se parte de una mezcla que contiene 0,50 moles de todos y cada uno de los
componentes que intervienen en la reacción; la reacción transcurrirá hacia la derecha.
Solución.
Dado el siguiente equilibrio homogéneo:
N2(g) + 3 H2(g) ⇔ 2 NH3(g)
a) Falsa. La reacción transcurrirá hacia la izquierda ya que el número de moles de N2 es 0 y el
sistema debe evolucionar hacia la formación de dicho reactivo.
Esto se confirma comparando el coeficiente de concentración inicial (Q) con el valor de Kc.
Q = [ NH3 ]2
/ ([ N2 ] . [ H2 ]3
) = (1/2 )2
/ ((0/2) . (0,5/2)3
) = 0,25 / 0 = º
Q toma un valor muy grande, que debe disminuir aumentando el denominador, es decir,
desplazándose hacia la izquierda.
b) Para ver si es verdadera o falsa calculamos el valor de Q:
Q = [ NH3 ]2
/ ([ N2 ] . [ H2 ]3
) = (0,5/2 )2
/ ((0,5/2) . (0,5/2)3
) = 1 / (0,5/2)2
= 16
Como Kc= 0,5 y el resultado obtenido de Q = 16 , para alcanzar el equilibrio debe aumentar el
denominador y disminuir el numerador, es decir, que debe aumentar la cantidad de N2 y H2 y
disminuir la cantidad de NH3. Por tanto, la reacción se desplazará hacia la izquierda. La
afirmación es falsa.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-179-320.jpg)

![CASTILLA LEÓN / JUNIO 98.COU / QUIMICA / CINÉTICA Y EQUILIBRIO /
OPCION A / Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Explique y justifique si las siguientes proposiciones son ciertas o falsas.
a) De dos sales poco solubles siempre tendrá menos solubilidad la que tenga menor
producto de solubilidad.
b) La solubilidad del Ag2CrO4, sal poco soluble, será menor en agua que en una disolución
0,01 M de AgNO3.
c) El producto de solubilidad del Ag2CrO4 cambia con la temperatura.
d) Para el compuesto MF2 (peso molecular 100 g/mol) que tiene una Ks = 4,0·10-12
, la
solubilidad acuosa será 0,010 g/L.
Solución:
a) Es falso.
La solubilidad de una sal depende del producto de solubilidad, pero también depende del número
de iones en los que se disocie dicha sal. De dos sales con el mismo producto de solubilidad tendrá
menos solubilidad aquella que se disocie en menos iones; por esta razón, la afirmación propuesta
es falsa ya que no se cumple en todos los casos.
Por ejemplo la solubilidad del AgCl (Ks = 2·10-10
), que se disocia en dos iones, es menor que la del
Ag2CrO4 (Ks = 1·10-12
), que se disocia en tres iones. Estas solubilidades son respectivamente
1,4·10-5
M y 6,3·10-5
M.
b) Es falso.
En la disolución 0,01 M de AgNO3 hay iones Ag+
que producen el efecto del ion común.
Para eliminar ese exceso de iones Ag+
, el equilibrio de solubilidad del Ag2CrO4 se desplaza hacia
la izquierda, el resultado de esto es una mayor precipitación.
Es decir, ocurre todo lo contrario, la solubilidad es mayor en agua pura.
c) Es cierto.
El producto de solubilidad del Ag2CrO4 , como el de cualquier sal, al ser una constante de
equilibrio varía con la temperatura.
d) Es cierto.
El equilibrio de solubilidad sería.
MF2 (s) çè M2+
(aq) + 2F-
(aq)
s s 2s
Ks = [M2+
]·[F-
] = s · (2s)2
= 4s3
Ks / 43 = (4 ⋅10
−12
)/ 43
= 10
−4
M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-181-320.jpg)

![CASTILLA-LEÓN /SEPTIEMBRE 98. LOGSE /QUÍMICA /CINÉTICA Y EQUILIBRIO
/BLOQUE A /Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- En un recipiente de 2,50 litros se introducen 117,6 g de N2 y 14,4 g de H2 y se
calienta hasta 220ºC; en este momento se alcanza el siguiente equilibrio:
N2 (g) + 3 H2 (g) 2NH3
Si la presión total en el recipiente donde se produce la reacción es de 12 atm
calcular:
a) La concentración en mol´l-1
de todas y cada una de las especies presentes en el
equilibrio.
b) El valor de Kc y Kp para el equilibrio en estas condiciones.
Solución 2:
a) Haciendo cálculos estequiométricos hallamos los moles de N2 y de H2
Nº moles = m / Pm
nH2 = 14,4 / 2,016 nN2 = 117,6 / 28,02
nH2 = 7,143 moles de nH2 nN2 = 4,197 moles de nN2
A continuación hacemos una tabla de equilibrio.
N2 (g) + 3 H2 (g) ↔ 2NH3
no 4,197 7,143
nr x 3x
neq (4,197 – x) (7,143 – 3x) 2x
Los moles totales serían:
nt = (4,197 – x) + (7,143 – x) + 2x = (11,34 – 2x) moles totales de la reacción.
La ley de gases ideales nos dice el nº exacto de moles de la reacción de forma que podemos
saber la x.
PV = nRT
120 · 2,5 = (11,34 – 3x) · 0,082 · (273 + 220)
x = 1,959
n = 7,42 moles de la reacción
[N2 ]eq = nº de moles / V [H2 ]eq = nº de moles / V
[N2 ]eq = (4,197 – 1,959) / 2,5 [H2 ]eq = (7,143 – 3 · 1,959) / 2,5
[N2 ]eq = 0,895 M [H2 ]eq = 0,5 M
[NH3 ]eq = nº de moles / V](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-183-320.jpg)
![CASTILLA-LEÓN /SEPTIEMBRE 98. LOGSE /QUÍMICA /CINÉTICA Y EQUILIBRIO
/BLOQUE A /Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
[NH3 ]eq = 2 · 1,959
[NH3 ]eq = 1,6 M
b) Valor de Kc
Kc = ([NH3 ]eq) 2
/ ([N2 ]eq · ([H2 ]eq)3
)
Kc = 0,0256 / 0,112
Kc = 22,88 mol-2
·L2
Utilizando la relación existente entre las dos constantes hallamos el valor de Kp.
Kp = Kc · (RT)∆n
∆n = 2 – (1 + 3)
Kp = 22,88 · ( 0,082 . 493)-2
∆n = -2 moles
Kp = 0,014 atm-2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-184-320.jpg)



![CATALUÑA / JUNIO 00. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO / SERIE 3
/ OPCIÓN A / EJERCICIO 5
www.profes.net es un servicio gratuito de Ediciones SM
5.-El pH de una disolución 0,025 M de HNO2 es 2,56.
a) Escribir la ecuación de disociación del ácido nitroso.
b) ¿Cuál será el valor de Ka de este ácido?
c) Justifique como sería el pH de una disolución de nitrito de sodio: ácido, básico o
neutro.
Solución:
a) Ecuación de disociación del ácido nitroso:
HNO2 + H2O • NO2
-
+ H3O+
b) Cálculo de la Ka:
HNO2 + H2O • NO2
-
+ H3O+
C0 0,025 --- ---
Cr x
Ceq. 0,025 – x x x
pH = 2,56
[H3O+
] = 10-2,56
= 2,51·10-3
M
Entonces:
[NO2
-
] = 2,51·10-3
M
[HNO2] = 0,025 – 2,5·10-3
= 2,25 · 10-2
M
Ka = [H3O+
] · [NO2
-
] / [HNO2]
Ka = (2,51·10-3
)2
/ 2,25·10-2
Ka = 2,8·10-4
mol/l
c) Una disolución de la sal soluble NaNO2 se disocia completamente del siguiente modo:
NaNO2 → Na+
+ NO2
-](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-188-320.jpg)

![CATALUÑA / JUNIO 00. COU / QUIMICA / CINETICA Y EQUILIBRIO/ SERIE 3 /
OPCION A / EJERCICIO 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- En un recipiente de 5 litros y a una temperatura T hay una mezcla de 0,012 moles de
dióxido de azufre, 0,005 moles de oxígeno y 0,001 moles de trióxido de azufre. La
constante de equilibrio para la reacción:
2 SO2 (g) + O2 (g) • 2 SO3 (g) ∆H < 0
es de 2 · 106
a la temperatura T
a) Indique si la mezcla está en equilibrio, si no lo está razone como variará el número
de moles de cada sustancia al evolucionar hacia el equilibrio.
b) A partir de la ley de acción de masas razone como varia el rendimiento de la
obtención de trióxido de azufre
- al aumentar la temperatura
- al comprimir la mezcla en equilibrio
Solución:
a) 2 SO2 (g) + O2 (g) • 2 SO3 (g)
Concentración (mol/L) 0,012/5 0,005/5 0,001/5
Aplicando la ley de acción de masas:
Kc = [SO3]2
/ [SO2
2
][O2]
Se calcula el coeficiente de concentración:
Q = (2·10-4
)2
/ (2,4·10-3
)2
(1·10-3
) = 6,94
Se comprueba que: Q ≠ Kc; 6,94 ≠ 2·106
Como el valor obtenido de Q al aplicar la ley de acción de masas es distinto del valor de la
constante de equilibrio, lo que significa que la mezcla con las concentraciones indicadas no se
encuentra en equilibrio.
El valor de la constante de equilibrio es mucho mayor que el de Q. Para que el sistema
evolucione hacia el equilibrio, tiene que desplazarse hacia la formación de SO3, de forma que
aumente el numerador y disminuya el denominador de la expresión de Kc.
Variación del número de moles de cada sustancia:
2 SO2 (g) + O2 (g) • 2 SO3 (g)
inicialmente 0,012 0,005 0,001
reaccionan 2x x ---
equilibrio 0,012 – 2x 0,005 – x 0,001+ 2x](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-190-320.jpg)


![CATALUÑA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / SERIE 2
/ OPCIÓN A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- La constante del producto de solubilidad del hidróxido de magnesio a 25ºC es de
5,61·10-12
.
a) Calcule la solubilidad (en g / L) de dicho compuesto en agua pura.
b) Calcule la solubilidad (en g / L) de dicho compuesto en una disolución de hidróxido
sodico de pH = 12.
c) Explique de qué manera se podría conseguir la redisolución del precipitado.
Datos: masas atómicas: O = 16; H = 1; Mg = 24,3.
Kw = 1,0·10-14
Solución:
a) El equilibrio de la sal poco soluble es:
Mg(OH)2 (s) Mg2+
(ac) + 2 OH-
(ac)
s 2·s
Siendo s la concentración molar de iones en disolución a la temperatura dada.
La expresión del producto de solubilidad aplicada a este caso, quedaría:
Ks = [Mg2+
] · [OH-
]2
= s · (2·s)2
= 4·s3
= 5,61·10-12
De donde:
s = 1,12·10-4
mol / L
Y con la masa molecular del compuesto, se obtiene la solubilidad en g / L:
s = 1,12·10-4
mol / L · 58,3 g / mol = 6,52·10-3
g / L
b) Si existe una disolución de NaOH, hay más iones OH-
, lo que desplaza el equilibrio hacia
la izquierda, disminuyendo la solubilidad del hidróxido magnésico.
Se llama ahora s´ a la nueva solubilidad.
Se sabe que si el pH =12:
pH + pOH =14; Luego pOH = 2
pOH = -log [OH-
] = 2
[OH-
] = 10-2
M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-193-320.jpg)
![CATALUÑA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / SERIE 2
/ OPCIÓN A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
De nuevo se escribe el equilibrio original, considerando ahora la concentración total de iones
OH-
en disolución:
Mg(OH)2 (s) Mg2+
(ac) + 2 OH-
(ac)
s´ 2·s´ + 10-2
La expresión del producto de solubilidad, sería ahora :
Ks = [Mg2+
] · [OH-
]2
= s´ · (2·s´+ 10-2
)2
= 5,61·10-12
De donde:
s´ = 5,6 ·10-8
mol / L
Y con la masa molecular del compuesto, se obtiene la solubilidad en g / L:
s´ = 5,6 ·10-8
mol / L · 58,3 g / mol = 3,26 ·10-6
g / L
Como se preveía, la solubilidad del compuesto ha disminuido: s´<< s.
c) Si se acidifica el medio añadiendo, por ejemplo HCl, disminuye la [OH-
], con lo que el
equilibrio para compensar se desplaza hacia la derecha, disolviéndose así más cantidad de
hidróxido magnésico. Por tanto, aumenta la solubilidad.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-194-320.jpg)
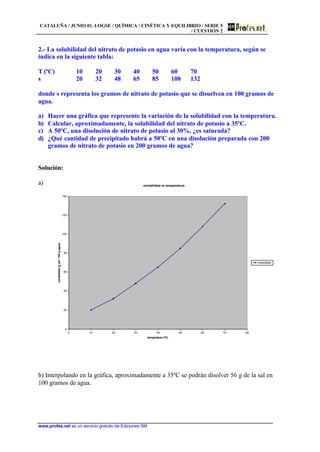

![CATALUÑA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQULIBRIO / SERIE 5 /
OPCIÓN B / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- En un recipiente de 1 litro de capacidad, y a la temperatura de 400ºC, se han
introducido 0,5 moles de yodo, 0,2 moles de hidrógeno y 3 moles de yoduro de
hidrógeno, todos en estado gaseoso.
El proceso que tiene lugar es el siguiente, con una constante de equilibrio Kc = 59, a la
temperatura dada:
I2 (g) + H2 (g) 2 HI (g)
a) Justifique en qué sentido transcurrirá la reacción a 400ºC.
b) Calcule las concentraciones de las tres especies en el equilibrio.
c) Una vez alcanzado el equilibrio, razone en qué sentido se desplazará la reacción si se
aumenta la presión total del sistema.
Solución:
a) Se escribe el equilibrio, y la expresión de la constante Kc, sustituyendo en ella las
concentraciones de todas las especies, halladas al dividir los moles entre el volumen total:
H2 (g) + I2 (g) 2 HI (g)
Moles iniciales 0,2 0,5 3
[ ]iniciales 0,2 / 1 0,5 / 1 3 / 1
Calculamos con estos datos el coeficiente de concentración:
Q = [HI]2
/ ([I2]·[H2])
Q = 32
/ (0,5 · 0,2) = 90
Se compara Q con la Kc = 59 dada en el enunciado:
Kc < Q
Luego la reacción se desplazará hacia la izquierda, aumentando la concentración de reactivos
y disminuyendo la del producto, para alcanzar así el equilibrio.
b) Se escribe de nuevo la reacción, denominando x a la concentración del producto
consumida, y de reactivos formada:
H2 (g) + I2 (g) 2 HI (g)
[ ]iniciales 0,2 / 1 0,5 / 1 3 / 1
[ ] equilibrio 0,2 + x 0,5 + x 3 – 2·x](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-197-320.jpg)
![CATALUÑA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQULIBRIO / SERIE 5 /
OPCIÓN B / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
Se sustituye en la expresión de la Kc:
(3 - 2·x)2
/ ((0,2 + x) · (0,5 + x)) = 59
De donde se obtiene:
x = 0,054 moles
[x] = 0,054 mol/L
Y así se calculan las concentraciones de las tres especies presentes en el equilibrio:
[I2] = 0,5 + 0,054 = 0,554 M
[H2] = 0,2 + 0,054 = 0,254 M
[HI] = 3 – 2·0,054 = 2,89 M
c) Según el principio de Le Chatelier, si sobre un equilibrio se introduce alguna modificación,
éste evoluciona en el sentido que se oponga a dicho cambio.
Si aumenta la presión, para mantener P · V = cte, el equilibrio se debe desplazar hacia el
miembro donde haya menor número de moles. En este caso los moles de reactivos y
productos coinciden, luego no se altera el equilibrio con la presión.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-198-320.jpg)


![CATALUÑA / JUNIO 01. COU / QUÍMICA / CINETICA Y EQULIBRIO / SERIE 3 /
CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- A una disolución acuosa que contiene iones yoduro y cloruro, en la misma
concentración 0,1 M, se le añade una disolución acuosa de nitrato de plata.
a) ¿Precipitará primero el cloruro de plata o el yoduro de plata? Justifique la respuesta.
b) Determine la concentración del primer ión cuando comienza a precipitar el segundo.
Datos:
Producto de solubilidad a 25ºC: Ks (cloruro de plata) = 1,8·10-10
Ks (yoduro de plata) = 8,3·10-17
Solución:
a) Se calcula la concentración de ión plata necesaria para que precipite cada sal, sabiendo que
del otro ión (el halogenuro) se tiene 0,1 M.
La sal que precipite en primer lugar será la que requiera para ello menor cantidad de plata:
AgI (s) Ag+
(ac) + I-
(ac)
s s
Ks (AgI) = 8,3·10-17
= [Ag+
] · [I-
] = s · 0,1
De donde:
[Ag+
] = 8,3·10-16
moles / L
AgCl (s) Ag+
(ac) + Cl-
(ac)
s s
Ks (AgCl) = 1,8·10-10
= [Ag+
] · [Cl-
] = s · 0,1
Y por tanto:
[Ag+
] = 1,8·10-9
moles / L
Es decir, precipita antes el yoduro porque necesita para ello menos concentración de plata.
b) Cuando empieza a precipitar el ión cloruro, la concentración de ión plata es 1,8·10-9
M;
luego si se sustituye este valor en la Ks del AgI, ya precipitado, se tiene:
Ks = [Ag+
] · [I-
] = 8,3·10-17
= 1,8·10-9
· [I-
]
[I-
] =4,61·10-8
M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-201-320.jpg)

![CATALUÑA / JUNIO 01. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / SERIE 3 /
OPCIÓN B / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
R – COOH + CH3OH R – COOCH3 + H2O (esterificación)
[inic.] 0,5 0,5 0,6 0,6
[recc.] x x
[equil.] 0,5-x 0,5-x 0,6+x 0,6+x
(0,6 + x )2
/ (0,5 - x)2
= 5
x = 0,16 mol/L
Estado de equilibrio:
[R – COOH] = [CH3OH] = 0,5 - 0,16 = 0,34 mol/L
[R – COOCH3 ] = [H2O] = 0,6 + 0,16 = 0,76 mol/L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-203-320.jpg)
![CATALUÑA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / SERIE 2
/ OPCIÓN B / CUESTIÓN Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- La constante de equilibrio Kc para la reacción:
SO2 (g) + NO2 (g) SO3 (g) + NO (g)
es igual a 3 a una temperatura determinada.
a) Justificar por qué no está en equilibrio, a la misma temperatura, una mezcla
formada por 0,4 moles de SO2, 0,4 moles de NO2, 0,8 moles de SO3 y 0,8 moles de NO
(en un recipiente de un litro)
b) Determinar la cantidad que habrá de cada especie en el momento de alcanzar el
equilibrio.
c) Justificar hacia donde se desplazará el equilibrio si se incrementa el volumen del
recipiente a 2 L.
Solución:
La expresión de la Kc para este equilibrio es la siguiente:
Kc = ([SO3]· [NO]) / ([SO2]· [NO2])
Y su valor a la temperatura dada es Kc = 3.
a) Se sustituyen las concentraciones de las 4 especies en una expresión del tipo anterior para
hallar el coeficiente de concentración (Q). Al ser el volumen total la unidad, coinciden moles
y concentraciones:
0,8 · 0,8
Q = = 4
0,4 · 0,4
Como el valor obtenido es distinto de 3, no se tiene la mezcla en equilibrio, y para que éste
sea alcanzado, habrán de aumentar las concentraciones de los reactivos, desplazándose hacia
la izquierda.
b) Se escribe el equilibrio, llamando “x” a la cantidad de productos consumida, y de reactivos
formada:
SO2 (g) + NO2 (g) SO3 (g) + NO (g)
[ ]inicial 0,4 0,4 0,8 0,8
[ ]equilibrio 0,4 + x 0,4 + x 0,8 – x 0,8 – x
Y se sustituye en la expresión de Kc, que se iguala a 3:
Kc = (0,8 – x)2
/ (0,4 + x)2
= 3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-204-320.jpg)
![CATALUÑA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / SERIE 2
/ OPCIÓN B / CUESTIÓN Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
De donde:
x = 0,04
Y se puede concluir:
[SO3] = [NO] = 0,44 moles / L
[SO2] = [NO2] = 0,76 moles / L
c) La variación de volumen o de presión en un equilibrio se relaciona con el número de moles
de especies gaseosas en un miembro y en otro de la ecuación, como en este caso, en ambos
miembros se tienen dos moles de gas, un aumento de volumen del recipiente no desplazaría el
equilibrio.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-205-320.jpg)
![CATALUÑA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / SERIE 3
/ OPCIÓN A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
4.- A 1 L de disolución de nitrato de plata de concentración 1,0 · 10-4
mol· dm-3
se le
añade gota a gota, una disolución 0,001 M de cloruro de sodio. Cuando se han
adicionado 1,8 cm3
de esta disolución, aparece un precipitado.
a) Escribir la reacción que tiene lugar y especificar el compuesto que precipita.
b) Calcular la constante del producto de solubilidad del precipitado que se ha formado
c) Explicar qué se observará si se añade amoníaco a la disolución que contiene el
precipitado.
Solución:
a) La reacción de precipitación será:
AgNO3 + NaCl τ AgCl $ + NaNO3
Precipitará el cloruro de plata.
b) El volumen total tras la mezcla será:
V total = 1 + 0,0018 = 1,0018 L
La expresión del producto de solubilidad del cloruro de plata es:
Ks = [Ag+
]· [Cl-
]
A partir de la concentración de cada sal soluble, se determinan las concentraciones reales de
ambos iones que forman la sal insoluble:
[ ] = ( M · V inicial ) / V final
[Ag+
] = 1 · 10-4
/ 1,0018
[Cl-
] = (1,8 · 10-3
· 0,001) / 1,0018
Aplicando estos valores, correspondientes a la disolución saturada, a la expresión de Ks se
tiene:
Ks = 1,8 · 10-10
c) Si se adiciona amoníaco, se formará un ión complejo estable entre el catión central plata y
los ligandos NH3 , por lo que el precipitado se redisolverá:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-206-320.jpg)



![CATALUÑA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / SERIE 3
/ CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- a) Indicar cuál es el pH de una disolución 0,01 M de ácido nítrico.
b) Se añaden 0,82 g de acetato de sodio a 1 L de la disolución anterior. Razonar si el pH
será más pequeño, igual o mayor que en el caso anterior.
c) Para al caso b), calcular la concentración de ión acetato en la disolución.
Datos: masas atómicas: H = 1; C = 12; O = 16; Na = 23
Ka (ácido acético) = 1,8 · 10-5
Solución:
a) El ácido nítrico es un ácido fuerte, totalmente disociado, luego la concentración de protones
final será la misma que la inicial de ácido:
HNO3 + H2O š NO3
-
+ H3O+
Luego:
[HNO3] inicial = [H3O+
] final = 0,01 M
Según la definición de pH se calcula su valor:
pH = - log [H3O+
] = 2
Como era de esperar, la disolución es ácida (pH<7).
b) Se adiciona acetato de sodio, sal que procede del ácido acético (ácido débil) y de hidróxido
de sodio (base fuerte).
La parte que procede del ácido débil, es decir, el ión acetato, se hidrolizará, desprendiéndose
iones OH-
, que reducirán el carácter ácido de la disolución, luego su pH final será más alto
(más cercano a 7) que en el momento inicial.
CH3COONa š CH3COO-
+ Na+
CH3COO-
+ H2O CH3COOH + OH-
Hidrólisis básica
c) Se hallan los moles de acetato: n CH3COONa = 0,82 / = 0,82 / 82 = 0,01 moles
Como el volumen no varía por la adición de la sal: [CH3COONa] = 0,01 M
La cantidad adicionada de acetato, es estequiométricamente equivalente a la de ácido nítrico
inicial. Luego se supone que finalmente se trabaja con una disolución de ácido acético
también 0,01 M.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-210-320.jpg)
![CATALUÑA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / SERIE 3
/ CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
Se escribe el equilibrio de disociación del ácido acético (HAc = débil), y con la concentración
inicial y la constante de acidez, se determina la concentración de iones acetato (Ac-
), que
coincidirá con la de protones:
HAc + H2O Ac-
+ H3O+
[ ]inicial 0,01 -- --
[ ]equilibrio 0,01 – x x x
De donde, gracias a la expresión de la Ka, se tiene:
Ka = ([Ac-
]· [H3O+
]) / [HAc]
1,8· 10-5
= x2
/ (0,01 – x)
Despejando:
x = 4,2 · 10-4
mol/L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-211-320.jpg)
![CATALUÑA / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / SERIE 2
/ OPCIÓN A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- El ácido acetilsalicílico (aspirina) de fórmula C9H8O4, es un ácido débil y
monocrótico. Su solubilidad en agua es 0,5 g en 150 mL y una disolución saturada tiene
un pH 2,65.
a) Calcular su constante de acidez.
b) Justificar si el pH de una disoluciónde la sal sódica del ácido acetilsalicílico es menor,
igual o mayor que 7.
c) La digestión de aspirinas puede ser perjudicial en los casos en los que haya tendencia
a una excesiva acidez gástrica. Justificar si los siguientes productos serían o no
adecuados para compensar esta acidez:
Cloruro de sodio, vinagre, glucosa, hidrógenocarbonato de sodio.
Masas atómicas: H = 1; C = 12; O = 16.
a) Es un ácido débil, luego estará parcialmente disociado, se denomina Co a la concentración
inicial:
HA + H2O A-
+ H3O+
[inicial] Co -- --
[equilibrio] Co · (1 - a) Co · a Co · a
Y por definición:
pH = - log · [H3O+
] = 2,65
Luego:
[H3O+
] = 10-2,65
= 2,24 · 10-3
M = Co · a
Con los datos de solubilidad y la masa molecular se halla la concentración inicial, y así se
despeja el grado de disociación, a:
Co = (0.5 / 180) / 0,15 = 0,0185 M
2,24 · 10-3
M = 0,0185 · a
a = 0,121 = 12,1 %
La expresión de la constante de equilibrio, será:
Ka = ([A-
] · [H3O+
]) / [HA]
Y sustituyendo los datos calculados, se tiene ya su valor:
Ka = (Co · a2
) / (1 - a)](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-212-320.jpg)

![CATALUÑA / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / SERIE 2
/ OPCIÓN A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- A temperatura ambiente una disolución saturada de cloruro de plomo (II) contiene
1,004 g de la sal en 250 mL de disolución.
a) Calcule el producto de solubilidad del cloruro de plomo (II).
b) Determine si se producirá precipitación al mezclar 10 cm3
de disolución de cloruro de
sodio 0,1 M con 30 cm3
de disolución de nitrato de plomo (II) 0,01 M.
Masas atómicas: Cl = 35,5; Pb = 207,2
Solución:
a) La expresión del producto de solubilidad es:
Kps = [Pb2+
] · [Cl-
]2
Se determinan las concentraciones de los dos iones en disolución:
[Pb2+
] = (1,004 / 278) / 0,250 = 0,0144 M
Dada la estequiometría de la sal: PbCl2, habrá el dobles de iones cloruro:
[Cl-
] = 0,0288 M
Luego:
Kps = 0,0144 · 0,0288 = 1,2 · 10-5
b) Se halla el producto entre las concentraciones de los dos iones dadas, y se compara con el
valor de Kps:
[Pb2+
] · [Cl-
]2
= 0,0075 · 0,0252
= 4,69 · 10-6
Como es un valor menor que Kps, no habrá precipitado.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-214-320.jpg)
![CATALUÑA / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / SERIE 5
/ OPCIÓN A / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
CUESTIÓN 3
3.- El ácido benzoico es monoprótico con una constante de disociación Ka = 6,3 · 10-5
a) Determinar el pH de una disolución 0,05 M de ácido benzoico y la concentración de
las especies presentes.
b) Determinar el volumen de una disolución NaOH 0,1 M necesaria para valorar 25 cm3
de la disolución anterior.
c) Justificar si en el punto de equivalencia de valoración la disolución será ácida, básica
o neutra.
Solución:
a) El ácido benzoico es un ácido monoprótico y débil, luego se disocia parcialmente, dando
lugar a un equilibrio:
HB + H2O ‡ B-
+ H3O+
[inicial] 0,05 -- --
[equilibrio] 0,05 - x x x
La expresión de la constante de equilibrio, será:
Kc = ([B-
] · [H3O+
]) / [HB]
Y sustituyendo su valor, dado en el enunciado, se despeja la cantidad disociada, "x":
6,3 · 10-5
= x2
/ (0,05 - x)
Ya se tiene:
x = 1,77 · 10-3
M
Y por definición:
pH = - log · [H3O+
] = - log 1,77 · 10-3
= 2,75
Como era de esperar, es un disolución ácida, de pH menor que 7.
[B-
] = [H3O+
] = 1,77 · 10-3
M
[HB] = 0,05 - 1,77 · 10-3
= 0,0482 M
b) En una valoración se cumple.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-215-320.jpg)



![CATALUÑA /JUNIO 98.COU /QUÍMICA / CINÉTICA Y EQUILIBRIO
/OPCIÓN B/Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Calcula el pH de la disolución que se obtiene al añadir 15mL de NaOH 0,1 M a:
a) 15mL de ácido clorhídrico 0,1 M. ( 0,5 ptos)
b) 10,0mL de ácido clorhídrico 0,1 M. ( 0,7 ptos)
c) 15mL de ácido benzoico 0,1 M. ( 0,8 ptos)
Datos: Ka (ác.benzoico) = 6,5⋅10-5
; Kw = 10-14
Solución:
a) Se produce una neutralización completa debido a que los volúmenes y las concentraciones de NaOH
y HCl son iguales quedando una disolución de NaCl (sal formada por un ácido y una base fuerte) que
da un pH = 7 (neutro).
NaOH + HCl D NaCl + H2O
b) En este caso queda en exceso 15 – 10 = 5mL de NaOH 0,1M que se encuentran contenidos en un
volumen de 15 + 10 = 25mL. Como el NaOH está totalmente disociado, será:
[OH-
] = 0,1⋅ 5 / 25 = 0,02 M
pOH = 1,7 ; pH = 14 – 1,7 = 12,3
c) La neutralización es completa debido a que el ácido benzoico es un ácido monoprótico y las
concentraciones y los volúmenes de ácido y de base son iguales.
C6H5COOH + NaOH " C6H5COONa + H2O
Se forma una disolución de benzoato sódico , cuyo anión C6H5COO-
sufre la reacción de hidrólisis.
Como el C6H5COONa está totalmente disociado: [C6H5COO-
] = 0,1 · 15 / 30 = 0,05 M
Ecuación de la hidrólisis: C6H5COO-
+ H2O D C6H5COOH + OH-
Concentraciones iniciales 0,05 0 0](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-219-320.jpg)
![CATALUÑA /JUNIO 98.COU /QUÍMICA / CINÉTICA Y EQUILIBRIO
/OPCIÓN B/Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
Concentraciones en el equilibrio 0,05-x x x
Se deduce que la constante de hidrólisis es igual a la de basicidad del anión C6H5COO-
y por lo tanto:
De donde x = [OH-
] = 2,7⋅10-6
M
pOH = 5,6
pH = 14 - 5,6 = 8,4
05,005,0
105,1
105,1
10·5,6
10·0,1
][
]][[
22
10
10
5
14
56
56
x
x
x
Ka
Kw
COOHC
OHOOHHC
KbKh
≈
−
=⋅
⋅====≡
−
−
−
−
−
−](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-220-320.jpg)
![CATALUÑA / JUNIO 98.COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN B / Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- Si la constante del producto de solubilidad del cloruro de plomo es 1,7⋅10-5
a) Indicar que se entiende por solución saturada. ( 0,5 ptoS)
b) Calcula la solubilidad del cloruro de plomo en mol/L . (0,75 ptos)
c) Calcula el volumen de solución saturada que se puede preparar con 1,0 g de cloruro de
plomo (II). (0,75 ptos)
Datos: Masas atómicas: Pb = 207; Cl = 35,5
Solución:
a) Disolución saturada es la disolución de una sustancia cuya concentración es la de equilibrio, con parte
de sustancia no disuelta. Es decir aquella cuya concentración coincide con el limite de la solubilidad.
b) Equilibrio de solubilidad:
PbCl2(s) D Pb2+
(aq) + 2Cl-
(aq)
Las concentraciones de cada ión seran:
[Pb2+
] = S; [Cl-
] = 2S
Por lo que sustituyendo en la expresión de Ks:
(
teniendo en cuenta el Pm de PbCl2 = 278 g/mol), la solubilidad será:
S = 1,6⋅10–2
mol/L · 278 g/mol = 4,5 g / L
c) Como en 1L se disuelven 4,5 g de esta sal, el volumen de disolución saturada que se puede preparar
con 1 g de PbCl2 será:
1 g / (4,5 g/L) = 0,22 L
Lmol
Ks
SSSSKs /106,1
4
107,1
4
;4)2( 23
5
332 −
−
?=
?
====](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-221-320.jpg)
![CATALUÑA / JUNIO 98.COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE 1 /
CUESTION 2.
www.profes.net es un servicio gratuito de Ediciones SM
2.- En 100 ml de agua a 25ºC se disuelven 93 mg de hidróxido de calcio.
a) ¿Qué pH tendrá esta disolución?
b) Calcular el producto de solubilidad del hidróxido de calcio a 25ºC.
Datos: masas atómicas: Ca = 40; H = 1; O = 16.
Solución:
a) Disolución de Ca(OH)2
Ca(OH)2 → Ca2+
+ 2 OH-
Es un hidróxido que se supone disociado completamente, por lo que la concentración de iones
OH-
será dos veces la concentración inicial de Ca(OH)2
Concentración de Ca(OH)2 = nº moles / V (L)
Nº de moles de Ca(OH)2 = m(g) / Pm = 0,093 / 74 = 1,2·10-3
moles
[Ca(OH)2] = 1,2·10-3
/ 0,1 = 1,2·10-2
M
Por lo tanto [OH-
] = 2· (1,2·10-2
) = 2,4·10-2
M
A partir del producto iónico del agua Kw = [H3O+
] · [OH-
]
10-14
= [H3O+
] · [OH-
]
[H3O+
] = 10-14
/ [2,4·10-2
]
[H3O+
] = 4,16·10-13
pH = - log [H3O+
] = - log (4,16·10-13
) = 12,4
b) Equilibrio de solubilidad Ca(OH)2 • Ca2+
+ 2 OH-
s 2s
Ks = [Ca2+
] · [OH-
]2
= s (2s)2
= 4 s3
Ks = 4 · (1,2·10-2
)3
= 8,00· 10-6](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-222-320.jpg)
![CATALUÑA / JUNIO 98.COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE 1 /
CUESTION 3.
www.profes.net es un servicio gratuito de Ediciones SM
3.- La constante de equilibrio Kp a 250ºC para la reacción:
PCl5 (g) • PCl3 (g) + Cl2 (g)
Es igual a 1,18 atm. Un recipiente de 1 dm3
contiene inicialmente 0,2 moles de PCl5 y 0,1
moles de Cl2 a la temperatura de 250ºC.
a) ¿Cuál es el valor de Kc de esta reacción a 250ºC?
b) Indique cuál será la concentración de cada una de las tres especies químicas al
alcanzar el equilibrio.
Datos: R = 8,314 J / K mol = 0,082 atm·L / K·mol
Solución:
a) Para calcular el valor de Kc, recurrimos a la relación que existe entre esta y Kp.
Kp = Kc (RT)∆n
Kc = Kp (RT)-∆n
Kc = 1,18 · (0,082 · 523)-1
= 2,75·10-2
b) PCl5 • PCl3 + Cl2
C inicial (mol/L) 0,2 0,1
C reacciona x - -
C equilibrio 0,2 – x x 0,1+ x
Aplicando la ley de acción de masas Kc = [PCl3][Cl2] / [PCl5]
Kc = x · (0,1 + x) / (0,2 – x) ; x2
+ 100.0275 x – 5.5 = 0
Resolviendo la ecuación de segundo grado obtenida, x = 0,034 mol/L
[PCl5] = 0,2 – 0,034 = 0,166 mol/L
[PCl3] = 0,034 mol/L
[Cl2] = 0,1 + x = 0,1 + 0,034 = 0,134 mol/L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-223-320.jpg)
![CATALUÑA / JUNIO 99. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.– Justifíquese si se producirá precipitado cuando mezclamos 80 cm3
de una disolución
0,01 M de sulfato de sodio con 120 cm3
de otra disolución 0,02 M de nitrato de bario.
Dato: Ks (sulfato de bario) = 1,1·10-10
.
Solución:
La reacción viene descrita por la ecuación:
Na2SO4 + Ba(NO3)2 → BaSO4 + 2 NaNO3
Para que se forme el precipitado de sulfato de bario, teniendo en cuenta que Na2SO4 y
Ba(NO3)2 son dos sales totalmente disociadas:
BaSO4 (s) D Ba2+
(aq.) + SO4
2-
(aq.)
El producto iónico tiene que ser mayor que el producto de solubilidad:
Q = [Ba2+
] · [SO4
2-
] > Ks.
Para comprobarlo, calculamos primero el número de moles de iones SO4
2-
(que suministra la
disolución de Na2SO4 ), y el número de moles de iones Ba2+
(que proceden del Ba(NO3)2 ).
Así, tenemos que:
nº moles SO4
2-
= (0,01 mol / 1.000 mL) · 80 mL = 8 ·10-4
mol
nº moles Ba2+
= (0,02 mol / 1.000 mL) · 120 mL = 2,4 · 10-3
mol
y como al mezclarse ambas disoluciones el volumen final es del 200 mL, las concentraciones
molares de los iones dados, serán:
[SO4
2-
] = 8 · 10-4
mol / 0,200 L = 0,004 M
[Ba2+
] = 2,4 · 10-3
mol / 0,200 L = 0,012 M
Q = [SO4
2-
] · [Ba2+
] = 0,004 · 0,012 = 4,8 · 10-5
Este valor de Q es mayor que el valor de Ks =1,1 · 10-10
Por tanto, se formará precipitado de BaSO4.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-224-320.jpg)

![CATALUÑA / SEPTIEMBRE 00. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
SERIE 2 / OPCION A / EJERCICIO 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- La constante de equilibrio Kp para la reacción:
N2 (g) + 3 H2 (g) → 2 NH3 (g)
A 400ºC es igual a 1,67·10-4
, expresando la presión en atmósferas.
Un recipiente de 2,0 litros contiene, a 25ºC, 0,01 mol de N2, 0,02 moles de H2, 0,03 moles
de NH3.
Se calienta la mezcla gaseosa hasta 400ºC, en presencia de un catalizador.
a) Explique razonadamente si la mezcla está en equilibrio a 400ºC. Si no está en
equilibrio, ¿en qué sentido transcurrirá la reacción?
b) Una vez alcanzado el equilibrio, justifique qué pasará si:
1- Introducimos nitrógeno en el sistema
2- Disminuimos la presión del sistema.
Datos: R = 0,082 atm·L/K·mol = 8,31 J/K·mol
Solución:
a) Para saber si la mezcla está en equilibrio, calculamos el valor del coeficiente de
concentración Q Kc y comparamos con el valor dado de la constante.
N2 (g) + 3 H2 (g) → 2 NH3 (g)
Nº de moles eq. 0,01 0,02 0,03
Q Kc = [NH3]2
/ [N2] · [H2]3
Q Kc = (0,03)2
/ (0,01) · (0,02)3
= 11250
Sabiendo que Kp = Kc · (R·T) ∆n
Q Kp = 11250 · ( 0,082 · 673 )-2
= 3,69
Al no coincidir este valor obtenido con el tabulado, podemos decir que la mezcla no se
encuentra en equilibrio.
Dado que Q Kp > Kp, podemos afirmar que predominan el producto amoniaco (numerador)
y, por tanto, que la reacción esta desplazada hacia la derecha.
b) 1) Si se introduce nitrógeno en el sistema en equilibrio, según el principio de Le Chatelier,
este se desplazará para contrarrestar el cambio producido, en este caso se desplazará hacia la
derecha para consumir el nitrógeno suministrado.
2) Si disminuimos la presión del sistema en equilibrio (Dn < 0 ), este se desplazará hacia el
lado donde más moles gaseosos tengamos, en este caso se desplaza hacia la izquierda.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-226-320.jpg)
![CATALUÑA / SEPTIEMBRE. 00. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
SERIE 6 / OPCION A / EJERCICIO 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- Se dispone de una disolución 0,1 M de cloruro de calcio y 0,01 M de cloruro de
magnesio a la cual se añade lentamente una disolución de hidróxido sódico.
a) Indique si precipitará primero el hidróxido de calcio o el de magnesio.
b) ¿Se formará precipitado de hidróxido de calcio cuando el pH de la disolución sea
10?.
Datos; Ks (hidroxido de calcio) = 5,5·10-6
; Ks (hidroxido de magnesio) = 1,1·10-11
Solución:
a) Concentración de CaCl2 0,1 M y concentración de MgCl2 0,01 M.
Son dos sales solubles que en disolución acuosa se disocian completamente:
CaCl2 → Ca2+
+ 2 Cl-
MgCl2 → Mg2+
+ 2 Cl-
Se anade NaOH (base fuerte): NaOH → Na+
+ OH-
Tanto los iones Ca2+
como los Mg2+
reaccionarán con los iones OH-
pudiendo dar los
correspondientes precipitados de Ca(OH)2 y Mg(OH)2, el que aparezca uno u otro primero
dependerá de la concentración que tengamos de cada ión y del valor de las constantes de
solubilidad de cada uno de los precipitados.
CaCl2 → Ca2+
+ 2 Cl-
Inicial 0,1 M --- ---
Final --- 0,1 0,2
Ks (Ca(OH)2) = 5,5·10-6
= [Ca2+
] · [OH-
]2
de donde [OH-
]2
= 5,5·10-6
/ 0,1 = 5,5·10-5
Entonces la concentración de iones OH-
, y por lo tanto de NaOH, necesaria para que precipite
el Ca(OH)2 será:
[OH-
] = (5,5·10-5
)1/2
= 7,4·10-3
M
MgCl2 → Mg2+
+ 2 Cl-
Inicial 0,01 M --- ---
Final --- 0,01 0,02
Ks (Mg(OH)2) = 1,1·10-11
= [Mg2+
] · [OH-
]2
de donde [OH-
]2
= 1,1·10-11
/ 0,01= 1,1·10-9](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-227-320.jpg)
![CATALUÑA / SEPTIEMBRE. 00. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
SERIE 6 / OPCION A / EJERCICIO 5
www.profes.net es un servicio gratuito de Ediciones SM
Por lo que la concentración de iones OH-
, y por consiguiente la de NaOH, necesaria para la
precipitación de Mg(OH)2 será:
[OH-
] = (1,1·10-9
)1/2
= 3,3·10-5
M
Comparando ambos valores de concentración de OH-
necesarios para cada precipitación,
como para que precipite el Mg(OH)2 es necesario menor concentración de iones OH-
, será
este hidróxidoel que primero lo haga.
b) Si el pH de la disolución es 10, significa que:
pH + pOH = 14
pOH = 14 –10 = 4
pOH = -log[OH-
]
[OH-
] = 10-4
M.
Para la precipitación de Ca(OH)2 era necesaria una concentración [OH-
] = 7,4·10-3
M, que es
mayor que la que tenemos a pH = 10.
Asi que podemos afirmar que no precipitará el hidróxido de calcio.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-228-320.jpg)
![CATALUÑA / SEPTIEMBRE 00. SELECTIVIDAD / QUIMICA / CINETICA Y
EQUILIBRIO / SERIE 2 / OPCION A / EJERCICIO 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- En una reacción de dióxido de azufre con dióxido de nitrógeno se obtiene trióxido de
azufre y monóxido de nitrógeno. A 25ªC un recipiente de 1 litro contiene en el equilibrio
0,8 moles de dióxido de azufre, 0,1 moles de dióxido de nitrógeno, 0,6 moles de trióxido
de azufre y 0,4 moles de monóxido de nitrógeno. Calcule:
a) Las constantes Kc y Kp.
b) El número de moles de monóxido de nitrógeno que habría que añadir al recipiente
para que la concentración de dióxido de nitrógeno aumente a 0,3 mol/L si se mantiene
constante la temperatura.
Datos: R = 0,082 atm·L/K·mol
Solución:
a) Reacción: SO2 (g) + NO2 (g) D SO3 (g) + NO (g)
moles en equilibrio 0,8 0,1 0,6 0,4
Expresión de la constante de equilibrio:
Kc =
[ ][ ]
[ ][ ]22
3
·
·
NOSO
NOSO
Como el volumen del recipiente es de 1 L, la concentración de cada sustancia coincide
numéricamente con el nº de moles de cada una de ellas.
Kc = (0,6) · (0,4) / (0,8) · (0,1) = 3
La expresión que relaciona Kc y Kp es la siguiente:
Kp = Kc · (RT)∆n
∆n = incremento del número de moles gaseosos
∆n = 2 – 2 = 0
Kp = 3 · (0,082 · 298)0
= 3
b) Al añadir x moles en exceso de NO (producto) el equilibrio se desplaza hacia la izquierda:
Reacción: SO2 + NO2 D SO3 + NO Moles
0,8 0,1 0,6 0,4+x equilibrio inicial
--- --- y y reaccionan
y y --- --- se forman
0,8+y 0,1+y 0,6-y 0,4+x-y equilibrio final](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-229-320.jpg)

![CATALUÑA / SEPTIEMBRE 00. SELECTIVIDAD / QUIMICA / CINETICA Y
EQUILIBRIO / SERIE 2 / OPCION A / EJERCICIO 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- Un yogurt tiene un pH = 3. Si se considera que el único ácido presente en el yogurt es
el ácido láctico, calcular la concentración de este ácido expresada en gramos de ácido
por litro.
Datos: El ácido láctico es monoprótido de Ka = 1,25·10-4
y de masa molar 90 g/mol.
Solución:
El yogurt tiene pH = 3.
El ácido láctico tiene un solo protón HL y como constante de ionización: Ka = 1,25·10-4
Moles HL + H2O D L-
+ H3O+
Inicialmente C0 -- --
Se disocian x -- --
Equilibrio C0 – x x x
Sabiendo que: pH = -log [H3O+
]
[H3O+
] = 10-3
M
Aplicando la ley del equilibrio Ka = x2
/ (C0-x)
1,25·10-4
= (10-3
)2
/ (C0 – 10-3
)
1,25·10-4
= 10-6
/ (C0 – 10-3
)
C0 = 9·10-3
M
Para pasar la concentración a gramos/litro, sabemos que:
C (g/L) = M (mol/L) · Mm
[HL] = 9·10-3
· 90
[HL] = 0,81 g / L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-231-320.jpg)
![CATALUÑA / SEPTIEMBRE 00. COU / QUIMICA / CINETICA Y EQUILIBRIO /
SERIE 6 / OPCION A / EJERCICIO 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- La constante de equilibrio, Kc a 448ºC, para la reacción:
I2 (g) + H2 (g) • 2 HI (g)
Es igual a 50.
Un recipiente contiene inicialmente una mezcla formada por 0,5 moles de I2, 0,2 moles
de H2 y 1 mol de HI a una temperatura de 448ºC.
a) Justifique mediante los cálculos necesarios que la mezcla no está en equilibrio e
indique en que sentido se desplazará la reacción.
b) La mezcla reacciona hasta llegar al equilibrio a 448ºC. Indique el número de moles
de cada especie en equilibrio.
Solución:
a) Reacción: I2 (g) + H2 (g) • 2 HI (g)
moles iniciales : 0,5 0,2 1
Aplicando la ley de acción de masas y tomando un volumen de V L para el sistema,
comprobamos si el valor que se obtiene del coeficiente de concentración (Q), coincide con el
valor dado por el problema para la constante de equilibrio (Kc).
Kc = [HI]2
/ [I2]·[H2 ]
Q = (1/V)2
/ ((0,5/V)·(0,2/V)) = 1 / 0,1 = 10
El valor obtenido de Q no coincide con el valor de Kc, por consiguiente se puede afirmar que
los valores de concentraciones dados no corresponden a una situación de equilibrio.
Para que se alcance el estado de equilibrio, la reacción tendrá que desplazarse hacia la derecha
para que así aumente la concentración de HI, y disminuya la de I2 y la de H2.
b) Según lo explicado en el apartado anterior la situación inicial evoluciona hacia el producto:
Reacción: I2 (g) + H2 (g) • 2 HI (g)
inicialmente 0,5 0,2 1
reaccionan x x ---
equilibrio 0,5 – x 0,2 – x 1 + 2 x
Aplicando la ley del equilibrio:
Kc = [HI]2
/ [I2]·[H2 ]](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-232-320.jpg)

![CATALUÑA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRO /
SERIE 1 / OPCIÓN A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- Un matraz de 2 L a 373 K contiene una mezcla en equilibrio formada por 0,20 moles
de N2O4 y 0,29 moles de NO2.
a) Calcular las constantes de equilibrio Kc y Kp de la reacción: N2O4 2 NO2 a
esta temperatura.
b) Si se añaden 0,11 moles deNO2 al recipiente, calcular las concentraciones de las dos
especies al alcanzarse de nuevo el equilibrio.
Datos: R = 0,082 atm · L· K-1
· mol-1
= 8,31 J · K-1
· mol-1
Solución:
a) El equilibrio que tiene lugar es el siguiente:
N2O4 2 NO2
Su expresión de Kc será:
Kc = [NO2]2
/ [N2O4]
Y las concentraciones de los dos gases en el equilibrio:
[NO2] = 0,29 / 2 = 0,145 M
[N2O4] = 0,20 / 2 = 0,10 M
De donde:
Kc = 0,210 mol/L
Por la relación entre Kc y Kp, se tiene:
Kp = Kc · (R· T)Dn
Kp = 0,210 · (0,082· 373)2 -1
= 6,43 atm
b) Se modifican los moles de N2O4, luego variará su concentración inicial y, para reestablecer
el equilibrio, se tenderá a formar NO2, reaccionando "x" moles del N2O4:
N2O4 2 NO2
Moles iniciales 0,20 0,29 + 0,11](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-234-320.jpg)
![CATALUÑA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRO /
SERIE 1 / OPCIÓN A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
Moles equilibrio 0,20 + x 0,40 - 2 · x
Dividiendo por 2 para pasar a concentraciones, y sustituyendo en Kc (que no varía, al
mantenerse constante la temperatura), se llega a:
Kc = (0,2 - 2· x)2
/ (0,10 + x) = 0,210
De donde: x = 0,0205 M
Por lo que se tiene finalmente el nuevo estado de equilibrio:
[NO2] = 0,159 mol/L
[N2O4] = 0,1205 mol/L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-235-320.jpg)



![CATALUÑA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
SERIE 1 / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- El análisis químico de una determinada muestra de agua da que cada litro contiene,
entre otras especies: 384 mg de calcio y 76,8 mg de sulfato.
a) Hallar la concentración molar de calcio y de sulfato en el agua analizada.
b) Justificar por que no se observa precipitado de sulfato de calcio.
c) Si a 1 L del agua anterior se le añaden 200 cm3
de disolución 0,02 M de sulfato de
sodio, se observa precipitado Justificarlo.
Datos: masas atómicas: H = 1; C = 12; O = 16; Na = 23; Ca = 40
Kps (sulfato de calcio) = 3 · 10-5
Solución:
a) Con las masas de los 2 iones y sus masas atómicas, se determinan sus concentraciones
molares:
[Ca2+
] = 0,0096 M
[SO4
2-
] = 0,0008 M
b) El producto de estas concentraciones se compara con el dato de Kps:
[Ca2+
]· [SO4
2-
] = 0,0096 · 0,0008 = 7,68 · 10-6
< Kps
En este caso, la sal se disuelve por completo, y no aparece precipitado en el fondo.
c) Se modifica ahora el volumen final, y la masa de iones sulfato, luego las nuevas
concentraciones serán:
V final = 1,2 L
Nuevos moles de SO4
2-
= 0,02 · 0,2 = 0,004 moles
[Ca2+
] = 0,0096 / 1,2 = 0,008 M
[SO4
2-
] = (0,0008 + 0,2 · 0,02) / 1,2 = 0,004 M
De nuevo se multiplican las concentraciones:
[Ca2+
]· [SO4
2-
] = 0,008 · 0,004 = 3,2 · 10-5
> Kps
Ahora sí hay precipitado del sulfato de calcio.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-239-320.jpg)


![CATALUÑA / SEPTIEMBRE 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
SERIE 3 / OPCIÓN B / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN B
CUESTIÓN 4
4.- El cloruro de hidrógeno es un gas muy soluble en agua cuya disolución acuosa se
denomina ácido clorhídrico. Se puede obtener por reacción entre el cloruro de sodio y
ácido sulfúrico concentrado.
a) Escribir la reacción correspondiente de obtención de cloruro de hidrógeno a partir de
los compuestos anteriores.
b) Calcular el pH de la disolución obtenida formada a partir de 1 g de cloruro de sodio
disuelto en 0,5 L de agua.
c) Calcular la concentración y el pH que tendrá una disolución de NaOH tal que 1 l de
ella neutralice la disolución del apartado anterior.
Masas atómicas: H = 1; O = 16 ; Na = 23 ; Cl = 35,5
Kw = 1,0·10-14
Solución:
a) La reacción que tiene lugar es:
2 NaCl + H2SO4 " 2 HCl + Na2SO4
b) Se determinan los moles contenidos en el gramo de NaCl empleado, y así se calculan los
moles de HCl formados, y con el volumen dado, su molaridad:
moles NaCl = 1 / (23 + 35,5) = 0,017 moles
Se forman los mismos moles de HCl, pues la relación estequiométrica es 1:1, y como el
volumen final es de 0,5 L, se tiene:
M HCl = 0,017 / 0,5 = 0,034 M
El HCl es un ácido fuerte, totalmente disociado, luego habrá la misma concentración de
protones que inicial de ácido:
HCl + H2O " H3O+
+ Cl-
[inicial] 0,034 -- --
[final] -- 0,034 0,034
Por definición:
pH = - log [H3O+
]](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-242-320.jpg)
![CATALUÑA / SEPTIEMBRE 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
SERIE 3 / OPCIÓN B / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
Luego, en este caso:
pH = 1,46, un pH ácido como era de esperar.
b) En una valoración se cumple.
Nº equivalentes ácido = nº equivalentes base
O lo que es lo mismo:
(N · V) a = (N · V) b
En el caso dado, al ser un ácido monoprótico, coinciden molaridad y normalidad, luego basta
con sustituir y averiguar la normalidad de la base NaOH:
0,034 · 0,5 = Nb · 1
Nb = 0,017 N
Estamos ante una base fuerte, disociada por completo:
NaOH " Na+
+ OH-
[inicial] 0,017 -- --
[final] -- 0,017 0,017
El pOh se halla:
pOH = - log [OH-
] = 1,77
Y como:
pH + pOH = 14
Se tiene:
pH = 12,23
Es, pues, una disolución de carácter básico.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-243-320.jpg)

![CATALUÑA / SEPTIEMBRE 98.LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
SERIE 2 / PREGUNTA Nº 3 / CUESTION B
www.profes.net es un servicio gratuito de Ediciones SM
3.B.- Justificar si se producirá precipitado de cloruro de plata al mezclar 1 litro de una
disolución 10-4
M de cloruro sódico con 1 litro de una disolución de nitrato de plata
6·10-7
M.
Datos: Kps (ClAg) = 1,1·10-10
Solución:
Tanto el cloruro sódico como el nitrato de plata son sales solubles, es decir que se disocian
completamente.
Calculando las concentraciones de NaCl y AgNO3, conocemos las concentraciones de los iones Cl-
y Ag+
que tenemos en disolución, para formar el precipitado.
NaCl → Na+
+ Cl-
AgNO3 → Ag+
+ NO3
-
Teniendo en cuenta que los volúmenes son aditivos V = 1 + 1 = 2L
[NaCl] = [Cl-
] = 10-4
/ 2 = 5·10-5
M
[AgNO3] = [Ag+
] = 6·10-7
/ 2 = 3·10-7
M
Para ver si precipita o no cloruro de plata hay que comparar el producto iónico con el
producto de solubilidad.
Kps = 1,1·10-10
AgCl (s) D Cl-
+ Ag+
Si Q > Kps si se formará precipitado
Si Q < Kps no se formará precipitado
Si Q = Kps equilibrio de saturación
Q = [Cl-
] · [Ag+
] = 5·10-5
· 3·10-7
= 1,5·10-11
Como Q < Kps no se forma precipitado de cloruro de plata](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-245-320.jpg)
![CATALUÑA / SEPTIEMBRE 98. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
SERIE 5 / OPCION A / PROBLEMA Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.c).- Calcular el número de iones cloruro y el número de iones plata existentes en 100cm3
de una disolución saturada de cloruro de plata.
Datos: Kps (cloruro de plata) = 1,76·10-10
; NA = 6,02·1023
Solución:
Disolución saturada de cloruro de plata 100 cm3
= 0,1 L
Equilibrio de solubilidad. ClAg (s) D Cl-
+ Ag+
S S
Kps = S · S = S2
;
1,76·10-10
= S2
S = 1,32·10-5
mol/L
Si la disolución está saturada: [Cl-
] = [Ag+
] = S = 1,32·10-5
mol/L
Nº moles de iones Cl-
= Nº moles de iones Ag+
= 1,32·10-5
mol/L · 0,1 L = 1,32·10-6
moles
Sabiendo que en 1 mol de iones hay NA iones:
Nº de iones de Cl-
= Nº de iones Ag+
= 1,32·10-6
· 6,02·1023
= 7,98·1017
Nª iones Cl-
= 7,98·1017
(iones en 0,1L de disolución saturada de ClAg)
Nº iones Ag+
= 7,98·1017
(iones en 0,1L de disolución saturada de ClAg)](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-246-320.jpg)
![CATALUÑA / SEPTIEMBRE 98.COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE
4 / OPCION A/ PROBLEMA Nº 5.
www.profes.net es un servicio gratuito de Ediciones SM
5.A.- a) ¿Cuál es el valor de la constante de acidez del ácido benzoico si el pH de una
disolución 0,02 M de este ácido es 2,94?.
b) Calcular el pH de una disolución 0,01 M de benzoato sódico.
Solución:
a) Equilibrio de disociación del ácido benzoico:
C6H5-COOH + H2O D C6H5-COO-
+ H3O+
Concentración inicial 0,02 _ _
Se disocia: x _ _
Equilibrio: 0,02 – x x x
Como sabemos que K = [C6H5-COO-
]·[H3O+
] / [C6H5-COOH]
2,94 = x·x / (0,02 – x)
2,94 = x2
/ (0,02 – x)
x2
+ 2,94 x – 0,058 = 0
Resolviendo esta ecuación de segundo grado se obtienen los valores siguientes:
x1 = 0,019 M y x2 = - 2,9 M. Este último resultado no tiene sentido químico, ya que no podemos
tener una concentración negativa.
Por lo tanto x = [H3O+
] = 0,019 M
De donde pH = -log [H3O+
]
pH = -log (0,019)
pH = 1,7
b) Tenemos una disolución de benzoato sódico. Es una sal y se disocia totalmente:
C6H5-COONa → C6H5COO-
+ Na+
Conociendo la concentración inicial de la sal, sabemos por la estequiometría de la reacción que las
concentraciones de Na+
y de C6H5-COO-
son 0,01 M.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-247-320.jpg)
![CATALUÑA / SEPTIEMBRE 98.COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE
4 / OPCION A/ PROBLEMA Nº 5.
www.profes.net es un servicio gratuito de Ediciones SM
El ión benzoato en una base débil que proviene de un ácido supuestamente fuerte (ácido benzoico),
y no sufrirá hidrólisis. El ion Na+
es un ácido débil que proviene de una base fuerte NaOH, por lo
que tampoco sufrirá hidrólisis, de modo que el pH vendrá determinado por el producto iónico del
agua.
Kw =10-14
= [H3O+
]·[OH-
]
[H3O+
] =10-7
M
pH = -log 10-7
pH = 7 (neutro)
Nota .- Si, con todo rigor, suponemos que el ácido benzoíco no es realmente fuerte necesitaríamos
conocer el dato de la constante de ácidez para con ella deducir la constante de hidrólisis (Kh) y así
realizar los correspondientes cálculos del equilibrio de hidrólisis. Sin embargo, este dato no aparece
en el enunciado.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-248-320.jpg)
![CATALUÑA / SEPTIEMBRE 98.COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE
4 / PROBLEMA Nº 1 .
www.profes.net es un servicio gratuito de Ediciones SM
1.- En un recipiente de 2 L tenemos inicialmente una mezcla de 0,40 moles de N2, 1,10
moles de H2 y 0,50 moles de NH3. Cuando se alcanza el equilibrio la cantidad de amoniaco
es de 0,30 moles.
N2 (g) + 3 H2(g) D 2 NH3 (g) ∆H = -92,4 kJ
a) Calcular el valor de Kc a la temperatura que corresponda el equilibrio anterior.
b) Indique de forma razonada que modificará la cantidad de amoniaco en el equilibrio
anterior:
1. Una disminución de volumen del recipiente por compresión de la mezcla
2. Un aumento de la temperatura
Solución:
a) Equilibrio: N2 (g) + 3 H2 (g) D 2 NH3
n iniciales: 0,40 1,10 0,50
n reaccionan: x 3x -
n equilibrio: 0,40-x 1,10-3x 0,50+2x
Como en el equilibrio los moles de amoniaco son 0,30, se cumple que: 0,50 + 2x = 0,30
x = (0,30 - 0,50) / 2 = - 0,10 moles
Esta cantidad negativa indica que el equilibrio evoluciona de derecha a izquierda, es decir
disminuyendo la concentración de producto.
Aplicando la ley de acción de masas: K = [NH3]2
/ [N2][H2]3
K = (0,30/2)2
/ [(0,50/2) · (1,40/2)3
] = 1,049 (mol/l)-2
b) N2(g) + 3 H2 (g) D 2 NH3 (g) ∆H = -92,41 kJ Reacción exotérmica.
1- Una disminución de volumen por aumento de la presión, hace que el equilibrio se desplaze a la
derecha, es decir a la formación de amoniaco, ya que es donde hay menor número de moles
gaseosos
2- Un aumento de la temperatura al ser una reacción exotérmica hace que el equilibrio se desplaze a
la izquierda para consumir la energía calorífica suministrada.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-249-320.jpg)
![CATALUÑA / SEPTIEMBRE 98. COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE
6 / PROBLEMA Nº 1.
www.profes.net es un servicio gratuito de Ediciones SM
1.- Dada una disolución de amoniaco 0,5 M:
a) Calcular el pH y la molaridad de una disolución de hidróxido de sodio que tenga el
mismo pH.
b) Si se valoran con ácido clorhídrico volúmenes iguales de ambas disoluciones por
separado, explique razonadamente:
1) En qué caso se consumirá más ácido clorhídrico.
2) En cada caso, justifique si el pH en el punto de equivalencia será igual, más pequeño o
más grande que 7.
Datos: Kb (amoniaco) = 1,8·10-5
Solución:
a) Para saber la concentración y el pH de la disolución de NaOH, de forma que coincida con el pH
de una disolución de NH3 0,5M, primeramente calculamos el pH de la citada disolución de
amoniaco:
NH3 + H2O D NH4
+
+ OH-
Concentración inicial 0,5 - -
Se disocia: x - -
Se forma: - x x
Equilibrio: 0,5 – x x x
Aplicando la constante de basicidad a este equilibrio:
Kb = [NH4
+
]·[OH-
] / [NH3]
Kb = 1,8·10-5
= x·x / (0,5-x) = x2
/ (0,5-x)
1,8·10-5
· (0,5-x) = x2
x2
+ 1,8·10-5
x – 9·10-6
= 0
Resolviendo esta ecuación de segundo grado, se obtiene:
x = 6,58·10-6
M.
Entonces [OH-
] = 6,58·10-6
M
A partir del producto iónico del agua: Kw = [H3O+
][OH-
] = 10-14
10-14
= [H3O+
]· 6,58·10-6
[H3O+
] = 1,52·10-9
M
pH = -log [H3O+
] = - log (1,52·10-9
) = 8,8.
Si queremos una disolución de pH = 8,8 de NaOH, como esta base es fuerte, sabemos que en
disolución acuosa se disocia completamente, dando lugar a:
NaOH → Na+
+ OH-
Por lo tanto el pH de esta disolución será pH = 8,8 cuando la concentración de iones OH-
coincida con la calculada para la disolución de amoniaco [OH-
] = 6,58·10-6
M, de modo que](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-250-320.jpg)
![CATALUÑA / SEPTIEMBRE 98. COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE
6 / PROBLEMA Nº 1.
www.profes.net es un servicio gratuito de Ediciones SM
al ser una base totalmente disociada, la concentración de la disolución de NaOH coincidirá
con esta última.
[NaOH] = 6,58·10-6
M
b) Valoraciones con HCl
1- Reacción de valoración del amoniaco con HCl
NH3 + HCl D NH4
+
+ Cl-
Reacción de valoración del hidróxido sódico con HCl
NaOH + HCl → NaCl + H2O
El ácido clorhídrico valorante en los dos casos es un ácido fuerte.
Igualando el nº de equivalentes de ácido y base en las valoraciónes resulta:
Sabemos que tanto para el NH3, como para NaOH y como para HCl M = N
N·V = N’ (HCl) · V’(HCl)
Suponemos V(amoniaco) = V(sosa)
0,5 · V(amoniaco) = N’ · V’ 0,5 / 6,58·10-6
= V’ / V’’ 775987,8 = V’ / V’’
por lo tanto V’ >> V’’
6,58·10-6
· V(sosa) = N’· V’’
Es decir el volumen de ácido empleado en la valoración del amoniaco es mucho mayor que el
empleado en la valoración del hidróxido sódico.
2 – Reacción de valoración del amoniaco:
NH3 + HCl D NH4
+
+ Cl-
Es una valoración de una base débil con un ácido fuerte, por lo tanto, el pH final < 7
Reacción de valoración de la sosa:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-251-320.jpg)

![CATALUÑA / SEPTIEMBRE 98. COU / QUIMICA / CINETICA Y EQUILIBRIO SERIE
6 / PROBLEMA Nª 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- La solubilidad del bromuro de plomo (II) en agua a 25ºC es de 4,29 g/dm3
.
a) Calcular el producto de solubilidad de la sal mencionada.
b) Indicar si se formará precipitado de bromuro de plomo cuando se añaden 5 cm3
de
disolución de nitrato de plomo (II) 0,01 M a 5 cm3
de disolución 0,001 M de bromuro de
potasio.
Datos: masas atómicas: Br = 80; Pb = 207.
Solución:
a) Equilibrio de solubilidad: PbBr2 (s) D Pb2+
+ 2 Br –
S 2S
Aplicando la constante de solubilidad Ks = [Pb2+
] · [Br -
]2
= S · (2S)2
= 4·S3
Conocemos S = 4,29 g/dm3
, y la pasamos las unidades a mol/L:
(1dm3
= 1 L)
S = 4,29 / 376 = 0,0122 mol/L
Sustituyendo el valor obtenido en la ecuación de la constante o producto de solubilidad, llegamos a:
Ks = 4 · (0,0122)3
= 7,32·10-6
b) Tenemos: 5 cm3
de Pb(NO3)2 cuya concentración es 0,01M
5 cm3
de KBr cuya concentración es 0,001M.
Son dos sales solubles, y que, por tanto, en disolución acuosa se disocian completamente:
Pb(NO3)2 → Pb2+
+ 2 NO3
-
KBr → K+
+ Br –
nº de moles = M · V
nº de moles iniciales de Pb(NO3)2 = nº moles finales de Pb2+
= 0,01 · 0,05 = 5·10-4
moles
nº de moles iniciales de KBr = nº de moles finales de Br -
= 0,001 · 0,05 = 5·10-5
moles](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-253-320.jpg)
![CATALUÑA / SEPTIEMBRE 98. COU / QUIMICA / CINETICA Y EQUILIBRIO SERIE
6 / PROBLEMA Nª 3
www.profes.net es un servicio gratuito de Ediciones SM
Así, tendremos estas concentraciones finales de cada ión del posible precipitado:
[Pb2+
] = 5·10-4
/ (0,05 + 0,05) = 5·10-4
/ 0,1 = 5·10-3
M
[Br -
] = 5·10-5
/ (0,05 + 0,05) = 5·10-5
/ 0,1 = 5·10-4
M
Para que se forme precipitado el producto iónico Q = [Pb2+
]·[Br -
]2
tiene que ser mayor que el
valor de Ks = 7,32·10-6
Q = 5·10-3
· (5·10-4
)2
= 1,25·10-9
Como en este caso Q < Ks no se formará precipitado de la sal PbBr2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-254-320.jpg)
![CATALUÑA / SEPTIEMBRE 99.LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
SERIE 2 / OPCION A / Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- A 280K la solubilidad del hidróxido de zinc es de 1,64 mg/dm3
. ¿Cuál será el valor de
KPS de este hidróxido a la temperatura indicada?.
Datos: masas atómicas: Zn = 63,5; O = 16; H = 1.
Solución:
Solubilidad del hidróxido de zinc S = 1,64 mg/ dm3
Para resolver el problema necesitamos la solubilidad en moles/ L, por lo tanto:
S = 1,64 mg / dm3
· 1g / 1000 mg · 1mol / 97 g · 1 L / dm3
= 1,69 · 10-5
mol / L
Equilibrio de solubilidad del hidróxido de zinc:
Zn(OH)2 D Zn+2
+ 2 OH-
S 2S
Producto de solubilidad : Kps = [Zn+2
] · [OH-
]2
= S · ( 2S )2
= 4 · S3
Kps = 4 · (1,69 · 10-5
)3
= 1,93 · 10-14](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-255-320.jpg)
![CATALUÑA / SEPTIEMBRE 99.LOGSE / QUIMICA / ESTEQUIOMETRIA /
SERIE 2 / Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Se desea neutralizar 500 cm3
de KOH de pH =12 con una disolución de ácido
clorhídrico 0,05 M.
a) Indicar el volumen de ácido que será necesario.
b) Dibujar los elementos que serían necesarios, y explicar el procedimiento que se
seguiría para la neutralización en el laboratorio.
Solución:
a) Reacción de neutralización: KOH + HCl KCl + H2O
En una neutralización, el número de equivalentes de ácido tiene que ser igual al número de
equivalentes de base:
Nácido · Vácido = Nbase · Vbase
El hidróxido potásico es una base fuerte, se disocia completamente: KOH K+
+ OH-
De modo que la concentración de iones OH-
es la misma que la concentración se KOH, por lo
tanto como sabemos que el pH = 12, por el producto de ionización del agua calculamos la
concentración de OH-
:
Kw = 10-14
= [H3O+
] · [OH-
]
10-14
= 10-12
· [OH-
]; [OH-
] = 10-14
/ 10-12
= 10-2
Por lo tanto [KOH] = 0,01M
NHCl = MHCl · valencia = 0,05 · 1 = 0,05 eq/L
NKOH = MKOH · valencia = 0,01 · 1 = 0,01 eq/L
Volviendo a la ecuación de neutralización: NHCl · VHCl = NKOH · VKOH
0,05 eq/L · VHCl = 0,01 eq/L · 0,5 L
VHCl = 0,01 · 0,5 / 0,05 = 0,1 L = 100 mL
b) Para realizar una neutralización en el laboratorio, los elementos necesarios son:
Erlenmeyer : matraz de cuello estrecho que contiene generalmente la sustancia a valorar más
un indicador apropiado.
Bureta: Es como una pipeta graduada, más grande, y que tiene un sistema de salida del
contenido, que se controla con una llave. Generalmente contiene el valorante o disolución
patrón, de concentración perfectamente conocida.
Pie con soporte: para sujetar la bureta.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-256-320.jpg)

![CATALUÑA / SEPTIEMBRE 99. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
SERIE 5 /OPCION A / Nª 6
www.profes.net es un servicio gratuito de Ediciones SM
6.- Calcular el número total de iones que hay en 1 cm3
de una disolución saturada de
hidróxido de cadmio a 25ºC.
Datos: Ks (hidróxido de cadmio) a 25ºC = 1,2·10-14
; NA = 6,023·1023
Solución:
Equilibrio de solubilidad del Cd(OH)2:
Cd(OH)2 D Cd2+
+ 2 OH-
S 2S
Ks = [Cd2+
] · [OH-
]2
= S · (2S)2
= 4 S3
De donde S = (Ks / 4)1/3
, sustituyendo en esta ecuación el valor de Ks
S = (1,2·10-14
/ 4 )1/3
= 1,44·10-5
mol/L
En 1 cm3
= 0,001 L , el número de iones será:
Nº de moles de iones Cd2+
= 1,44·10-5
mol/L · 0,001 L = 1,44·10-8
moles de iones Cd2+
Nº de moles de iones OH-
= 2·1,44·10-5
mol/L · 0,001L = 2,88·10-8
moles de iones OH-
Como en un mol de iones hay NA iones:
Nº de iones Cd2+
= 1,44·10-8
· 6,023·1023
= 8,67·1015
iones Cd2+
Nº de iones OH-
= 2,88·10-8
· 6,023·1023
= 1,73·1016
iones OH-](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-258-320.jpg)
![CATALUÑA / SEPTIEMBRE 99. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
SERIE 5 / Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- a) Calcular el pH de la disolución obtenida al mezclar 250 mL de una disolución de
hidróxido sódico 0,5M con 300 mL de una disolución de ácido sulfúrico 0,2M.
(supónganse volúmenes aditivos).
b) Indicar razonadamente que haría para neutralizar la disolución.
c) En los envases de hidróxido sódico se observan las etiquetas de seguridad siguientes:
Indicar su significado.
Solución:
a) Si mezclamos 250 mL de NaOH 0,5 M y 300 mL de H2SO4 0,2 M, al variar el volumen, las
concentraciones también van a variar, lo que no varía es el número de moles de cada sustancia.
Calculamos el número de moles de cada uno.
moles de NaOH = M · V = 0,5 · 0,25 = 0,125 moles
moles de H2SO4 = M · V = 0,2 · 0,3 = 0,06 moles
V total = 0,3 + 0,25 = 0,55 L
Tanto el hidróxido sódico como el ácido sulfúrico se disocian totalmente ya que son base y
ácido fuertes respectivamente.
Equilibrios de disociación:
NaOH → Na+
+ OH-
Moles iniciales 0,125 _ _
Equilibrio _ 0,125 0,125
Por lo tanto la concentración de [OH-
] = 0,125 / 0,55 = 0,227 M
H2SO4 → 2 H+
+ SO4
-
Moles iniciales: 0,06 _ _
Equilibrio _ 0,12 0,06
Por lo tanto la concentración de [H3O+
] = 0,12 / 0,55 = 0,218 M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-259-320.jpg)
![CATALUÑA / SEPTIEMBRE 99. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
SERIE 5 / Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
Reaccionarán los iones OH-
que provienen del hidróxido sódico y los iones H3O+
que
provienen del ácido sulfúrico.
OH-
+ H3O+
D H2O
Concentración inicial: 0,227 0,218
Como la constante de esta reacción es la inversa de la constante del producto de ionización del
agua que tiene un valor de Kw = 10-14
, tendremos:
K = 1014
Esta constante es muy grande, lo que significa que el equilibrio está totalmente desplazado a la
derecha, de forma que la reacción se produce hasta que se agota alguno de los reactivos. La
estequiometría de la reacción es 1:1, por lo tanto el reactivo limitante es H3O+
, quedando:
OH-
+ H3O+
D H2O
Concentración inicial: 0,227 0,218
Equilibrio: 9·10-3
_
El pH viene determinado por la concentración de iones hidroxilo. Sabiendo que
Kw = 10-14
= [OH-
] · [H3O+
]
10-14
= 9·10-3
· [H3O+
]
[H3O+
] = 10-14
/ 9·10-3
= 1,11·10-11
M
pH = -log [H3O+
] = -log ( 1,11·10-11
) = 10,95.
b) Para neutralizar la solución, se podría añadir ácido, ya que es una disolución básica.
Tendria que ser un ácido fuerte concentrado con un indicador apropiado.
c) Etiqueta A: Producto corrosivo para la piel.
Etiqueta B: Producto nócivo para la salud..](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-260-320.jpg)
![CATALUÑA / SEPTIEMBRE 99.COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE
4 / OPCION A / Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- El kps del fluoruro de magnesio es 6,24 · 10-9
.
a) Determine cuántos gramos de fluoruro de magnesio se han disuelto en 1L de una
disolución saturada de esta sal.
b) ¿Precipitará fluoruro de magnesio si se mezclan 200 cm3
de una disolución 4 · 10-4
M de
fluoruro potásico con 300 cm3
de una disolución 2 · 10-3
M de cloruro de magnesio?.
Datos: masas atómicas Mg = 24,3; F = 19.
Solución:
a) Equilibrio de solubilidad de la sal: MgF2 D Mg2+
+ 2 F-
S 2S
El producto de solubilidad es kps = S (2S)2
= 4S3
6,24·10-9
= 4S3
Despejando: S = ( 6,24·10-9
/ 4 )1/3
= 1,16·10-3
mol/L
En 1L se han disuelto 1,16·10-3
moles de MgF2, luego sabiendo que la masa molecular
del fluoruro de magnesio es 62,3 g/mol
m (g) = moles · Pm = 1,16·10-3
· 62,3 = 0,072 g (se han disuelto en 1L)
b) Para que precipite fluoruro de magnesio es necesario que el producto iónico
Q = [Mg2+
][F-
]2
sea mayor que el valor de kps = 6,24·10-9
Se realiza el cálculo de las concentraciones iónicas.
El volumen es aditivo de modo que:
V = 200 cm3
+ 300cm3
= 0,2 L + 0,3 L = 0,5 L
[KF] = 4·10-4
M ; V = 200cm3
= 0,2 L
moles de KF = M · V = 4·10-4
· 0,2 = 8·10-5
moles
Como KF es una sal y se disocia totalmente (KF " K+
+ F-
), tendremos :
Moles de F-
= 8·10-5
moles](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-261-320.jpg)
![CATALUÑA / SEPTIEMBRE 99.COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE
4 / OPCION A / Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
[F-
] = moles / V = 8·10-5
/ 0,5 = 1,6·10-4
M
En cuanto a la otra sal tenemos:
[MgCl2] = 2·10-3
M; V = 300cm3
= 0,3 L
moles de MgCl2 = M · V = 2·10-3
· 0,3 = 6·10-4
moles
Como MgCl2 es una sal y se disuelve totalmente (MgCl2 " Mg2+
+ 2 Cl-
) tendremos:
Moles de Mg2+
= 6·10-4
moles
[Mg2+
] = moles / V = 6·10-4
/ 0,5 =1,2·10-3
M
Por lo tanto Q = [Mg2+
][F-
]2
= 1,2·10-3
· (1,6·10-4
)2
= 3,07·10-11
Como Q < kps no se formará precipitado.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-262-320.jpg)
![CATALUÑA / SEPTIEMBRE 99.COU / QUIMICA / CINETICA Y EQUILIBRIO / SERIE
6 / Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Un sistema en equilibrio está formado por una disolución que contiene iones Mg+2
, F-
y
OH-
en contacto con hidróxido de magnesio sólido y fluoruro de magnesio sólido. Las
concentraciones son:
[Mg+2
] = 2,70·10-3
mol/dm3
; [F-
] = 1,54·10-3
mol/dm3
; [OH-
] = 7,45·10-5
mol/dm3
a) Determine el producto de solubilidad del hidróxido de magnesio y del fluoruro de
magnesio.
b) Si se añade un ácido fuerte a la disolución, justifique cualitativamente que precipitado se
redisolverá.
Solución:
a) Equilibrio de solubilidad del hidróxido de magnesio.
Mg (OH)2 (s) D Mg2+
+ 2 OH-
S 2S
Ks = [Mg2+
] · [OH-
]2
= S· (2S)2
= 4S3
[OH-
] = 2S
S = (7,45 · 10-5
) / 2 = 3,725·10-5
mol / L
Ks = 4 · S3
Ks = 4 · (3,725·10-5
)3
= 2,06·10-13
Equilibrio de solubilidad del fluoruro de magnesio:
MgF2 (s) D Mg2+
+ 2F-
S 2S
Ks = [Mg2+
] · [F-
]2
= S · (2S)2
= 4S3
[F-
] = 2S
S = (1,54·10-3
) / 2 = 7,7·10-4
mol / L
Ks = 4 · S3
Ks = 4 · (7,7·10-4
)3
= 1,82·10-9
b) Cuando tenemos los equilibrios del hidróxido de magnesio y del fluoruro de magnesio, en
disolución se encuentran, además de los iones Mg2+
, iones OH-
y F-
.
De modo que al añadir un ácido (H+
), los aniones anteriores reaccionarán con los protones del ácido
desplazando el equilibrio de solubilidad hacia la derecha, por disminución de la concentración del
anion.
Ahora bien, OH-
y F-
, son dos aniones distintos, por lo tanto no reaccionan a la vez con los
protones:
El OH-
es una base fuerte (proviene del H2O, anfótera)
El F-
es una base débil (proviene del HF, ácido fuerte)
El anión que reaccionará primero con los protones del ácido será el OH-
(formando agua), por ser
base más fuerte.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-263-320.jpg)



![CATALUÑA / JUNIO98.LOGSE / QUIMICA / CINÉTICA Y EQUILIBRIO / OPCION A
/ Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.-Una solución 10-4
M de hidróxido de sodio tiene el mismo pH que una solución de
hipoclorito de sodio.
a) Indique el valor del pH resultante.
b) Calcule la concentración de la solución de hipoclorito de sodio.
Datos: Ka(HClO) = 3,5·10-8
Solución:
a) El hidróxido sódico es una base muy fuerte que se disocia totalmente en disolución acuosa:
NaOH à Na+
+ OH-
[OH-
] = 10-4
M
pOH = -log [OH-
] = -log (10-4
) = 4
pH = 14 - pOH = 14 - 4 = 10
b) Esta sal es soluble y por ello totalmente disociada en agua:
NaClO à Na+
+ ClO-
El ión ClO-
, procedente de un ácido débil, experimentará hidrólisis.
Equilibrio de hidrólisis: ClO-
+ H2O çè HClO + OH-
co x
ceq x-10-4
10-4
10-4
La concentración de ión OH-
suministrada por la hidrólisis será igual que la que proporciona la
disolución de sosa NaOH 10-4
M. Es decir el pH será el mismo.
Kh
[HClO ]⋅[OH−
]
[ClO
−
]
=
Kw
Ka
=
10−14
3,5 ⋅10
−8 = 2,86 ⋅10
−7
2,86 ⋅10
−7
=
10−4
⋅10−4
x −10
−4 ≈
10−8
x
(Se hace esta aproximación: x-10-4
≈x )
x = 0,035 M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-267-320.jpg)
![CATALUÑA / JUNIO98.LOGSE / QUIMICA / CINÉTICA Y EQUILIBRIO / OPCION A
/ Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
Como consecuencia: [ClO-
] = [NaClO] = 0,035 M
Se han despreciado los iones oxhidrilo procedentes de la autoionización del agua.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-268-320.jpg)

![MADRID /JUNIO 04. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO/PROBLEMA
B 1
equilibrio x/2 moles de H2 (g) y x/2 moles de I2 (g). Todo esto lo podemos resumir
en una tabla:
IH H2 I2
Nº de moles iniciales 0,6 - -
Nº de moles en el
equilibrio
0,6-X moles X/2 moles X/2 moles
Concentración en el
equilibrio
(0,6-X)/1
moles/litro
X/2
moles/litro
X/2 moles/litro
Para calcular X utilizamos la expresión de Kc.
[ ][ ]
[ ] ( )
2 2
2 2
·
2 2
0,0156
0,6
c
X X
H I
K
XIH
⎛ ⎞ ⎛ ⎞
⎜ ⎟ ⎜ ⎟
⎝ ⎠ ⎝ ⎠= = =
−
Resolviendo nos queda una ecuación de segundo grado en X, cuya solución es X = 0,12
moles. Por tanto las concentraciones de las especies en el equilibrio son:
[ ]
[ ]
[ ]
2
2
(0,6 )
(0,6 0,12) 0,48 /
1
0,122 0,06 /
1 2 2
0,122 0,06 /
1 2 2
X
IH moles litro
Litro
X
X
H moles litro
litro
X
X
I moles litro
litro
−
= = − =
= = = =
= = = =
c) Para calcular la presión total en el equilibrio, utilizaremos la ecuación de los gases
perfectos y el número de moles de todas las sustancias en el equilibrio.
TP (1L)=(0,48+0,12+0,12)(0,082atm·L/ºK·mol)(400+273,15)
PV nRT=
Despejando PT = 33,12 atm.
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-270-320.jpg)
![COMUNIDAD DE MADRID /SEPTIEMBRE 2004. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / CUESTIÓN 1
1.- La reacción de obtención de polietileno a partir de eteno,
n CH2=CH2 (g) ⇄ [-CH2CH2-]n (s), es exotérmica.
a) Escriba la expresión de la constante de equilibrio, Kp.
b) ¿Qué tipo de reacción de polimerización se produce?
c) ¿Cómo afecta un aumento de la temperatura a la obtención de polietileno?
d) ¿Cómo afecta un aumento de la presión total del sistema a la obtención de
polietileno?
SOLUCIÓN CUESTIÓN 1:
a)
( )
( )
2 2
2 2
(-CH CH )
p
CH =CH
P
K =
P
n
n
−
; como el polímero es un sólido y su presión es constante, esta se
engloba en la constante de equilibrio de forma que la expresión de K’
p es:
2 2
'
p
CH =CH
1
K
(P )n
=
b) Es una reacción de polimerización por adición a un doble enlace.
c) Una variación de la temperatura modifica la constante de equilibrio por que está definida
para una temperatura determinada. Por otro lado, por el principio de Le Chatelier, un aumento
de la temperatura desplazará el equilibrio hacia donde la reacción sea endotérmica; por lo
tanto, se desplazará hacia la izquierda.
d) Por el principio de Le Chatelier, un aumento de presión desplazará el equilibrio hacia
donde hay un menor número de moles; por lo tanto, se desplazará hacia la derecha.
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-271-320.jpg)
![COMUNIDAD DE MADRID /SEPTIEMBRE 2004. LOGSE / QUÍMICA /CINÉTICA Y
EQUILIBRIO / CUESTIÓN 3
3.- La reacción en fase gaseosa A + B → C + D es endotérmica y su ecuación cinética es:
v = k [A]2
. Justifique si las siguientes afirmaciones son verdaderas o falsas:
a) El reactivo A se consume más deprisa que el B.
b) Un aumento de presión total produce un aumento de la velocidad de la reacción.
c) Una vez iniciada la reacción, la velocidad de reacción es constante si la temperatura
no varía.
d) Por ser endotérmica, un aumento de temperatura disminuye la velocidad de reacción.
SOLUCIÓN CUESTIÓN 3
a) Falsa. La velocidad de desaparición de A y B es:
[ ] [ ]A B1 1
v
d d
a dt b dt
= − = − ,
La estequiometría ente A y B es de 1mol A : 1mol B, por lo que a = b y la velocidad
de desaparición es la misma.
b) Verdadera. Un aumento de la presión incrementa el número de choques efectivos entre
las moléculas.
c) Falsa. Eso sólo ocurre en las reacciones de orden cero y la expresión de la velocidad
de reacción indica que esta es una reacción de orden 2 con respecto al reactivo A.
Debido a ello, a medida que desaparece A, la velocidad de reacción disminuye y es, la
tangente a cada instante, de la curva de la variación de la concentración de A con
respecto al tiempo.
d) Falsa. Un aumento de temperatura produce un fuerte incremento de la proporción de
moléculas con energías elevada. Como la velocidad ( [ ]
2
v AK= ) depende de la
constante de reacción y K depende de la temperatura ( ), se observa que
un incremento de la temperatura aumenta notablemente la velocidad de reacción. De
forma aproximada se puede decir que al aumentar 10 grados la temperatura, la
velocidad de reacción se duplica.
/aE RT
K Ae−
=
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-272-320.jpg)
![COMUNIDAD DE MADRID /SEP 2004. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / PROBLEMA 2/OPCIÓN A
OPCIÓN A
Problema 2.- En un reactor de 1 L, a temperatura constante, se establece el equilibrio:
NO2 + SO2 ⇄ NO + SO3, siendo las concentraciones molares en el equilibrio:
[NO2]=0,2, [SO2]=0,6, [NO]=4,0, [SO3]=1,2.
a) Calcular el valor de la Kc. a esa temperatura
b) Si se añaden 0,4 moles de NO2 ¿Cuál será la nueva concentración de reactivos y
productos cuando se reestablezca de nuevo el equilibrio?
SOLUCIÓN PROBLEMA 2 (OPCIÓN A)
(a) Para el equilibrio NO2 + SO ⇄ NO + SO3 la constante Kc vale:
[ ][ ]
[ ][ ]
3
2 2
(1,2)·(4)
40
(0,2)·(0,6)
c
SO NO
K
NO SO
= = = (Sin dimensiones)
(b) Una vez que se establece el equilibrio se añaden 0,4 moles de NO2, el sistema evoluciona
y las nuevas concentraciones en el equilibrio serán:
NO2 SO NO SO3
Moles iniciales O,2 + 0,4 0,6 4 1,2
Moles equilibrio 0,6 – X 0,6 -X 4 + X 1,2 + X
Utilizando la constante de equilibrio:
[ ][ ]
[ ][ ]
3
2 2
(1,2 )·(4 )
40
(0,6 )·(0,6 )
c
SO NO X X
K
NO SO X X
+ +
= =
− −
=
Resolviendo se obtiene una ecuación de segundo grado en X que tiene dos soluciones X1 =
1,15 y X2 = 0,21, como no pueden reaccionar más moles de los que hay inicialmente, la
solución es X = 0,21.
Por tanto, las concentraciones en el nuevo equilibrio que se obtiene al añadir 0,4 moles de
NO2 son:
NO2 SO NO SO3
Moles equilibrio 0,39 0,39 4,21 1,41
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-273-320.jpg)






![MADRID/ JUNIO 06 LOGSE/ QUÍMICA / CINÉTICA Y EQUILIBRIO/ OPCIÓN B /
PROBLEMA 1
SEGUNDA PARTE
OPCIÓN B
Problema 1.- En un recipiente de 0,4 L se introduce 1 mol de N2 y 3 mol de H2 a la temperatura de
780 K.
Cuando se establece el equilibrio para la reacción N2 + 3 H2 ← 2 NH3, se tiene una mezcla con un
28% en mol de NH3. Determine:
a) El número de moles de cada componente en el equilibrio.
b) La presión final del sistema.
c) El valor de la constante de equilibrio, Kp.
Datos.- R = 0,082 atm·L·K-1
·mol-1
Puntuación máxima por apartado: a) y c) 0,75 puntos y b) 0,5 puntos.
SOLUCIÓN:
Problema 1
Apartado a)
Calculamos en primer lugar las concentraciones iniciales de los reactivos:
[ ] ( )
5'2
4'0
1
V
Nn
N 2i
i2 === mol/L
[ ] ( )
5'7
4'0
3
V
Hn
H 2i
i2 === mol/L
Establecemos la ecuación del equilibrio propuesto, y la tabla que nos permite relacionar las moles iniciales
y las moles una vez alcanzado el estado de equilibrio:
N2 + 3H2 ↔ 2NH3
Moles Iniciales 1 3 0
Moles en el equilibrio 1-x 3-3x 2x
(llamamos x a las moles de nitrógeno, N2, que se consumen hasta que se alcanza el estado de equilibrio).
Nos dicen que cuando se alcanza el estado de equilibrio las moles de amoniaco representan un 28% de las
moles totales. Los moles totales en nuestro equilibrio son: (1-x)+(3-3x)+2x = 4-2x , por tanto podemos
establecer la relación:
33 xmolesNH2
esmolestotal)x24(
molesNH28
esmolestotal100 −
=
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-280-320.jpg)




![MADRID / SEPTIEMBRE 06 LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO/
CUESTION 3
PRIMERA PARTE
Cuestión 3
Cuestión 3. El amoniaco reacciona a 298 K con oxígeno molecular y se oxida a monóxido de
nitrógeno y agua, siendo su entalpía de reacción negativa.
a) Formule la ecuación química correspondiente con coeficientes estequiométricos enteros.
b) Escriba la expresión de la constante de equilibrio, Kp.
c) Razona cómo se modificará el equilibrio al aumentar la presión total a 298 K si son todos los
compuestos gaseosos a excepción del H2O que se encuentra en estado líquido.
d) Explique razonadamente cómo se podría aumentar el valor de la constante de equilibrio.
Puntuación máxima por apartado: 0’5 puntos.
SOLUCIÓN:
Apartado a)
La reacción, ajustada con coefiecientes enteros es: 3 2 24NH (g) 5O (g) 4NO(g) 6H O(l)+ +
Apartado b)
[ ]
[ ] [ ]
4
eq
c 4 5
3 2eq eq
NO
K
NH O
=
⋅
Apartado c)
Al aumentar la presión total, el equilibrio, según el principio de Le Chatelier tenderá a contrarrestar este
efecto, es decir, tenderá a desplazarse hacia el sentido que haga disminuir la presión total, concretamente,
hacia donde existan menos moles gaseosas.
En este caso hay menos moles gaseosas en los productos (4 moles de gases) que en los reactivos (9 moles
de gases).
Por lo tanto el equilibrio se desplazará hacia los productos.
Apartado d)
El valor de la constante de equilibrio únicamente se puede modificar si cambia la temperatura.
Concretamente para que el valor de la constante aumente, la temperatura debe aumentar.
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-285-320.jpg)
![MADRID / SEPTIEMBRE 06 LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO/ OPCIÓN
B/ PROBLEMA 2
SEGUNDA PARTE
OPCIÓN B
Problema 2. Una disolución contiene 0’376 gramos de fenol (C6H5OH) por cada 100 mL. Sabiendo
que el fenol se puede comportar como ácido débil monoprótico y que su valor de Ka es 1’0·10-10
calcule:
a) Las concentraciones finales de fenol y fenolato presentes en la disolución, así como el pH y el
porcentaje de ionización del fenol.
b) El volumen de disolución de hidróxido de sodio 0’2 M que se necesitaría para valorar
(neutralizar) 25 mL de disolución de fenol.
Datos: Masas atómicas: H = 1, C = 12, O =16
Puntuación máxima por apartado: 1’0 puntos.
SOLUCIÓN:
Apartado a)
Calculamos la concentración inicial, en moles/litro, de fenol:
mol/g9411651126)OHHC(M 56r =++⋅+⋅= ;
004'0
94
376'0
Mr
m
)OHHC(n 56i === moles
[ ] 04'0
100'0
004'0
V
n
OHHC i
i56 === mol/L
Establecemos la ecuación del equilibrio de acidez del , y la tabla que nos permite relacionar las
concentraciones iniciales y las concentraciones una vez alcanzado el estado de equilibrio:
OHHC 56
OHHC 56 (aq) + OH2 (aq) ↔ −
OHC 56 (aq) + +
OH3 (aq)
Conc. Iniciales (mol/L) 0’04 _______ 0 0
Conc. en el equilibrio
(mol/L)
0’04-x _______ x x
(llamamos x a la concentración de fenol que se consume hasta que se alcanza el estado de equilibrio).
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-286-320.jpg)
![MADRID / SEPTIEMBRE 06 LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO/ OPCIÓN
B/ PROBLEMA 2
Aplicamos ahora la ecuación de la constante de acidez del fenol, que es la constante que corresponde al
equilibrio planteado:
[ ] [ ]
[ ]eq
eq56eq3
56a
OHCOH
)OHHC(K
OH
5
H
6
C
−+
⋅
= (1)
Sustituyendo en (1) el valor de Ka (enunciado) y el de las concentraciones en el equilibrio (tabla de
equilibrio), obtenemos una ecuación que nos permite calcular el valor de x:
x04´0
x
x04´0
xx
101
2
10
−
=
−
⋅
=⋅ −
( ) 210
xx04´0101 =−⋅⋅ −
; ;21012
xx101104 =⋅−⋅ −−
0104x101x 12102
=⋅−⋅+ −−
L/mol102x 6−
⋅=
(La otra solución de la ecuación es negativa, y por tanto, no es válida en este caso)
Conocido ya el valor de x, podemos calcular el valor de la concentración de fenol y fenolato presentes en
el estado de equilibrio:
[ ] 03999'0x04´0OHH eq5 =−=6C mol/L ; [ ] ==− x
eq
COO
5
H
6
C 6
102 −
⋅ mol/L
El valor del pH de la disolución será: logpH −= [ ]eq3OH +
[ ] ==+
xeqOH3
6
102 −
⋅ mol/L
logpH −= [ ] logOH eq3 −=+
7,5102 6
=⋅ −
Es un pH ácido (<7) como era de esperar.
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-287-320.jpg)

![MADRID / JUNIO 00. LOGSE / QUIMICA / CINETICA Y EQUILIBRIO / OPCIÓN A /
PROBLEMA 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- El N2O4 gas se descompone parcialmente a 45ºC para dar NO2 gas. En un recipiente
vacío, de un litro de capacidad, a 45ºC se introducen 0,1 moles de N2O4 alcanzándose el
en equilibrio una presión de 3,18 atmósferas. Calcule:
a) Las constantes de equilibrio en función de las presiones y de las concentraciones.
b) El grado de disociación del N2O4.
Datos: R = 0,082 atm·L / K·mol
Puntuación máxima por apartado: 1,25 a) y 0,75 b).
Solución:
Reacción de descomposición: N2O4 D 2 NO2
Inicialmente 0,1 ---
Se disocia 0,1α ---
Equilibrio 0,1 (1-α) 0,2α
Contestaremos los apartados en orden inverso, pues parece más lógico.
b) Podemos conocer el número total de moles en el equilibrio a partir de la presión total:
P · V = n · R · T, de donde
n = (P · V) / (R · T) = (3,18 · 1) / ( 0,082 · 318) = 0,12
En el equilibrio hemos visto, ya que el volumen de la disolución es 1 L, que:
nT = 0,1·(1-α) + 0,2α = 0,1·(1+ α)
Igualando con el cálculo anterior:
0,1·(1+α) = 0,12, de donde despejamos el grado de disociación:
α = 0,02 / 0,1 = 0,219
Es decir se ha disociado el 21,9 %.
a) Una vez conocido el grado de disociación podemos conocer las concentraciones de cada
especie en el equilibrio, y con ellas la constante de equilibrio en función de las
concentraciones
Kc = [NO2]2
/ [N2O4] = (0,2 α)2
/ (0,1-0,1α)
Kc = (0,2 · 0,219)2
/ 0,08 = 0,0016 / 0,08 = 2,4·10-2
mol/L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-289-320.jpg)

![MADRID / JUNIO 2000. COU / QUIMICA / CINETICA Y EQUILIBRIO / OPCION A
/ PREGUNTA OBLIGATORIA / EJERCICIO 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- El producto de solubilidad de una base M(OH)2 es 4·10-12
. Determine el volumen de
un ácido HA (Ka = 1·10-6
), de concentración 1 M, que se necesita para valorar 100 mL de
la disolución saturada de la base.
Solución:
En una valoración ácido-base, el punto de equivalencia se alcanza al igualarse el número de
equivalentes de ácido y base.
La base es un hidróxido cuyo equilibrio de solubilidad es: M(OH)2 • M2+
+ 2 OH-
S 2S
Como Ks = [M2+
] · [OH-
]2
= S· (2S)2
= 4 · S3
1 · 10-6
= 4 · S3
S = ( 1 · 10-6
/ 4 )1/3
S = 10-4
M
Por lo tanto [OH-
] = 2·10-4
M
El nº de equivalentes de la base es 2·10-4
equivalentes, por lo que son necesarios estos
mismos equivalentes de base ácido para la neutralización:
Equilibrio de disociación del ácido: HA • H+
+ A-
Inicialmente (mol/L) 1 - -
En el equilibrio: 1-x x x
Ka = [H+
] · [A-
] / [HA]
1·10-6
= x2
/ 1-x
x2
+ 1·10-6
x – 1·10-6
= 0
Resolviendo la ecuación de segundo grado se obtiene que x = 9,99 · 10-4
M
Teniendo en cuenta que la valencia del ácido es 1, el nº de equivalentes coincide con el nº de
moles.
Entonces si en una disolución del ácido 1 M se tienen 9,99·10-4
moles en 1 L, se puede decir
que en 1 L hay 9,99·10-4
equivalentes de ácido, de manera que como para la valoración se
necesitan 2·10-4
equivalentes, el volumen de ácido requerido será:
2·10-4
/ 9,99·10-2
= 0,2 L
V (HA) = 200 mL de ácido 1 M son necesarios para la neutralización.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-291-320.jpg)

![MADRID / JUNIO 2000. COU / QUIMICA / CINETICA Y EQUILIBRIO /
PREGUNTA OPTATIVA / OPCION A / EJERCICIO 1
www.profes.net es un servicio gratuito de Ediciones SM
Por lo que el pH vendrá determinado por la concentración de iones H+
que quedan sin
reaccionar.
[H+
] = nº de moles / V (L) disolución = 1·10-4
/ 0,01 = 0,01 mol/L
pH = -log [H+
] = -log (0,01) = 2
pH (de la disolución indicada) = 2
b) 10 mL de disolución de HNO3 0,4 M + 0,28 g de KOH
El ácido nítrico es también un ácido fuerte por lo que se disociará totalmente.
Cálculo del número de moles de cada sustancia:
Moles de HNO3 = Molaridad · Volumen = 0,4 · 0,01 = 4·10-3
moles
Moles de KOH = m(g) / Pm = 0,28 / 56 = 5·10-3
Como en el apartado anterior, al ser ácido y base fuerte y disociarse totalmente, el número de
moles de iones coincide con el número de moles iniciales de cada sustancia.
HNO3 → H+
+ NO3
-
KOH → K+
+ OH-
4·10-3
5·10-3
Reacción entre H+
y OH-
: H+
+ OH-
• H2O
Inic. 4·10-3
5·10-3
Final - 1·10-3
En este caso el pH lo determina la concentración de iones OH-
[OH-
] = moles / V(L) disolución = 1·10-3
/ 0,01 = 0,1 mol/L
pOH = -log [OH-
] = -log (0,1) = 1
como Kw = [H+
] · [OH-
] = 10-14
, aplicando logaritmos, y cambiando el signo de toda la
ecuación: 14 = pH + pOH, de donde pH = 14 – pOH
El pH de la disolución indicada es pH = 14 – 1 = 13](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-293-320.jpg)
![MADRID / JUNIO 2000. COU / QUIMICA / CINETICA Y EQUILIBRIO /
PREGUNTA OPTATIVA / OPCION A / EJERCICIO 1
www.profes.net es un servicio gratuito de Ediciones SM
c) 25 mL de disolución de HCl 0,1 M + 25 mL de disolución de HNO3 0,4 M
Cálculo de moles:
Moles de HCl = Molaridad · V(L) = 0,1 ·25·10-3
= 2,5·10-3
moles
Moles de HNO3 = Molaridad · V(L) = 0,4 · 25·10-3
= 1·10-2
moles
Como los dos son ácidos que se disociancompletamente en disoluciónacuosa, el pH vendrá
determinado por la concentraciónde protones que proviene de ambos.
[H+
] = moles / V(L) disolución = (2,5·10-3
+ 1·10-2
) / 50·10-3
= 0,25 mol/L
pH = -log [H+
] = -log (0,25) = 0,6
d) Para la neutralización es necesario que el nº de equivalentes de ácido sea igual al nº de
equivalentes de base. En este caso el número de equivalentes tanto de ácido como de base
coincide con el número de moles respectivos ya que las valencias de ambos son uno.
25 mL de disolución de pH = 0,6
[H+
] = 10–pH
= 10–0,6
= 0,25 M
nº de moles de H+
= Molaridad · V(L) = 0,25 · 25·10-3
= 6,25·10-3
moles
Por lo tanto son necesarios 6,25·10-3
moles de base: nº moles = m(g) / Pm
m (g) = nº moles · Pm = 6,25·10-3
· 56 = 0,35 g de KOH
Estos son los gramos necesarios para la neutralizaciónde 25 mL de la disolucióndel apartado
anterior.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-294-320.jpg)
![MADRID / JUNIO.2000. COU / QUIMICA / CINETICA Y EQUILIBRIO /
PREGUNTA OPTATIVA / OPCIÓN A / EJERCICIO 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Se tiene una disolución saturada de fosfato de plata. Calcule:
a) La solubilidad de dicha sal expresando el resultado en g/L
b) El volumen de la disolución que sería preciso evaporar para obtener un residuo de
11,8 miligramos de dicha sal.
DATOS: Ks (fosfato de plata) = 1 · 10-18
Masas atómicas : P =31; O =16; Ag=108.
Solución:
a) Equilibrio de solubilidad del fosfato de plata:
Ag3(PO4) D 3 Ag+
+ PO4
3-
S 3S S
El producto de solubilidad Ks = [Ag+
]3
·[PO4
3-
]
Ks = (3S)3
· S = 27 · S4
1·10-18
= 27 · S4
S = ( 1·10-18
/ 27 )1/4
=1,39·10-5
mol/L
Para expresar la solubilidad en g/L, hay que pasar los moles a gramos: Pm Ag3(PO4) = 419
S = 1,39·10-5
· 419 = 5,8·10-3
g/L
b) Residuo 11,8 mg de fosfato de plata.
Moles de fosfato (residuo) = g / Pm = 11,8·10-3
/ 419 = 2,82·10-5
moles
Sabiendo que la molaridad de la sal es igual a la solubilidad M = 1,39·10-5
mol/L, y
conociendo los moles de sal que quedan como residuo al evaporar la disolución, aplicando la
definición de molaridad, se calcula el volumen de disolución:
M = nº de moles / V(L) disolución
1,39·10-5
= 2,82·10-5
/ V
V = 2,82·10-5
/ 1,39·10-5
= 2,03 L de disolución](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-295-320.jpg)

![MADRID / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Para los siguientes equilibrios:
1º) 2 N2O5 (g) 4 NO2 (g) + O2 (g)
2º) N2 (g) + 3 H2 (g) 2 NH3 (g)
3º) H2CO3 (ac) H+
(ac) + HCO3
-
(ac)
4º) CaCO3 (s) CaO (s) + CO2 (g)
a) Escriba las expresiones de Kc y Kp.
b) Razone qué sucederá en los equilibrios 1º y 2º si se aumenta la presión a temperatura
constante.
Solución:
a) La Kc es la constante de equilibrio expresada en función de las concentraciones, luego sólo
pueden aparecer en ella los reactivos y productos gaseosos o en disolución.
En la expresión de Kp, referida a las presiones parciales de los componentes de una mezcla,
únicamente se incluyen las especies en estado gaseoso.
Por lo tanto:
1º) Las tres especies implicadas en el equilibrio son gases, luego aparecen en las 2 constantes.
[NO2]4
· [O2]
Kc =
[N2O5 ]2
(P(NO2))4
· (P(O2))
Kp =
(P(N2O5 ))2
2º) Las tres especies implicadas en el equilibrio son gases, también aparecen en las 2
constantes.
[NH3]2
Kc =
[N2] · [H2]3
(P(NH3))2
Kp =
(P(N2)) · (P(H2))3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-297-320.jpg)
![MADRID / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
[H+
] · [HCO3
-
]
3º) Kc =
[H2CO3]
No existe Kp, porque todas las especies implicadas en el equilibrio son disoluciones.
4º) La única especie no sólida, y que al ser un gas, aparece en ambas constantes es el CO2.
Kc = [CO2]
Kp = P(CO2)
b) Según el principio de Le Chatelier, si sobre un equilibrio se introduce alguna modificación,
éste evoluciona en el sentido que se oponga a dicho cambio.
Como a temperatura constante, se ha de cumplir: P · V = cte, si se aumenta la presión, el
equilibrio se desplazará hacia el miembro de menor volumen, es decir, donde haya menor
número de moles. En los casos propuestos sería:
1º equilibrio: hacia los reactivos (izquierda).
2º equilibrio: hacia los productos (derecha).](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-298-320.jpg)
![MADRID / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A /
PROBLEMA 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Se dispone de una disolución acuosa 0,001 M de ácido 2- cloroetanoico, cuya
constante Ka es 1,3 · 10-3
. Calcule:
a) El grado de disociación del ácido.
b) El pH de la disolución.
c) Los gramos de ácido que se necesitarán para preparar dos litros de esta disolución.
Datos: Masas atómicas: C = 12,0; O = 16,0; Cl = 35,5; H = 1,0.
Solución:
a) El ácido dado, es orgánico, luego será débil, disociándose parcialmente:
CH2Cl - COOH + H2O CH2Cl - COO-
+ H3O+
[ ]inicial 0,001 -- --
[ ]equilibrio 0,001· (1 - a) 0,001·a 0,001·a
Llamando a al grado de disociación.
Como se conoce el valor de la constante de acidez, se puede despejar el grado de disociación:
Ka = ([CH2Cl - COO-
] · [H3O+
]) / ([CH2Cl - COOH])
Ka = (0,001· a)2
/ 0,001· (1 - a) = 1,3 ·10-3
De donde se tiene:
a = 0,65 = 65%
b) Se define: pH = -log [H3O+
]= -log (0,001 · 0,65) = 3,18
Se comprueba que es una disolución ácida, pues el pH es menor que 7.
c) Se conocen concentración molar (0,001 M), y volumen (2 L) de la disolución, luego para
determinar los gramos de ácido que se necesitan, se recurre ala expresión de molaridad:
M = nº moles soluto / V disolución (L)
Y como: nº moles = masa / M molecular
Se puede escribir:
M = (masa / M molecular) / V disolución (L)
Y despejando la masa, y sustituyendo los datos numéricos:
m = 0,001 moles/L · 2 L · 94,5 g/mol = 0,19 g](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-299-320.jpg)
![MADRID / JUNIO 01. COU / QUÍMICA / OBLIGATORIA / CINÉTICA Y
EQUILIBRIO / BLOQUE A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- El pH de una disolución de un ácido fuerte H2A es 2,0. Si a 50 mL de dicha disolución
se le añaden 5 mL de una disolución de una base fuerte BOH 0,05 M:
a) Determine la concentración de ácido que queda sin neutralizar.
b) Si la masa molecular de BOH es 24, ¿cuántos gramos de base se necesitan para
neutralizar la disolución del apartado anterior?
Solución:
a) Se escribe la reacción de disociación total del ácido fuerte del problema, y como
pH = -log [H3O+
], se puede determinar la concentración de protones que hay:
H2A + 2 H2O " A2-
+ 2 H3O+
pH = 2, 0
De donde [H3O+
] = 10-2
M
Como el ácido se disocia totalmente, con la concentración de protones se puede calcular la
concentración inicial del ácido:
H2A + 2 H2O " A2-
+ 2 H3O+
[ ]inicial Ci -- --
[ ]final -- Ci 2 Ci
Por lo tanto:
2· Ci = 10-2
M
Ci = 5·10-3
M
Una vez conocida la concentración inicial del ácido, se calculan los moles presentes en el
volumen que se indica de V =50 mL = 0, 05 L:
Moles de H2A = M · V = 5·10-3
· 0,05 = 2,5·10-4
moles
Del mismo modo, se calculan los moles contenidos en los 5 mL de la base:
Moles de BOH = 0,05 · 0,005 = 2,5·10-4
moles
Tras la mezcla los moles de cada sustancia no varían, pero como el volumen final sí lo hace,
se modificarán las concentraciones molares:
V final = 0,05 + 0,005 = 0,055 L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-300-320.jpg)
![MADRID / JUNIO 01. COU / QUÍMICA / OBLIGATORIA / CINÉTICA Y
EQUILIBRIO / BLOQUE A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
Las nuevas concentraciones serán:
M´ H2A = 4,54 · 10-3
M
M´ BOH = 4,54 · 10-3
M
La reacción de neutralización será:
2 BOH + H2A τ B2A + 2 H2O
[ ]inicial 4,54 · 10-3
4,54 · 10-3
-- --
[ ] final -- 2,27 · 10-3
2,27 · 10-3
2 · 2,27 · 10-3
Es decir, el ácido está en exceso, sobrando 2,27 · 10-3
moles / L.
b) La disolución que se quiere neutralizar ahora son los 2,27 · 10-3
moles / L de H2A.
Como el volumen final de la disolución es 0,055 L los moles a neutralizar son:
2,27 · 10-3
· 0,055 = 1,24·10-4
moles H2A
Como según la estequiometría de la reacción, por cada mol de ácido, se consumen dos moles
de base, para neutralizar el ácido presente, se requerirán:
2 · 1,24·10-4
= 2,48 · 10-4
moles de BOH, que expresados en gramos equivalen a:
2,48 · 10-4
· 24 gr/mol = 0,006 g = 6 mg de BOH](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-301-320.jpg)
![MADRID / JUNIO 01. COU / QUÍMICA /OBLIGATORIA / CINÉTICA Y
EQUILIBRIO / BLOQUE A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Una mezcla de yoduros de litio y de potasio tiene una masa de 2,5 g. Tras
precipitarlos con nitrato de plata, se obtuvieron 3,8 g de yoduro de plata.
a) Determine la composición porcentual de la mezcla inicial.
b) Calcule los gramos de yoduro de plata presentes en 10 mL de su disoluciónsaturada.
Datos: Ks (yoduro de plata) = 8,5 · 10-17
Masas atómicas: Li = 7; K = 39; I = 126,9; Ag = 107,9
Solución:
a) De los 2,5 g de la mezcla de sales, se tienen:
x g de LiI, y, por tanto, (x – 2,5) g de KI
Al adicionar el nitrato de plata, todo el yodo procedente de estos dos yoduros solubles, se
precipita en forma de una nueva sal insoluble, el AgI.
Se calcula, en primer lugar, los gramos de yodo presentes en los x g de LiI:
1 mol de LiI =133,9 g contiene 126,9 g de I
x g y g de I
y = (126,9 · x) / 133,9 = 0,94 · x g de I
Del mismo modo, se calculan los gramos de I en los (2,5 – x) g de KI:
1 mol de KI = 166 g contiene 126,9 g de I
(2,5 – x) z g de I
z = [126,9 · (2,5 – x)] / 166 = 0,76 · (2,5 – x)
Y, finalmente, se determinan los gramos de yodo presentes en los 3,8 g de precipitado de AgI:
1 mol de AgI = 234,8 g contiene 126,9 g de I
3,8 g w g de I
w = 2,05 g de I
Como se ha dicho ya, el I precipitado como AgI, procedía de las sales LiI y KI, luego:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-302-320.jpg)
![MADRID / JUNIO 01. COU / QUÍMICA /OBLIGATORIA / CINÉTICA Y
EQUILIBRIO / BLOQUE A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
0,94 · x + 0,76 · (2,5 – x) = 2,05
De donde se deduce:
x = 0,83 g = masa de LiI
2,5 – x = 1,67 g = masa de KI
Y con las cantidades de cada sal calculadas, se puede hallar la composición de la mezcla en
tanto por ciento:
% LiI = (100 · 0,83) / 2,5 = 33,2%
% KI = (100 · 1,67) / 2,5 = 66,8%
b) Se escribe el equilibrio de solubilidad de la sal AgI, y con el valor de la Ks, se determina la
solubilidad en moles/L. A continuación, con la masa molecular, se pasa la solubilidad a g/L.
Y finalmente, se determinan los gramos de AgI en 10 mL (0,01 L)
AgI (s) λ Ag+
(ac) + I-
(ac)
s s
Ks = [Ag+
]·[ I-
] = s2
= 8,5 · 10-17
s = 9,22 · 10-9
moles / L
M molecular AgI = 234,8 g / mol
s = 9,22 · 10-9
· 234,8 = 2,16 · 10-6
g / L
Si en 1 L 2,16 · 10-6
g de AgI
en 0,01 L x
x = 2,16 · 10-8
g AgI en 10 mL de disolución.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-303-320.jpg)

![MADRID / JUNIO 01. COU / QUÍMICA / OPTATIVA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- A 800 K, el monóxido de carbono reacciona con agua para dar dióxido de carbono e
hidrógeno, alcanzando un equilibrio cuya constante vale Kc = 5,1. Si a dicha
temperatura y en un recipiente de 50 L se hace reaccionar 1 mol de monóxido de
carbono con 1 mol de agua, calcule:
a) ¿Cuántos moles de monóxido de carbono quedan sin reaccionar?, ¿cuál es la presión
parcial de cada componente en el equilibrio?, ¿cuál es la presión total?
b) Si una vez alcanzado el equilibrio, se introducen 2 moles más de agua, ¿cuántos moles
de monóxido de carbono quedarán ahora sin reaccionar?
Datos: R = 0,082 atm·L·mol-1
·K-1
Solución:
a) Se escribe el equilibrio, llamando x a la concentración de reactivos que se consumen, y por
tanto, de productos que se forman:
CO + H2O CO2 + H2
[ ] iniciales 1/50 1/50 -- --
[ ] equilibrio 1/50 – x 1/50- x x x
La expresión de Kc es:
Kc = ([CO2]·[H2]) / ([CO]· [H2O])
Luego se sustituyen las concentraciones en el equilibrio correspondientes:
Kc = (x )2
/ (1/50 – x)2
= 5,1
De donde:
x = 0,0139 M
Por tanto:
[CO] eq. = 1/50 – 0,0139 = 0,0061 M
n CO eq. = 0,0061·50 = 0,305 moles
La expresión de las presiones parciales de los componentes de una mezcla de gases es:
Pi = Ptotal · Xi
Siendo Xi la fracción molar del componente estudiado.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-305-320.jpg)
![MADRID / JUNIO 01. COU / QUÍMICA / OPTATIVA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
Para averiguar la presión total en el recipiente se recurre a la ecuación de los gases perfectos:
P·V = n·R·T
Siendo: n = nº total de moles en el equilibrio = (0,305 · 2) + (0,695 · 2) = 2 moles
P total = (2 · 0,082 · 800) / 50 = 2,624 atm.
Estando ya en disposición de determinar las fracciones molares y las presiones parciales de
todos los componentes de la mezcla:
X CO = X H2O = 0,305 / 2 = 0,1525
P CO = P H2O = 2,624 · 0,1525 = 0,4 atm.
X CO2 = X H2 = 0,695 / 2 = 0,3475
P CO2 = P H2 = 2,624 · 0,3475 = 0,91 atm
b) Como se aumentan los moles de un reactivo, el equilibrio tiende a desplazarse hacia los
productos, oponiéndose a la modificación introducida.
Se vuelve a escribir el equilibrio, siendo ahora concentraciones iniciales las del equilibrio
alcanzado anteriormente, y llamando z a la concentración de reactivos consumida:
CO + H2O CO2 + H2
[ ] iniciales 6,1·10-3
6,1·10-3
+ (2/50) 0,0139 0,0139
[ ]equilibrio 6,1·10-3
– z 0,0461 – z 0,0139 + z 0,0139 + z
La expresión de Kc es:
Kc = ([CO2]·[H2]) / ([CO]· [H2O])
Luego se sustituyen las concentraciones en el equilibrio correspondientes:
Kc = (0,0139 + z)2
/ ((6,1·10-3
– z) · (0,0461 – z))
De donde:
z = 0,0045 M = 4,5·10-3
M
Por lo que la concentración de CO en el equilibrio será:
[CO] eq. = 6,1·10-3
– 4,5·10-3
= 1,6·10-3
M
n CO eq. = 1,6·10-3
· 50 = 0,08 moles](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-306-320.jpg)
![MADRID / JUNIO 01. COU / QUÍMICA / OPTATIVA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- El bromuro de plata tiene una solubilidad de 1,0·10-6
M. Calcule la cantidad de sal
precipitada o disuelta:
a) Si se añaden 0,188 mg de dicha sal a 1 L de agua.
b) Si se añaden 0,376 mg de dicha sal a 1 L de agua.
Datos: masas atómicas: Ag = 108; Br = 80.
Solución:
Se escribe el equilibrio de solubilidad de la sal dada:
AgBr (s) D Ag+
(ac) + Br-
(ac)
s s
Llamando s a la solubilidad de dicha sal, cuyo dato se conoce: s = 1,0·10-6
moles / L
La expresión del producto de solubilidad será:
Ks = [Ag+
] · [Br-
] = s2
= 1,0·10-12
a) Con la masa molecular del compuesto, se determinan los moles de sal añadidos al agua:
m AgBr = 0,188 mg AgBr = 1,88·10-4
g
n AgBr = 1,88·10-4
/ 188 = 1,0·10-6
moles (en 1 L)
Como lo máximo que se puede disolver es: 1,0·10-6
moles/L = 1,88·10-4
g/L = 0,188 mg/L
Se disolverá toda la sal añadida al agua.
b) Con la masa molecular del compuesto, se determinan los moles de sal añadidos al agua:
m AgBr = 0,376 mg = 3,76·10-4
g
n AgBr = 3,76·10-4
/ 188 = 2·10-6
moles (en 1 L)
Como lo máximo que se puede disolver es: 1,0·10-6
moles/L = 1,88·10-4
g/L = 0,188 mg/L
Quedará como precipitado sin disolver: 2·10-6
- 1,0·10-6
= 1,0·10-6
moles
Que expresados en masa serán: 188 g / mol · 1,0·10-6
moles = 1,88·10-4
g = 0,188 mg](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-307-320.jpg)

![MADRID / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A /
PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
Problema 2
Se preparan 500 mL de una disolución que contiene 0,2 moles de un ácido orgánico
monoprótico cuyo pH es 5,7. Calcule:
a) La constante de disociación del ácido.
b) El grado de disociación del ácido en la disolución
c) La constante Kb de la base conjugada.
Solución:
En primer lugar se determina la concentración de la disolución, gracias a los datos de número
de moles y volumen (en litros):
M = 0,2 / 0,5 = 0,4 mol/L
A partir del equilibrio de disociación del ácido orgánico débil, HA, llamando “x” a los
moles/L que reaccionan y sabiendo que corresponden a la concentración de protones que
marca el pH de la disolución, se tiene:
HA + H2O A-
+ H3O+
[ ]inicial 0,4 -- --
[ ]equil. 0,4 – x x x
pH = - log [H3O+
] = 5,7
[H3O+
] = 10-5,7
= 2 · 10-6
M
x = 2 · 10-6
M
a) La expresión de la constante de acidez será:
Ka = ([A-
]· [H3O+
]) / [HA]
Ka = x · x / (0,4 - x)
Y sustituyendo por el valor hallado de x en dichas concentraciones en el equilibrio, y
operando, se tiene:
Ka = 1,00 · 10-11](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-309-320.jpg)
![MADRID / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A /
PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
b) Para determinar el grado de disociación, se escribe la fila de concentraciones en el
equilibrio en función de este parámetro, llamado a:
HA + H2O A-
+ H3O+
[ ]inicial 0,4 -- --
[ ]equil. 0,4 · (1– a) 0,4 · a 0,4 · a
Igualando las concentraciones de protones, por ejemplo, de ambas tablas, se tiene:
0,4· a = x
0,4· a = 2 · 10-6
De donde:
a = 5 · 10-6
= 5 · 10-4
%
c) Las constantes de un ácido débil y su base conjugada se relacionan por medio del producto
iónico del agua, Kw, de la siguiente manera:
Kw = Ka · Kb
Luego:
Kb = Kw / Ka = 10-14
/ 10-11
= 10-3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-310-320.jpg)

![MADRID / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN B
/ PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN B
2.- El equilibrio PCl5 (g) ‡ PCl3 (g) + Cl2 (g) se alcanza calentando 3 g de
pentacloruro de fósforo hasta 300ºC en un recipiente de medio litro, siendo la presión
final de 2 atm. Calcule:
a) El grado de disociación del pentacloruro de fósforo.
b) El valor de Kp a dicha temperatura.-
Datos: R = 0,082 (atm· L) / (mol · K); Masas atómicas: Cl = 35,5; P = 31,0
Solución:
a) Se determinan los moles del pentacloruro iniciales:
moles = 3 / (5 · 35,5 + 31) = 0,0143 moles
Se escribe el equilibrio, llamando a al grado de disociación en tanto por uno:
PCl5 (g) ‡ PCl3 (g) + Cl2 (g)
moles iniciales 0,0143 -- --
moles equilibrio 0,0143 · (1 - a ) 0,0143 · a 0,0143 · a
Para poder calcular el valor de a, se hallan los moles totales en el equilibrio con la ecuación
de los Gases Ideales:
P · V = n · R · T
n totales = (2 · 0,5) / (0,082 · 673) = 0,018
Luego estos 0,018 moles serán la suma de los moles en elequilibrio de las tres especies
gaseosas:
n totales = 0,018 = 0,0143 · (1 - a ) + 0,0143 · a + 0,0143 · a
De donde:
a = 0,258 = 25,8%
b) Para determinar la Kp, se determina Kc (en función de las concentraciones), y luego se
recurre a la relación entre ambas constantes de equilibrio:
Kc = ([PCl3] · [Cl2]) / [PCl5]
[PCl3] = [Cl2] = (0,0143 · 0,258) / 0,5 = 7,38 · 10-3
M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-312-320.jpg)
![MADRID / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN B
/ PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
[PCl5] = 0,0143 · (1 - 0,258) / 0,5 = 0,021 M
Kc = (7,38 · 10-3
)2
/ 0,021 = 2,6 · 10-3
Kp = Kc · (R · T)Dn
Kp = 2,6 · 10-3
· (0,082 · 673)2 - 1
= 0,143](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-313-320.jpg)


![MADRID / JUNIO 99. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / P 2
www.profes.net es un servicio gratuito de Ediciones SM
5.- Se tiene una disolución de una ácido cuya constante es de 2,0⋅10-3
y su grado de
disociación 0,15. Calcule:
a) La concentración de la disolución del ácido.
b) El pH de otra disolución del mismo ácido de concentración 1,0⋅10-3
M.
Solución:
a) Un ácido en general tiene la siguiente ecuación de disociación:
HA + H2O D A-
+ H3O+
C0 (1- α) C0 α C0 α
Si Ka = 2⋅ 10-3
y el grado de disociación α = 0,15, entonces:
[ ][ ]
[ ] ( )α
αα
−
==
−+
1
.
0
003
C
CC
HA
AOH
Ka
2⋅ 10-3
= 0,0225 ⋅ C0 / 0,85; despejando
C0 = 0,075 M
b) Se plantea otro estado de equilibrio diferente:
HA + H2O D A-
+ H3O+
C0 (1- α´) C0 α´ C0 α´
Ka = 2⋅10-3
es el mismo valor.
El grado de disociación variará:
2⋅ 10-3
= 10-3
⋅ α´2
/ (1-α´) α´ = 0,73
[H30+
] = C0⋅ α´ = 10-3
⋅ 0,73 = 7,3⋅10-4
M
pH = - log [H3O+
] = 3,13](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-316-320.jpg)

![MADRID / JUNIO 99. COU / QUÍMICA OBLIGATORIA / CINÉTICA y EQUILIBRIO
/ OPCIÓN A / Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- El pH de una disolución saturada de hidróxido de plomo(II) es 9,1, a 25 ºC.
Calcule:
a) La solubilidad del hidróxido de plomo(II) en mg/L a esa temperatura.
b) El valor de la constante del producto de solubilidad de dicho compuesto.
DATOS: Masas atómicas, 0 = 16; H = 1; Pb = 207,2
Solución:
a) Pb (OH)2 (s) D Pb2+
(aq) + 2 OH-
(aq)
s 2s
[OH-
] = 2s pH = 9,1
pOH = 14 – pH = 4.9
[OH-
] = 1,26⋅ 10-5
mol/L
2s = 1,26⋅ 10-5
mol/L ; s = 6,295⋅10-6
mol/L
El peso molecular del hidróxido de plomo es 241; como la solubilidad hay que expresarla en
mg/L, pasaremos el resultado de mol/ L a mg/L.
Número de moles = g / Peso molecular
Si lo pasamos a milimoles (mMol): s = 6,295⋅10-6
mol/L = 6,295⋅ 10-3
mMol/L
s = 6,295⋅ 10-3
mMol/L ⋅ 241 = 1,51 mg/L
b) Para hallar el producto de solubilidad
Ks = [Pb2+
]⋅ [OH-
]2
Si [Pb2+
] = s y [OH-
] = 2s
Ks = s · (2s)2
= 4 s3
= 4 (6,295⋅ 10-6
)3
= 9,98⋅10-16](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-318-320.jpg)
![MADRID / JUNIO 99.COU / QUÍMICA OPTATIVA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- En un recipiente de 10 litros se introducen 2 moles de un compuesto A y un mol de un
compuesto B. Se calienta a 300ºC y al cabo del tiempo se establece el siguiente equilibrio:
A(g) + 3B(g) D 2C(g)
El número de moles de B es igual que el de C. Calcule:
a) Los moles de cada componente en equilibrio.
b) El valor de las constantes Kc y Kp.
Solución:
a) A(g) + 3B(g) D 2C(g)
n0 2 1
nr x 3x
neq 2- x 1- 3x 2x
En el equilibrio nB = nC, entonces 1-3x = 2x; x = 0,2
Por tanto:
nA = 2 - x = 1,8 moles
nB=1 - 3x = 0,4 moles
nC = 2x = 0,4 moles
b)
[ ]
[ ][ ]
2
3
2
3
2
)/(89,138
10
4,0
10
8,1
10
4,0
.
−
=
⋅
== lmol
BA
C
Kc
Kp = Kc⋅ (RT)∆n
Kp = 138,89 ⋅ (0,082⋅573)-2
= 0,063 atm-2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-319-320.jpg)
![MADRID / JUNIO 99.COU / QUÍMICA OPTATIVA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- En un recipiente de 10 litros se introducen 2 moles de un compuesto A y un mol de un
compuesto B. Se calienta a 300ºC y al cabo del tiempo se establece el siguiente equilibrio:
A(g) + 3B(g) D 2C(g)
El número de moles de B es igual que el de C. Calcule:
a) Los moles de cada componente en equilibrio.
b) El valor de las constantes Kc y Kp.
Solución:
a) A(g) + 3B(g) D 2C(g)
n0 2 1
nr x 3x
neq 2- x 1- 3x 2x
En el equilibrio nB = nC, entonces 1-3x = 2x; x = 0,2
Por tanto:
nA = 2 - x = 1,8 moles
nB=1 - 3x = 0,4 moles
nC = 2x = 0,4 moles
b)
[ ]
[ ][ ]
2
3
2
3
2
)/(89,138
10
4,0
10
8,1
10
4,0
.
−
=
⋅
== lmol
BA
C
Kc
Kp = Kc⋅ (RT)∆n
Kp = 138,89 ⋅ (0,082⋅573)-2
= 0,063 atm-2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-320-320.jpg)

![MADRID / JUNIO 2000. COU / QUIMICA / CINETICA Y EQUILIBRIO / OPCION A
/ PREGUNTA OBLIGATORIA / EJERCICIO 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- A la temperatura de 100ºC y 1 atm de presión, el compuesto ZY está disociado en un
10%, según la reacción:
ZY (g) • Z (g) + Y (g)
Calcule el grado de disociación de ZY si se mantiene la temperatura pero la presión se
aumenta a 5 atm.
Solución:
La constante del equilibrio no varía al aumentar la presión, por lo que calculando dicha
constante con las condiciones iniciales y aplicándola posteriormente se puede obtener el grado
de disociación para las condiciones indicadas.
Para calcular la constate de equilibrio es necesario conocer la concentración inicial, que se
obtiene de los datos del problema:
Como inicialmente tenemos un compuesto gaseoso ZY(g), podemos aplicar la ecuación de los
gases ideales: P·V = n·R·T
n / V = P/ RT; n / V = 1 / 0,082 · 373 = 0,0326 M
ZY (g) • Z (g) + Y (g)
Inicialmente (mol/L) 0,0326 _ _
Se disocia 0,0326α
Se forma 0,0326α 0,0326α
En el equilibrio 0,0326(1-α) 0,0326α 0,0326α
Kc = [Z]·[Y] / [ZY] = 0,0326α· 0,0326α / 0,0326(1-α)
Kc = (0,0326α)2
/ 0,0326 (1-α) (sabiendo que α = 0,1)
Kc = 0,03262
· 0,12
/ 0,0326 ( 1 - 0,1)
Kc = 0,0326 · 0,01 / 0,9 = 3,6 · 10-4
Si la presión aumenta a P = 5 atm, varia la concentración:
n / V = P / R·T](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-322-320.jpg)




![MADRID / SEPTIEMBRE 00. SELECTIVIDAD / QUIMICA / CINETICA Y
EQUILIBRIO /OPCION A / OBLIGATORIA / EJERCICIO 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- El monóxido de carbono y el hidrógeno reaccionan, en estado gaseoso, dando metano
y agua. Cuándo se mezclan un mol de monóxido de carbono y tres moles de hidrógeno
en un recipiente de 10 L a 927ºC, se forman en el equilibrio 0,387 moles de agua.
Calcule:
a) El número de moles de cada especie en el equilibrio.
b) Las constantes de equilibrio Kc y Kp a 927ºC
DATOS: R = 0,082 atm·L / K·mol
Solución
a) El equilibrio homogéneo propuesto es el siguiente:
CO (g) + 3 H2 (g) D CH4 (g) + H2O (g)
inicialmente 1 mol 3 moles --- ---
reaccionan x 3x --- ---
equilibrio 1 – x 3 – 3x x x
Sabemos que en el equilibrio hay 0,387 moles de agua, por lo que x = 0,387
La composición del equilibrio es:
n CO eq = 1 – x = 1 – 0,387 = 0,613 moles
n H2 eq = 3 – 3x = 3 – 3·0,387 = 1,839 moles
n CH4 eq = x = 0,387 moles
n H2O eq = x = 0,387 moles
b) La constante de equilibrio Kc tiene la expresión:
Kc =
[ ][ ]
[ ][ ]3
2
24
HCO
OHCH
La concentración la expresamos en molaridad: M = nº de moles / V (L)
Entonces, debemos dividir el nº de moles de cada una de las especies en el equilibrio entre el
volumen de la disoluciónque es 10 L.
Kc =
( )( )
( )( )3
1839,0·0613,0
0387,0·0387,0
= 3,92](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-327-320.jpg)

![MADRID / SEPTIEMBRE 00. SELECTIVIDAD / QUIMICA /CINETICA Y
EQUILIBRIO /OPCION A / OBLIGATORIA / EJERCICIO 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Se disuelven 0,345 g de un ácido monoprótico HA en 100 mL de agua. El pH de la
disolución tiene un valor de 5,6. Calcule:
a) La constante de disociación de dicho ácido.
b) El grado de disociación.
c) Si se toman 25 mL de la disolución anterior y se neutralizan con una disolución de
hidróxido de sodio, que contiene 0,8 g/L, ¿qué volumen de ésta disolución se
requerirá?.
d) Si se toman 10 mL de la disolución original y se diluyen hasta 100 mL, ¿cuál sería el
nuevo pH?.
DATOS: Mm de HA = 345
Masas atómicas: Na = 23; O = 16 y H = 1.
Solución:
a) En primer lugar se calcula la concentración inicial de ácido (Co):
Co = (m / Mm) / V = (0,345/345) / 0,1 = 0,01 M
El equilibrio de disociación del ácido debil es el siguiente:
HA + H2O • A-
+ H3O+
inicialmente (mol/L) 0,01 --- ---
se disocián: x --- ---
equilibrio: 0,01 – x x x
Sabiendo que el pH de la disolución es 5,6:
pH = - log [ H3O+
]
5,6 = - log [ H3O+
]
[ H3O+
] eq = 10-5,6
M
x = 10-5,6
= 2,51·10-6
M
La constante de disociación del ácido es : Ka = [ H3O+
] · [A-
] / [HA]
Sustituyendo en esta expresión las concentraciones en el equilibrio se tiene:
Ka = (2,51·10-6
· 2,51·10-6
) / (0,01 – 2,51·10-6
) = 6,31·10-10](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-329-320.jpg)

![MADRID / SEPTIEMBRE 00. SELECTIVIDAD / QUIMICA /CINETICA Y
EQUILIBRIO /OPCION A / OBLIGATORIA / EJERCICIO 2
www.profes.net es un servicio gratuito de Ediciones SM
6,31·10-13
– 6,31·10-10
x = x2
x2
– 6,31·10-10
x – 6,31·10-13
= 0
Se obtienen dos valores para x, uno negativo (que no tiene sentido químico) y el otro positivo:
x = 7,94·10-7
mol/L
Como x = [H3O+
] = 7,94·10-7
mol/L
pH = - log (7,94·10-7
) = 6,1
Cómo es lógico, al diluir el ácido inicialdisminuye su concentracióny aumenta el pH de la
disoluciónresultante.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-331-320.jpg)
![MADRID / SEPTIEMBRE 01. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- La constante de la reacción H2 (g) + CO2 (g) H2O (g) + CO (g), cuya DDHº > 0,
vale 4,2 a 1650ºC. Si se introducen 0,8 moles de H2 (g) y 0,8 moles de CO2 (g) en un
recipiente de 5 L, determine:
a) Cuáles serán las presiones parciales de cada sustancia cuando se alcance el
equilibrio.
b) Si una vez alcanzado el equilibrio, se añaden 0,2 moles de CO, ¿cual será el efecto
sobre el equilibrio?.
c) Si se eleva la temperatura a 2000ºC, ¿hacia donde se desplazará el equilibrio?
d) ¿Cómo influirá en el equilibrio un aumento de presión a temperatura constante?
Datos: R = 0,082 atm · L · mol-1
· K-1
Solución:
a) Los datos de que se dispone son:
Kc = 4,2
T = 1650ºC = 1923 K
V total = 5 L
Como la Kc es la constante de equilibrio en función de las concentraciones, se calculan, en
primer lugar, las concentraciones de los reactivos introducidos en el matraz:
[ ] = moles / V total (L)
[H2] inicial = 0,8 / 5 = 0,16 M
[CO2 ] inicial = 0,8 / 5 = 0,16 M
Se llama x a la concentración de reactivos que se consume, quedando la expresión del
equilibrio:
H2 (g) + CO2 (g) H2O (g) + CO (g)
[ ]inicial 0,16 0,16 -- --
[ ]equilibrio 0,16 - x 0,16 - x x x
Kc = ([H2O] · [CO]) / ([H2] · [CO2 ])
Kc = x2
/ (0,16 – x)2
= 4,2
De donde se tiene:
x = 0,11 M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-332-320.jpg)
![MADRID / SEPTIEMBRE 01. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
Así se pueden conocer las concentraciones de todas las especies en el equilibrio, y con ellas y
el volumen total, los moles son:
[H2O]equilibrio = [CO] equilibrio = 0,11 M
moles H2O equilibrio = moles CO equilibrio = 0,11 · 5 = 0,55 moles
[H2] equilibrio =[CO2 ] equilibrio = 0,16 - 0,11 = 0,05 M
moles H2 equilibrio = moles CO2 equilibrio = 0,05 · 5 = 0,25 moles
Luego los moles totales en el equilibrio serán:
nT = 2 · 0,55 + 2 · 0,25 = 1,6 moles
Se recuerda ahora la expresión de la presión parcial de un componente de una mezcla:
Pi = Ptotal · Xi
Y como Xi, es el cociente entre los moles de cada componente y los totales, se tiene:
x CO = x H2O = 0,55 / 1,6 = 0,34
x H2 = x CO2 = 0,25 / 1,6 = 0,16
El dato de presión total no se tiene, pero sí los datos de volumen, moles y temperatura; luego
al tratar de gases puede escribirse que:
P · V = nT · R ·T
P = (1,6 · 0,082 · 1923) / 5 = 50,45 atm
Y ahora ya se tiene:
P CO = P H2O = 50,45 · 0,34 = 17,15 atm
P H2 = P CO2 = 50,45 · 0,16 = 8,07 atm
b) Según el principio de Le Chatelier, si sobre un equilibrio se introduce alguna
modificación, éste evoluciona en el sentido que se oponga a dicho cambio.
Luego si aumenta la concentración de CO, se desplazará en el sentido en que se consuma CO,
es decir, hacia la izquierda.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-333-320.jpg)

![MADRID / SEPTIEMBRE 01. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- ¿Qué volumen de disolución saturada de cloruro de plomo (II) se puede preparar con
1 g de dicha sal?
Datos: Ks [cloruro de plomo (II)] = 1,7 · 10-5
Masas atómicas: Cl = 35,5; Pb = 208.
Solución:
Una disolución saturada es aquella en la que que se encuentra en equilibrio la sal sólida con
sus iones en disolución:
PbCl2 (s) Pb2+
(ac) + 2 Cl-
(ac)
s s
Llamando s a la concentración de iones presente.
Ks = [Pb2+
] · [Cl-
]2
= s · (2s)2
= 4s3
= 1,7 · 10-5
De donde :
s = 0,016 moles / L
Conociendo la concentración máxima de sal (disolución saturada), su masa molecular (279 g /
mol), y la masa dada (1 g), se determina el volumen de disolución:
M = (m / M molecular) / V disolución (L)
0,016 = (1 / 279) / V
V = 0,22 L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-335-320.jpg)
![MADRID / SEPTIEMBRE 01. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Justifique la veracidad o falsedad de las siguientes afirmaciones, referidas a una
disolución acuosa diluida de un ácido fuerte monoprótido (HA)
a) La concentración de iones H3O+
es mayor que la de iones A-.
b) Las concentraciones de iones H3O+
, de iones A-
y de moléculas HA son
aproximadamente iguales.
c) Solamente hay iones H3O+
e iones A-
en la misma proporción molar.
d) Una disolución acuosa de la sal de sodio de dicho ácido tiene un pH neutro.
Solución:
Se escribe, en primer lugar, la reacción de disociación total del ácido fuerte dado, llamando Ci
a su concentración inicial, que coincide con la final de los iones formados:
HA + H2O δ H3O+
+ A-
[ ]inicial Ci -- --
[ ]final -- Ci Ci
A continuación se contesta a las cuestiones propuestas:
a) Falso. Al ser un ácido con un solo protón, la concentración de éstos iones hidronio coincide
con la de los aniones.
b) Falso. Por ser un ácido fuerte se encuentra totalmente disociado y apenas habrá nada de la
especie HA en disolución.
c) Cierto. Por lo citado en los apartados a) y b) podemos considerar despreciable la
concentración molar de HA.
d) Cierto. La sal del ácido HA es NaA.
Su disociación en iones es:
NaA δ A-
+ Na+
Como ambos iones proceden de un ácido (HA) y una base (NaOH) fuertes, respectivamente,
ninguno de los dos se hidroliza, resultando la disolución neutra, con pH = 7.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-336-320.jpg)
![MADRID / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
OPCIÓN A / PROBLEMA 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Una disolución acuosa 0,01 M de un ácido débil HA, tiene un grado de disociación de
0,25. Calcule:
a) Ka del ácido.
b) pH de la disolución.
c) Kb de la base conjugada A-
.
Dato: Producto iónico del agua: Kw = 1 · 10-14
Solución:
Se escribe el equilibrio de disociación del ácido dado:
HAc + H2O H3O+
+ Ac-
[ ]inicial 0,01 -- --
[ ]equil. 0,01·(1 - a) 0,01 · a 0,01 · a
Sabiendo que el valor de a es 0,25.
Se sustituyen las concentraciones en el equilibrio en la expresión de la constante de
disociación del ácido, Ka:
Ka = ([H3O+
]·[ Ac-
]) / [HAc]
Ka = (0,01 · 0,25)2
/ 0,01· (1 – 0,25)
De donde se tiene:
Ka = 0,33 · 10-4
b) El pH se determina con la concentración de protones presente en el equilibrio:
[H3O+
] =2,5 · 10-3
M
pH = - log [H3O+
] = 1,6
Como era de esperar, es una disolución ácida, con un pH menor que 7.
c) Se sabe que para cada par de ácido – base conjugados, se cumple:
Kw = Ka · Kb
Por tanto, en este caso:
Kb (A*
) = 3,03 · 10-10](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-337-320.jpg)

![MADRID / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN B / PROBLEMA 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Se dispone de 250 mL de una disolución que contiene 5 g de ácido bromoacético
(bromoetanoico) cuya Ka = 1 ,25· 10-3
. Escriba los equilibrios correspondientes y calcule:
a) El grado de disociación.
b) Los gramos de hidróxido de potasio necesarios para reaccionar completamente con
el ácido.
Nota; Considere que con la adición de 105 gramos de KOH no se produce aumento de
volumen.
Datos.- Masas atómicas: C = 12,0; O = 16,0; H = 1,0; Br = 79,9; K= 39,1.
Solución:
Se determinan, en primer lugar, los moles contenidos en los 5 g de ácido, y con ellos y el
volumen final de disolución, su molaridad:
Moles ácido = 5 / 138,9 = 0,036 moles
M = 0,036 / 0,25 = 0,144 M
Podríamos escribir el equilibrio de disociación del ácido bromoacético , al que se denomina
HA para simplificar:
HA + H2O H3O+
+ A-
[ ]inicial 0,144 -- --
[ ]equil. 0,144· (1- a) 0,144 · a 0,144 · a
Como se desconoce el valor de a, luego se escriben las concentraciones en el equilibrio en
función de “x”, o cantidad de disolución que reacciona:
HA + H2O H3O+
+ A-
[ ]equilibrio 0,144 – x x x
Se sustituyen las concentraciones en el equilibrio en la expresión de la constante de
disociación del ácido, Ka, cuyo valor se conoce:
Ka = ([H3O+
]· [ A-
]) / [HA]
Ka = x2
/ (0,144 – x) = 1,25 · 10-3
De donde se tiene:
x = 0,0136 M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-339-320.jpg)

![MADRID / SEPTIEMBRE 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / PROBLEMA Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
2.- Una disolución acuosa de ácido acético 0,01 M está ionizada en un 4,2%. Calcule:
a) Su constante de ionización.
b) ¿Qué concentración de ácido clorhídrico hay que preparar para tener un pH igual al
de la disolución problema?
Solución:
a) El equilibrio de disociación del ácido acético es:
HAc + H2O ‡ Ac-
+ H3O+
[inicial] 0,01 -- --
[equilibrio] 0,01 · (1 - 0,042) 0,01 · 0,042 0,01 · 0,042
Pues se da como dato un grado de disociación del 4,2%, lo que es lo mismo, del 0,042.
La expresión de la constante de acidez es:
Ka = ([Ac-
] · [H3O+
]) / [HAc]
Sustituyendo por los valores de las concentraciones en le equilibrio, se tiene:
Ka = (0,01 · 0,042)2
/ (0,01 · 0,958) = 1,84 · 10-5
b) El pH de la disolución de acético dada será:
pH = - log [H3O+
] = - log (0,01 · 0,042) = 3,37
Es, pues, una disolución ácida, como era de esperar.
El HCl es fuerte, luego la concentración inicial ha de coincidir con la de protones disueltos,
luego para que el pH fuese también de 3,37, la concentración de la disolución habría de ser de
0,01 · 0,042 = 4,2 · 10-4
M.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-341-320.jpg)


![MADRID / SEPTIEMBRE 98. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
Problema 2.-
a) El pH de una disolución de NaOH es 13.Calcule su concentración.
b) El pH de una disolución de igual concentración de amoniaco es 11,13. Calcule
la Kb del amoniaco y su grado de disociación.
Solución:
a) El NaOH es una base fuerte cuya reacción de disociación es:
NaOH à Na+
+ OH-
Como pH = 13
pH + pOH = 14
pOH = 14 – 13 = 1
[OH-
] = 0,1 M
Luego la [NaOH] = 0,1M
b) El NH3 en disolución acuosa es una base débil:
NH3 + H2O D NH4
+
+ OH-
Como conocemos el pH del amoniaco, que es 11,13 ( pH básico), podemos hallar el
pOH.
pH + pOH = 14
pOH = 14 –11,13 = 2,87
[OH-
] = 10 –2,87
= 1,34 · 10-3
M
Esta concentración es la del OH-
y la del NH4
+
[OH-
] = [NH4
+
] = 1,34 · 10-3
M
La constante de basicidad seria:
Kb = [NH4
+
]·[OH-
] / [NH3 ]](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-344-320.jpg)
![MADRID / SEPTIEMBRE 98. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
NH3 + H2O D NH4
+
+ OH-
[ ] o Co 0 0
[ ] r x
[ ]eq Co-x x x
Como se trata de una disolución de igual concentración que la de a) : Co = 0,1 M
Kb = x2
/ Co -x
Kb = (1,34 · 10-3
)2
/ (0,1 - 1,34 · 10-3
)
Kb = 1,81 · 10-5
Para hallar el grado de disociación:
x = Co · a
1,34 · 10-3
= 0,1 · a
a = 1,34 · 10-2
(1,34 %)](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-345-320.jpg)
![MADRID / SEPTIEMBRE 98. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2. - Razone utilizando los equilibrios correspondientes, si los pH de las disoluciones que
se relacionan son ácidos, basicos o neutros.
a) Acetato Potasico 0,01M
b) Nitrato sódico 0,01M
c) Sulfato amónico 0,01 M
d) Hidróxido de bario 0,01M
Solución:
pH = -log [H3O+
]
- Disolución Neutra: pH = 7
- Disolución Acida pH < 7
- Disolución Basica: pH > 7
a) El acetato potasico proviene del ácido acético, que es un ácido débil, y de la potasa, que es
una base fuerte, por lo que la reacción de disociación es:
CH3 – COOK à CH3 – COO-
+ K+
El CH3 –COO-
es una base fuerte, y el K+
un ácido débil, por lo que es la base fuerte la que da
hidrólisis
CH3 – COO-
+ H2O D CH3 – COOH + OH-
Por lo que el pH de esta disolución es básico.
b) El nitrato sódico proviene del ácido nítrico, que es un ácido fuerte, y del hidróxido de
sodio, que es una base fuerte, dando la siguiente reacción de disociación:
NaNO3 à Na+
+ NO3
-
Como el Na+
es un ácido débil y el NO3
-
es una base débil, no hay ninguna hidrólisis, por lo
que el pH es neutro.
c) El sulfato amónico proviene del ácido sulfúrico, ácido fuerte, y del hidróxido de sodio, que
es una base débil, por lo que la reacción de disociación seria:
(NH4 )2 SO4 à 2 NH4
+
+ SO4
2-
Como el SO4
2-
es una base débil, y el NH4
+
es un ácido fuerte, es éste quien sufre hidrólisis:
NH4
+
+ H2O D NH3 + H3O+
pH de la disolucion es ácido.
d) El hidroxido de bario es una base semifuerte que se disocia por la siguiente reaccion.
Ba(OH)2 à Ba2+
+ 2 OH-
Como se trata de de una base, su pH siempre es basico.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-346-320.jpg)
![MADRID / SEPTIEMBRE 98. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Se dispone de 100 mL de una disolución 0,01M de ácido clorhídrico, a la que se
añaden 17 mg de nitrato de plata.
a) Escriba la reacción que tiene lugar.
b) Determine si se producirá la precipitación de cloruro de plata (Ks = 1,8·10-10
)
DATOS: Masas atómicas: N = 14; O = 16; Ag = 108
Solución:
a) La reacción entre clorhídrico y la sal soluble de plata (AgNO3), puede dar lugar a la
aparición de un precipitado blanco de una sal insoluble de plata (AgCl):
HCl + AgNO3 t AgCl $ + HNO3
b) Para determinar si el cloruro de plata formado precipita, o no, se debe conocer la
concentración de iones Ag+
y Cl-
existente en disolución; para lo cual se han de calcular los
moles iniciales de los reactivos: HCl y AgNO3.
n HCl = 0,01 · 0,1 = 0,001 moles
n AgNO3 = 0,017 / 170 = 1· 10-4
moles
Las concentraciones reales de los iones cloruro y plata, suponiendo que el volumen de la
disolución permanece constante, serían:
[ Cl-
] = 0,001/ 0,1 = 10-2
mol/L
[Ag+
] = 1·10-4
/ 0,1 = 10-3
mol/L
El equilibrio de disociación de la sal insoluble será:
AgCl (s) D Ag+
(ac) + Cl-
(ac)
El producto iónico real correspondiente es este:
Q = [Ag+
]real · [ Cl-
]real = (10-3
) ·(10-2
) = 10-5
Como Ks = 1,8·10 -10
Se cumple que Q > Ks, y la sal sí precipita.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-347-320.jpg)

![MADRID / SEPTIEMBRE 99. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
PROBLEMA nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- El ácido benzoico (C6H5-COOH) es un buen conservante de alimentos ya que inhibe
el desarrollo microbiano, siempre y cuando el medio creado posea un pH inferior a 5.
Deduzca, mediante cálculos numéricos apropiados, si una disolución acuosa de ácido
benzoico de concentración 6,1 g⋅1-1
, es adecuada como líquido conservante.
Datos: Ka (C6H5-COOH) = 6,5⋅10-5
. Masas atómicas; C = 12,0; H = 1,0; O=16,0.
Solución:
Para saber si la disolución acuosa es adecuada como líquido conservante hemos de calcular su
pH.
El ácido benzoico se disocia según la reacción:
C6H5-COOH + H2O ⇔ C6H5-COO-
+ H3O+
C0 (1-α) c0α c0α
[ ][ ]
[ ] ( )α
αα
−
=
−
−
=
+−
1
..
0
00
56
356
c
cc
COOHHC
OHCOOHC
Ka
c0α2
= 6,5⋅10-5
c0 = 0,05 M
α = 0,036
[H3O+
] = c0⋅α = 0,0018 (0,18%)
pH = - log [H3O+
] = 2,74
Puesto que pH < 5, la disolución de ácido benzoico será adecuada como líquido conservante.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-349-320.jpg)


![MADRID / SEPTIEMBRE 99. COU / QUÍMICA / OBLIGATORIA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- a) Exprese la relación entre la solubilidad y el producto de solubilidad de una sal del
tipo AB2.
b) Razone cómo se verá afectada la solubilidad del yoduro de plomo (II) al añadir
yoduro potásico.
Solución:
a) El equilibrio de solubilidad de la sal insoluble se expresa así:
AB2 (s) λ A2+
(aq) + 2 B-
(aq)
s 2 s
Siendo s la solubilidad y Ks el producto de solubilidad.
Ks = [A2+
] · [B-
]2
= s · (2 s)2
= 4 s3
De donde.:
s = (Ks / 4)1/3
b) El equilibrio de solubilidad del yoduro de plomo (II) será:
PbI2 (s) λ Pb2+
(aq) + 2 I-
(aq)
Si se le añade KI , se está aumentando la concentración de iones I-
, luego el equilibrio
responderá en el sentido en que se oponga a esta alteración, es decir, disminuyendo la
solubilidad del yoduro de plomo (II).](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-352-320.jpg)


![MADRID / JUNIO98.LOGSE/ QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A / Nº
4
www.profes.net es un servicio gratuito de Ediciones SM
4.- Una mezcla gaseosa constituida inicialmente por 3,5 moles de hidrógeno y 2,5 moles de
yodo, se calienta a 400ºC con lo que al alcanzar el equilibrio se obtienen 4,5 moles de HI,
siendo el volumen del recipiente de reacción de 10 litros. Calcule:
a) El valor de las constantes de equilibrio Kc y Kp.
b) La concentración de los compuestos si el volumen se reduce a la mitad manteniendo
constante la temperatura de 400ºC.
Solución 4:
El equilibrio de formación del yoduro de hidrógeno es: H2 + I2 <--> 2HI
Las concentraciones iniciales de yodo e hidrógeno son:
[H2]0= 3,5/10 = 0,35 M
[I2]0 = 2,5/10 = 0,25 M
H2 + I2 <--> 2HI
concentración inicial: 0,35 0,25
concentración en el equilibrio: 0,35-x 0,25-x 2x
como [HI]eq= 0,45 mol/l 2x = 0,45 x = 0,225 M
Kc =
HI[ ]2
H2[ ] I2[ ]
=
0,452
0,125( )⋅ 0,025( )
= 64,8
n
)RT(KcKp ∆
=
como sólo se tienen en cuenta los moles gaseosos:
∆ = 2 − 2 = 0 Kp=Kc=64,8
b) Si la temperatura permanece constante, el valor de las constantes de equilibrio no varía. Al
reducirse el volumen a la mitad, las concentraciones iniciales son:
[H2]= 3,5/5 = 0,7 M
[I2] = 2,5/5 = 0,5 M
el equilibrio se estudia de manera análoga al apartado anterior:
H2 + I2 <--> 2HI
concentración inicial: 0,7 0,5](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-355-320.jpg)
![MADRID / JUNIO98.LOGSE/ QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A / Nº
4
www.profes.net es un servicio gratuito de Ediciones SM
concentración en el equilibrio: 0,7-x´ 0,5 –x´ 2x´
64,8 = 2x´ / (0,7-x´) · (0,5-x´) x´ = 0,45
Las concentraciones en el equilibrio son:
[H2] = 0,7 –0,45 = 0,25 M
[I2] = 0,5 –0,45 = 0,05 M
[HI] = 0,9 M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-356-320.jpg)
![MADRID / JUNIO98.LOGSE/ QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A / Nº
5
www.profes.net es un servicio gratuito de Ediciones SM
5.- En un laboratorio se tienen dos matraces, uno conteniendo 15ml de HCl cuya
concentración es 0,05 M y el otro 15 ml de ácido etanoico (acético) de concentración
también 0,05 M.
a)Calcule el pH de cada una de ellas.
b) ¿Qué cantidad de agua se debe añadir a la más ácida para que el pH de las dos
disoluciones sea el mismo?.
Solución 5:
El HCl es un ácido fuerte, por lo que se le considera completamente disociado.
HCl + H2O <--> Cl-
+ H3O+
El ácido etanoico es débil, como se ve en su Ka = 1,8·10-5
, y estará parcialmente disociado:
CH3—COOH + H2O <--> CH3—COO-
+ H3O+
El pH se define como –log[H3O+
].
Calculo el pH del HCl.
Como es un ácido fuerte, y según su reacción de disociación: [H3O+
]= 0,05 M
pH=-log[H3O+
] = 1,3
Para el CH3—COOH el tratamiento es el de un equilibrio y sustituyendo los valores en la
expresión de Ka :
]O[HC
]O[H
COOH]-[CH
]O][HCOO-[CH
Ka
30
2
3
3
3
-
3
+
++
−
==
Se hace la siguiente aproximación:
C0 ≈ C0 − H3 0
+
[ ]
De donde [H3O+
] = 10-3
M
pH =3,0
b) Para que la disolución de HCl tenga el mismo pH, es decir pH = 3,0 [H3O+
]=10-3
M
[HCl] = 10-3
M
Luego hay que pasar de un ácido 0,05 M a otro más diluido 0,001 M, es decir diluir el HCl
concentrado 50 veces. Por tanto el volumen final será 50 veces el volumen inicial (15 mL)
V final = 50 · 15 = 750 mL
Suponiendo que los volúmenes son aditivos: 750 – 15 = 735 mL](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-357-320.jpg)

![MADRID / JUNIO 98.COU / QUIMICA / CINÉTICA Y EQUILIBRIO/ OPCION A / Nº 2
2.- Se sabe que 100 ml de una de una disolución de ácido oxoclorato de hidrógeno
(ác.hipocloroso) que contiene 1,05 gramos, tiene un pH de 4,1.
Calcule:
a) La constante de disociación del ácido.
b) El grado de disociación.
Datos: Masas atomicas Cl = 35,5 ; O = 16 ; H = 1
Solución :
a) El peso molecular del ácido oxoclorato de hidrogeno es de 52,5 g/mol, por lo que si la
disolución contiene 1,05 g el nº de moles será:
1,05 g
nHClO = = 0,0200 mol.
52,5 g/mol
Como esta cantidad de moles esta disuelta en 100 mL, que son 0,1 litros, la concentración será:
0,02 mol
[HClO] = = 0,200 M
0,1 L
Conocido el pH de la disolución, podemos hallar la concentración de iones H3O+
:
pH = 4,1
4,1 = - log [H3O+
]
[H3O+
] = 7,9·10-5
M
Conocidas las concentraciones escribimos el equilibrio de disociación:
HClO + H2O D ClO-
+ H3O+
Co 0,2 0 0
Ceq (0,2-7,9·10-5
) 7,9·10-5
7,9·10-5
Sustituyendo en la expresión de la constante de acidez:
[ClO-
]· [H3O+
] (7,9·10-5
)2
Ka = =
[HClO] 0,2 - 7,9·10-5](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-359-320.jpg)





![CASTELLÓN / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
PROBLEMA 1
www.profes.net es un servicio gratuito de Ediciones SM
Problema
1.- El ácido cis- cinámico (que es un ácido monoprótico que se puede simbolizar como
HCin, por ejemplo) tiene Ka = 1,3·10-4
. Se disuelven 2,96 g de este ácido en agua, hasta
obtener 200 ml de disolución, cuyo pH es 2,45. Calcular el peso molecular del ácido cis-
cinámico.
Solución:
Como el pH = 2,45, se calcula la concentración de protones en el equilibrio, ya que:
pH = -log [H3O+
]
Obteniendose: [H3O+
]= 3,55·10-3
M
El equlibrio de disociación del ácido dado sería:
HCin + H2O H3O+
+ Cin-
[ ]inic. Ci -- --
[ ]equil. Ci - 3,55·10-3
3,55·10-3
3,55·10-3
Y sustituyendo en la expresión de la constante de acidez, cuyo valor es conocido:
Ka = 1,3·10-4
= ([H3O+
] · [Cin-
]) / [HCin ] = ((3,55·10-3
)2
/ (Ci -3,55·10-3
))
De donde:
Ci = 0,10 M
Al conocer la concentración inicial de ácido, la masa de ácido disuelta, y el volumen de agua
empleado, se calcula la masa molecular de dicho ácido:
M = (m / Mm) / V
0,10 = (2,96 / Mmolec.) / 0,2
Mm HCin = 148 g /mol](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-365-320.jpg)
![CASTELLÓN / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
Problema
2.- Se disuelven 0,117 g de cloruro de sodio en 200 ml de agua. A esta disolución se le
añaden 10 ml de otra disolución acuosa de AgNO3 0,02 M, con lo que precipita cloruro
de plata. Calcular la masa que se obtiene de AgCl.
Datos: Kps (AgCl) = 1,78310-10
.
Masas atómicas relativas: Ag = 107,9, Cl = 35,5; Na = 23.
Solución:
Con la masa de sal que se da como dato, y la masa molecular que se calcula a partir de las
masas atómicas del sodio y el cloro, se determinan los moles de NaCl; y posteriormente, con
el volumen total (200 + 10 = 210 mL) pasado a litros, su concentración molar:
n NaCl = 0,117 / 58,5 = 0,002 = 2·10-3
moles
M NaCl = 2·10-3
/ 0,210 = 9,5·10-3
moles / L
Esta concentración de NaCl, coincide con la de sus iones, pues es una sal soluble totalmente
disociada.
[Cl-
] = [Na+
] = 9,5·10-3
moles / L
Ahora para el AgNO3 la nueva molaridad al realizar la mezcla de las dos disoluciones es:
n AgNO3 = V · M = 0,01 · 0,02 = 2·10-4
moles
[AgNO3] = (0,02 · 0,01) / 0,210 = 9,5·10-4
M
Esta es una sal soluble y esta también totalmente disociada por lo que:
[Ag+
] = 9,5·10-4
M
La sal formada es AgCl, poco soluble, luego disociada parcialmente:
AgCl (s) Ag+
(ac) + Cl-
(ac)
Y su producto iónico es:
[Ag+
]·[ Cl-
] = (9,5·10-3
) · (9,5·10-4
) = 9,0·10-6
Como este valor resulta mayor que el producto de solubilidad (Kps = 1,78·10-10
), la sal
precipitará, depositándose en el fondo del recipiente todos los iones plata de la disolución
original de AgNO3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-366-320.jpg)


![ALICANTE / JUNIO 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCION B /
EJERCICIO 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- A 480ºC y 1 atm de presión, el amoníaco (NH3) está disociado en un 66% dando H2 y
N2. Calcular : a) El valor de la constante de equilibrio (Kp) a 480ºC. b) Las presiones
parciales de cada componente cuando, a 480ºC, se aumenta la presión hasta 20 atm.
Justifique cualquier aproximación que realice y razone el resultado obtenido.
Solución:
a) La reacción que tiene lugar es la siguiente:
2 NH3 (g) ⇔ N2 (g) + 3 H2 (g)
n inic. 2n0
n reacc. 2n0α
n eq. 2n0(1-α) n0α 3n0α
Si llamamos n0 al nº de moles iniciales de NH3 y α al grado de disociación del NH3, el nº de
moles en el equilibrio de cada sustancia, es el indicado en la reacción, y el nº total de moles
será la suma:
nT = 2n0(1-α) + n0α + 3n0α = 2n0 (1+α)
Teniendo en cuenta que PT = 1 atm, las presiones parciales en equilibrio serán:
PNH3 = [(1-α)/ (1+α)]⋅ PT = 0,205 atm
PN2 = [α / 2(1+α)]⋅ PT = 0,199 atm
Ph2 = [3α / 2(1+α)]⋅ PT = 0,596 atm
Aplicando la L.A.M al caso de Kp tendríamos:
Kp = (PN2 ⋅ P3
H2) / P2
NH3 = [ 0,199 · (0,596)3
] / (0,205)2
= 1,0025 atm2
b) Al aumentar la presión el equilibrio se desplaza hacia el miembro de menor volumen, es
decir, hacia la izquierda, por lo que la disociación de NH3 será menor, α debe disminuir.
Si la expresión de Kp es: Kp = (PN2 ⋅ P3
H2) / P2
NH3 ≈ 1 (ya que T no varía)
Sustituyendo en dicha expresión los valores de las presiones parciales y simplificando queda:
[3α2
PT
2
] / [4 (1+α)2
(1-α)2
] = 1](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-369-320.jpg)
![ALICANTE / JUNIO 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCION B /
EJERCICIO 2
www.profes.net es un servicio gratuito de Ediciones SM
Como PT = 20 atm resulta la expresión:
300α2
= 1+ α4
+ 2α2
α4
- 298α2
+ 1 = 0
Si x = α2
x2
- 298x +1 = 0
x = 0,0033
α = 0,058 (5,8 %)
Las presiones parciales de cada sustancia serán ahora: (PT = 20 atm)
PNH3 = [(1-α)/ (1+α)]⋅ PT = 17,8 atm
PN2 = [α / 2(1+α)]⋅ PT = 0,55 atm
Ph2 = [3α / 2(1+α)]⋅ PT = 1,65 atm](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-370-320.jpg)



![COMUNIDAD VALENCIANA / JUNIO 02. LOGSE / QUÍMICA / TERMOQUÍMICA /
BLOQUE A / PROBLEMA Nº 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Se dispone de 80 ml de una disolución 0,15 M de ácido clorhídrico, disolución A, y de
100 ml de una disolución 0,1 M de hidróxido de sodio, disolución B. Se quiere saber:
a) El pH de la disolución A.
b) El pH de la disolución B.
c) Si se mezclan las dos disoluciones, ¿cuánto valdrá el pH de la resultante?
Solución:
a) Se escribe la disociación total del ácido fuerte, teniendo en cuenta que por ello la
concentración inicial de ácido será la misma que la final de los iones:
HCl + H2O τ H3O+
+ Cl-
[ ]inicial 0,15 -- --
[ ]final -- 0,15 0,15
Por la definición de pH se tiene:
pH = - log [H3O+
] = 0,82
b) Con el hidróxido de sodio, como base fuerte:
NaOH τ Na+
+ OH-
[ ]inicial 0,1 -- --
[ ]final -- 0,1 0,1
Ahora se determina el pOH, y a continuaciónel pH:
pOH = - log [OH-
] = 1
pH = 14 - 1 = 13
c) Al mezclar el ácido con la base, se forma una sal neutra, pues procede de ácido y base
fuertes, pero al determinar el número de moles que reaccionará de las dos especies, se tiene
que el HCl está en exceso, luego sobrarán protones, y la mezcla tendrá carácter ácido:
moles HCl = 0,08 · 0,15 = 0,012 moles
moles NaOH = 0,1 · 0,1 = 0,01 moles
HCl + NaOH τ NaCl + H2O](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-374-320.jpg)
![COMUNIDAD VALENCIANA / JUNIO 02. LOGSE / QUÍMICA / TERMOQUÍMICA /
BLOQUE A / PROBLEMA Nº 1
www.profes.net es un servicio gratuito de Ediciones SM
Moles iniciales 0,012 0,01 -- --
Moles finales 0,002 -- 0,01
Con los moles de ácido sobrantes, se escribe de nuevo la reacción de disociación:
HCl + H2O τ H3O+
+ Cl-
n inicial 0,002 -- --
n final -- 0,002 0,002
Luego la concentración de protones presente en el volumen total será:
[H3O+
] = 0,002 / 180 = 0,011 M
De nuevo, por la definición de pH se tiene:
pH = - log [H3O+
] = 1,95
Como era de esperar, el pH corresponde a una disolución ácida.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-375-320.jpg)

![CASTELLÓN / JUNIO 98. COU / QUÍMICA /CINÉTICA Y EQUILIBRIO /OPCIÓN A/
Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- A una disolución que contiene 50 mL de HCl 0,1 M se le van añadiendo cantidades
sucesivas de volúmenes de NaOH 0,1 M. Calcular: a) El pH inicial, antes de la adición de
la base. b) El pH después de la adición de 10 mL, 49,99 mL, 50 mL, 50,01 mL y 75 mL de
base.
Solución:
a) En primer lugar calculamos el pH inicial de la disolución de HCl 0,1M. Puesto que se trata de
un ácido muy fuerte, se encuentra totalmente disociado:
HCl + H2O → H3O+
(aq ) + Cl-
(aq)
Por lo tanto: [H3O+
] = 0,1 M
pH = -log (0,1) = 1
b) Como las disoluciones de ácido y de base tienen la misma molaridad, al añadir a los 50 mL de
HCl 0,1 M, 10 mL de NaOH 0,1 M, puede decirse que van a quedar 50 - 10 = 40 mL de HCl 0,1
M sin neutralizar.
n = M⋅V =0,1⋅40⋅10-3
= 4⋅10-3
mol HCl
Estos moles estarían contenidos en un volumen de disolución de 50 + 10 = 60 mL, con lo cual la
molaridad de esta nueva disolución y su pH serán:
M=
V
n
= 3
3
10·60
10·4
−
−
=0,067M
[HCl] = [H+
] = 0,067 M
pH = -log (0,067) = 1,2
Cuando añadimos 49,9mL de NaOH, quedan sin neutralizar: n = 10-6
mol HCl
[H+
]= 3
6
10·99,99
10
−
−
≈ 10-5
M
pH = - log 10-5
= 5](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-377-320.jpg)
![CASTELLÓN / JUNIO 98. COU / QUÍMICA /CINÉTICA Y EQUILIBRIO /OPCIÓN A/
Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
Al añadir 50 mL de NaOH no queda nada sin neutralizar, por tanto pH = 7
Cuando añadimos 50,01 mL de NaOH, quedan sin neutralizar: n =10-6
mol NaOH
[OH-
]= 3
6
10·01,100
10
−
−
=9.99·10-6
M
pOH = 5
pH =14 – pOH = 9
Al añadir 75 mL de NaOH quedan sin neutralizar: n = 2,5⋅10-3
mol NaOH
[OH-
]= 3
3
10·125
10·5,2
−
−
=0.02M
pOH = -log (0,02) =1,7
pH = 14 – 1,7 =12,3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-378-320.jpg)
![CASTELLÓN / JUNIO 98. COU / QUÍMICA /CINÉTICA Y EQUILIBRIO OPCIÓN A/
Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- La solubilidad del iodato de plomo (II) en agua destilada es 1,11·10-2
g/L a 25ºC.
Calcular: a) El producto de solubilidad del iodato de plomo (II) a 25 ºC. b) La concentración
de los iones iodato y plomo en una disolución saturada a 25 ºC.
Datos: Masas atómicas relativas: Pb = 207,19 ; I = 126,9 ; 0 = 16.
Solución:
El iodato de plomo (II) tiene el siguiente equilibrio de solubilidad:
Pb(IO3)2 (s) ⇔ Pb2+
(aq) + 2 IO3
-
(aq)
Su producto de solubilidad es: Ks = [Pb2+
] ⋅ [IO3
-
]2
Poniendo Ks en función de la solubilidad, como se cumple que:
[Pb2+
] = s ; [IO3
-
] = 2s
Ks = s ⋅ (2s)2
= 4s3
La solubilidad nos la dan en g/L y se debe expresar en mol/L
Luego s = 1,99·10-5
mol/L
Sustituyendo en la expresión de Ks resulta:
Ks = 4s3
= 4 · (1,99⋅10-5
)3
= 3,15·10-14
b) [Pb2+
] = s = 1,99⋅10-5
M
[IO3
-
] = 2s = 3,98⋅10-5
M
5
2
10·99,1
557
10·11,1
.
/
/ −
−
===
molecularM
Lg
Lmol](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-379-320.jpg)
![COMUNIDAD VALENCIANA / JUNIO 99. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / PROBLEMA nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- El compuesto NH2CO2NH4 (s) se descompone el calentarlo según la reacción:
NH2CO2NH4 (s) D CO2 (g) + 2 NH3 (g)
En un recipiente, en el que previamente se ha hecho el vacío, se calienta una cierta
cantidad del compuesto sólido y se observa que la presión total del gas en el equilibrio es
0,843 atm a 400 K.
a) Calcular Kp y Kc para el equilibrio presentado.
b) Calcular la cantidad (en moles) del compuesto sólido que quedará sin descomponer si
se introduce 1 mol en un recipiente vacío de 1 litro y se calienta hasta 400 K.
Datos: R= 0,082 atm·L/(K·mol)
Solución:
a) Al ser doble el número de moles de amoniaco que de dióxido de carbono, su presión parcial
también lo será:
x + 2x = 0,843 atm
x = 0,281 atm
P(CO2) = 0,281 atm P(NH3) = 0,562 atm.
Kp = P(CO2)· P(NH3)2
Kp = 0,281 · (0,562)2
= 8,9·10-2
Kp = Kc · (RT) ∆n
∆n = 3, por lo tanto: Kc = 8,9 ·10-2
/ (0,082 · 400)3
= 2,5 ·10-6
b) Si llamamos x al número de moles descompuestos, tenemos:
NH2CO2NH4 (s) D CO2 (g) + 2NH3 (g)
Moleso 1
Molesr x
Moleseq 1−x x 2x
Kc = [CO2] · [NH3]2
2,5·10-6
= (x / 1) · (2x / 1)2
= 4x3
x = 8,5·10-3
mol
Por lo tanto, la cantidad de sólido que queda sin descomponer será:
1−x = 1 − 8,5·10-3
= 0,9915 moles](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-380-320.jpg)






![CASTELLÓN / JUNIO 99.COU / QUIMICA / CINÉTICA Y EQUILIBRIO /
PROBLEMA Nº2
www.profes.net es un servicio gratuito de Ediciones SM
2.- a) El intervalo de viraje del indicador ácido-base naranja de metilo es, a pH entre 3,1
y 4,4, rojo-amarillo, y, el de la fenolftaleina, a pH entre 8,2 y 10, incoloro-rosa.¿Por qué
ambos se pueden utilizar en la valoraciones de ácido fuerte (como HCl) con base fuerte
(como el NaOH), cuyo pH de equivalencia es pH = 7, si a ese pH el primero es ya
amarillo y el segundo aún es incoloro?
b) El azul de bromotimol vira en un intervalo de pH entre 6 y 7,6 (amarillo-azul).Por
tanto, parece en principio más adecuado como indicador para las valoraciones
HCl / NaOH que los anteriores. Si estamos valorando 50 mL de HCl 0,2 M con NaOH
0,2 M, calcula el pH de la disolución de HCl 0,2M y el volumen de NAOH que se ha de
añadir cuando:
b.1) Se alcanza el punto de equivalencia, esto es, se ha neutralizado todo el ácido y el pH
es 7.
b.2) Se alcanza el punto final de la valoración empleando como indicador el naranja de
metilo, es decir, cuando la disolución es de color amarillo y el pH es 4,4.
b.3) Se alcanza el punto final de la valoración empleando como indicador la
fenolftaleina, es decir, cuando la disolución empieza a adquirir tonalidad rosa pálido y el
pH es 8,2.
b.4) Se alcanza el punto final de la valoración empleando como indicador el azul de
bromotimol, es decir, cuando la disolución es de color azul y el pH es 7,6.
Solución:
a) En las valoraciones de ácido fuerte con base fuerte, en las proximidades del punto de
equivalencia hay un gran salto de pH aproximadamente de pH = 3 a pH = 10, y en este
intervalo el naranja de metilo vira, a rojo y la fenolftaleina, vira a rosa.
b.1) En las valoraciones de HCl / NaOH la normalidad del ácido y la base es igual, por lo que
para alcanzar el punto de equivalencia el pH tiene que ser 7, por lo que habrá que añadir el
mismo volumen de NaOH que volumen de HCl que tengamos, en este caso V = 50 mL
b.2) Si el pH = 4,4 significa que [H3O+
] = 4,0 · 10-5
M, como la concentración de iones
hidrónio es muy pequeña, nos indica que estamos muy cerca del punto de equivalencia, por lo
tanto está neutralizado casi todo el HCl, es decir hemos añadido casi 50 mL de la disolución
de NaOH, por lo que el volumen total de la disolución es aproximadamente 100 mL, quedarán
por lo tanto sin neutralizar x mL de HCl 0,2 M
[H3O+
] = 4,0·10-5
M = 0,2 M · x mL / 100 mL
x mL = 4,0·10-5
· 100 / 0,2 = 0,02 mL
Se han añadido exactamente 50-0,02 = 49,98 mL de la disolución de NaOH.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-387-320.jpg)
![CASTELLÓN / JUNIO 99.COU / QUIMICA / CINÉTICA Y EQUILIBRIO /
PROBLEMA Nº2
www.profes.net es un servicio gratuito de Ediciones SM
b.3) Si el pH = 8,2, será: pOH = 14 – pH = 14 – 8,2 = 5,8
[OH-
] = 1,6·10-6
M.
Esta concentración nos indica que nos hemos pasado un poco del punto de equivalencia, por
lo que hay iones hidroxilo en exceso, queda un volumen x de NaOH 0,2 M en exceso:
[OH-
] = 1,6·10-6
M = 0,2 M · x mL / 100 mL
x mL = 1,6·10-6
· 100 / 0,2 = 8 · 10-4
mL, por lo que el volumen exacto añadido es de:
50 + 8·10-4
mL = 50,0008 mL
b.4) Del mismo modo que en el apartado b.3), el volumen exacto de NaOH añadido resulta
[OH-
] = 10-6,4
M = 0,2 M · x mL / 100 mL;
x mL = 10-6,4
· 100 / 0,2 = 2·10-4
mL
Volumen añadido = 50 + 0,0002 = 50,0002 mL.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-388-320.jpg)
![COMUNIDAD VALENCIANA / SEPTIEMBRE 00. LOGSE / QUIMICA / CINETICA Y
EQUILIBRIO/ OPCION A / CUESTION 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Determine la Kp a 1120 K del equilibrio químico representado por
C (s) + CO2 (g) + 2 Cl2 (g) • 2 COCl2 (g)
A partir de las constantes de equilibrio siguientes, a 1120 K:
C (s) + CO (g) • 2 CO (g) Kp1 = 1,3·1014
COCl2 (g) • CO (g) + Cl2 (g) Kp2 = 1,667·102
Solución:
La reacción en cuestión se obtendría a partir de las otras dos reacciones:
C (s) + CO (g) • 2 CO (g)
(-2) [ COCl2 (g) • CO (g) + Cl2 (g) ]
C (s) + CO2 (g) + 2 Cl2 (g) • 2 COCl2 (g)
La ley de Acción de Masas en la versión de Kp es la siguiente:
Kp =
22
2
2
2
· ClCO
COCl
PP
P
Kp1 =
2
2
CO
CO
P
P
y Kp2 =
2
2
·
COCl
ClCO
P
PP
A partir de estas expresiones se obtiene que:
Kp = Kp1 / (Kp2)2
Kp = 1,3·1014
/ (1,667·102
)2
= 4,678·109](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-389-320.jpg)
![COMUNIDAD VALENCIANA / SEPTIEMBRE 00. LOGSE / QUIMICA / CINETICA Y
EQUILIBRIO /OPCION A / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Disponemos de un vaso que contiene 100 mL de disolución 0,15 M de KOH (base
fuerte) y otro vaso que contiene 100 mL de disolución 0,15 M de NH3 (Kb = 1,8·10-5
)
a) Calcule el pH y la concentración de todas las especies presentes en el equilibrio en
ambas disoluciones.
b) Escriba las reacciones de neutralización de ambas bases con ácido clorhídrico
(HCl).Calcule el volumen de disolución 0,45 M de HCl necesario para neutralizar
cada una de las disoluciones KOH y NH3.
Solución:
a) Disolución de KOH 0,15 M V = 100 mL
El hidróxido potásico es una base fuerte que en disolución acuosa se disocia completamente:
KOH → K+
+ OH-
En la disolución aumenta la concentración de iones hidroxilo, este aumento de concentración
influirá en el valor de pH.
[OH-
] = 0,15 M
pOH = - log [OH-
] = - log (0,15) = 0,83
A partir del producto de ionización del agua sabemos que:
pH + pOH = 14
pH = 14 – pOH = 14 – 0,82 = 13,17 (muy básico)
Disolución de NH3 0,15M V = 100 mL Kb = 1,8·10-5
El amoniaco es una base débil, lo comprobamos con el valor de la constante de basicidad, el
equilibrio de hidrólisis es:
NH3 + H2O • NH4
+
+ OH-
Inicialmente 0,15 --- ---
Reacciona x --- ---
Equilibrio 0,15 – x x x
Aplicando la ley del equilibrio se tiene:
Kb =
[ ][ ]
[ ]3
4
NH
OHNH −+
1,8·10-5
= x2
/ (0,15 – x)](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-390-320.jpg)
![COMUNIDAD VALENCIANA / SEPTIEMBRE 00. LOGSE / QUIMICA / CINETICA Y
EQUILIBRIO /OPCION A / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
Se obtienen dos valores de x, uno negativo que no tiene sentido químico, y el otro valor
positivo:
x = 1,63·10-3
[OH-
] = 1,63·10-3
mol/L
pOH = -log [OH-
] = -log (1,63·10-3
) = 2,78
Como en el caso anterior a partir del producto iónico del agua se obtiene
pH = 14 – 2,78 = 11,22 (básico)
b) En una reacciónde neutralizaciónel número de equivalentes de ácido es igual al número de
equivalentes de base.
La neutralización se representa así: H3O+
+ OH-
• 2 H2O
Cada mol de iones hidronio se neutraliza con un mol de iones hidroxilo.
En el caso de la base fuerte KOH (valencia = 1):
N · V = N’ · V’
0,15 · 0,1 = 0,45 · V’
V’ (HCl) = 3,3·10-4
L = 0,33 mL
En el caso de la base débil NH3 , el resultado será:
[OH-
] = 1,63·10-3
mol/L
n OH-
= M · V= 1,63·10-3
· 0,1 = 1,63·10-4
moles
Se necesitan, por tanto: n H3O+
= 1,63·10-4
moles
Lo cual supone una cantidad de moles igual del ácido fuerte:
[HCl] = 1,63·10-4
moles
Como tenemos un ácido HCl que es 0,45 M:
n = V · M
1,63·10-4
= V · 0,45
V = 3,62 · 10-4
L = 0,362 mL HCl](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-391-320.jpg)




![COMUNIDAD VALENCIANA / SEPTIEMBRE 03. LOGSE/ QUÍMICA / CINÉTICA Y
EQUILIBRIO/ BLOQUE A / PROBLEMA Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
PROBLEMA 4.-
La constante de ionización del ácido fórmico (HCOOH) es de 1,77·10-4
. Calcular:
a) El pH de la disolución formada al disolver 0,025 g de ácido fórmico en 500 mL de
agua.
b) El pH de la disolución resultante al añadir 50 mL de ácido clorhídrico 0,02 M a 0,1 L
de la disolución anterior.
DATOS: Masas atómicas: H: 1; C: 12; O: 16
Solución:
Se escribe el equilibrio de disociación del ácido débil dado, llamando x a la cantidad
disociada en el equilibrio. Se determina la concentración inicial de ácido hallando los moles
contenidos en los 0,025 g, y dividiéndolos entre el volumen de agua tomado:
Moles HCOOH = 0,025 / 46 = 5,4 · 10-4
M = 5,4 · 10-4
/ 0,5 = 1,08 · 10-3
HCOOH + H2O ‡ HCOO-
+ H3O+
[ ]inicial 1,08 · 10-3
-- --
[ ]equil. 1,08 · 10-3
- x x x
La expresión de la Kc para el caso dado es:
Kc = ([HCOO-
] · [H3O+
]) / [HCOOH]
Kc = x2
/ (1,08 · 10-3
- x) = 1,77 · 10-4
De donde se tiene:
x = 3,58 · 10-4
M = [H3O+
]
Y recordando la expresión de pH:
pH = - log [H3O+
] = 3,44
Es menor que 7, como era de esperar la disolución es ácida.
b) El ácido que ahora se añade es fuerte, luego está totalmente disociado en sus iones,
aportando a la mezcla:
moles de HCl = 0,02 · 0,05 = 0,001 moles = 0,001 moles de H3O+](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-396-320.jpg)
![COMUNIDAD VALENCIANA / SEPTIEMBRE 03. LOGSE/ QUÍMICA / CINÉTICA Y
EQUILIBRIO/ BLOQUE A / PROBLEMA Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
La nueva concentración de protones será:
[H3O+
]nueva = moles totales de H3O+
/ V total
[H3O+
]nueva = (1,08 · 10-4
moles de protones aportan los 0,1 L de HCOOH + 0,001 moles
de protones aporta el HCl) / (0,05 + 0,1)
[H3O+
]nueva = 7,38 · 10-3
M
Luego como ya se sabe:
pH = - log [H3O+
]nueva = 2,47
Es una disolución más ácida que la inicial, pues se le ha adicionado un ácido fuerte.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-397-320.jpg)
![COMUNIDAD VALENCIANA / SEPTIEMBRE 99. LOGSE / QUÍMICA / CINÉTICA
Y EQUILIBRIO / OPCIÓN A / CUESTIÓN Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Razonar si son ciertas o falsas las siguientes afirmaciones referidas a una disolución
acuosa de amoníaco a la que se le añade cloruro de amonio:
A) El grado de disociación del amoníaco disminuye.
B) El pH de la disolución aumenta.
Solución:
A) Verdadera. Al añadir cloruro de amonio, introducimos un exceso de ión amonio y por
efecto del ión común, el equilibrio de disociación del amoniaco se desplaza hacia la izquierda.
NH3 + H2O D NH4
+
+ OH-
Con lo cual el grado de disociación del amoniaco disminuye.
B) Falsa. Al desplazarse este equilibrio hacia la izquierda disminuye la concentración de iones
OH-
en el medio, por lo que aumenta proporcionalmente la de iones H3O+
, disminuyendo así
el pH de la disolución amoniacal ( pH = -log [H3O+
] ).](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-398-320.jpg)

![COMUNIDAD VALENCIANA / SEPTIEMBRE 99. LOGSE / QUÍMICA / CINÉTICA
Y EQUILIBRIO / OPCIÓN B / PROBLEMA N º 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- El pH de 1 litro de disolución de sosa cáustica (NaOH) es 13.
a) Calcular los gramos de álcali utilizados en prepararla.
b) ¿Qué volumen de agua hay que añadir al litro de disolución anterior para que su pH
sea de 12? Suponer los volúmenes aditivos.
Datos: Ar(Na) = 23 ; Ar(O) = 16 ; Ar(H) = 1
Solución:
a) Patimos del valor del pH de la disolución:
pH =14 – pOH = 13 pOH = 1
pOH = - log [ OH-
]
[ OH-
] = 10 – pOH
= 10-1
= 0,1 M
La sosa es una base fuerte, es decir totalmente disociada, eso supone conocer la concentración
inicial de sosa:
NaOH (aq) à Na+
+ OH-
[NaOH] = 0,1 M M(NaOH) = 40
n NaOH = V · M = 1· 0,1 = 0,1 moles
m NaOH = 0,1 · 40 = 4 g NaOH
b) [OH-
] inicial = 0,1 M
pH = 12
pOH = 14 –12 = 2
[OH-
] final = 10 –2
= 0,01 M
M = n / V
0,01 = (0,1·1) / (1 + x)
x = 9 l (Hay que añadir 9 litros de H2O a la disolución anterior).](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-400-320.jpg)
![COMUNIDAD VALENCIANA / SEPTIEMBRE 99. LOGSE / QUÍMICA / CINÉTICA
Y EQUILIBRIO / OPCIÓN B / PROBLEMA N º 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- CO2 (g) + C (g) D 2 CO (g)
A 817º C la constante Kp para la reacción entre el CO2 puro y el grafito caliente es 10.
Calcular:
a) La presión parcial del CO si en el equilibrio a 817ºC la presión total es de 4
atmósferas.
b) La fracción molar de CO2 en el equilibrio anterior.
c) La Kc a 817ºC.
Solución:
a) Se realiza la tabla del equilibrio heterogéneo suponiendo n moles del reactivo gaseoso:
CO2 (g) + C (s) D 2 CO (g)
no n cte
nr nx cte
neq n(1-x) cte 2nx
nt gases = n(1–x) + 2nx = n(1+x)
P CO2 = [n(1-x) / n(1+ x)] · PT
P CO = [2nx / n(1+ x)] · PT
Kp = (PCO)2
/ (PCO2)
10 = (4x2
) / (1-x2
) · 4
x = 0,62 (luego se disocia un 62%)
PCO = [(2 · 0,62) / 1,62] · 4 = 3,06 atm
b) X CO2 = (1 - 0,62) / (1 + 0,62) = 0,234
c) Kp = Kc · (R · T) ∆n
∆n = 2 – 1 = 1
Kc = 10 / (0,082·1090) = 0,11 mol/l](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-401-320.jpg)
![ALICANTE / SEPTIEMBRE 99. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN B / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
B1.- A 25ºC una disolución acuosa de amoniaco 0,01M esta ioniza en un 4,1%. Calcular:
a) La concentración de los iones OH-
y NH4
+
y del amoniaco molecular.
b) El pH de la disolución.
c) La constante de ionización para el amoniaco acuoso.
d) La concentración de OH-
después de añadir 0,009 moles de NH4Cl a un litro de la
disolución inicial.
Justificar todas las aproximaciones realizadas y los resultados obtenidos.
Solución:
Se escribe el equilibrio de disociación del amoníaco acuoso (hidróxido de amonio),
especificando las concentraciones iniciales, y en el equilibrio de todas las especies, sabiendo
que el grado de disociación es del 4,1%, o lo que es lo mismo, del 0,041:
NH3 + H2O NH4
+
+ OH-
[ ]inic. 0,01 -- --
[ ]equil. 0,01·(1 – 0,041) 0,01·0,041 0,01·0,041
a) Ya se pueden conocer las concentraciones en el equilibrio pedidas:
[NH4
+
] = [OH-
] = 4,1·10-4
M
[NH3] = 9,6·10-3
M
b) Con la [OH-
] se determina el pOH de la disolución, y con él, el pH:
pOH = -log [OH-
] = -log [4,1·10-4
] = 3,38
pH = 14 – pOH = 10,62
Como era de esperar, la disolución tiene un pH superior a 7, confirmando su basicidad.
c) La constante de ionización, que en este caso, al ser de una base, denominamos Kb, se
define como el cociente entre el producto de las concentraciones de los productos, elevadas a
sus coeficientes estequiométricos, entre el de las concentraciones de reactivos, elevadas a los
suyos:
Kb = ([NH4
+
]· [OH-
]) / [NH3]
Kb = (4,1·10-4
)2
/ 9,6·10-3
= 1,75·10-5](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-402-320.jpg)
![ALICANTE / SEPTIEMBRE 99. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN B / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
d) Se añade una sal, totalmente disociada en sus iones, y que posée un ión en común con la
base anterior, lo cual va a hacer que el equilibrio se desplace hacia la izquierda, para tratar de
oponerse a la modificación introducida:
Como se conocen los moles de sal añadidos, y el volumen de la disolución final es 1 L, se
escriben las concentraciones inicial y final de la sal:
NH4Cl δ NH4
+
+ Cl-
[ ]inic. 0,009 -- --
[ ]final -- 0,009 0,009
Aplicando el efecto del ión común al equilibrio se tiene:
NH3 + H2O NH4
+
+ OH-
[ ]inic. 9,6·10-3
4,1·10-4
+ 0,009 4,1·10-4
[ ]equil. 9,6·10-3
- x (4,1·10-4
+ 0,009) + x 4,1·10-4
+ x
Se ha llamado x a la cantidad de base disociada como consecuencia del nuevo estado del
equilibrio.
Como la temperatura no se ha modificado, Kb permanece constante, lo que nos permite hallar
x, y así la nueva concentración de iones OH-
:
[(4,1·10-4
+ 0,009) – x] · [4,1·10-4
- x] / [ 9,6·10-3
+ x ] = 1,75·10-5
x = - 3,9·10-4
(el valor negativo indica el desplazamiento del equilibrio hacia la izquierda).
[OH-
] = 4,1·10-4
- 3,9·10-4
= 1,2·10-4
pOH = - log (1,2·10-4
) = 3,92
pH = 14 - 3,92 = 10,07](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-403-320.jpg)
![COMUNIDAD VALENCIANA / JUNIO 98. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / PROBLEMA 1
www.profes.net es un servicio gratuito de Ediciones SM
1.-En un recipiente cerrado de 10 litros en el que se ha hecho el vacio se introducen 0,2
moles de H2 y 0,2 moles de I2. Se mantiene la temperatura de 440ºC, alcanzándose el
equilibrio:
H2(g)+ I2(g) ↔ 2HI (g)
que a esa temperatura tiene para Kc el valor de 50.
a) ¿Cuál será el valor de Kp?
b) ¿Cuál es la presión total en la cámara?
c) ¿Cuántos moles de yodo quedan sin reaccionar en el equilibrio?
d) ¿Cuál es la presión parcial de cada componente en la mezcla de equilibrio?
Datos: Constante de los gases ideales,R=0,082 atm ⋅L ⋅K-1
⋅ Mol-1
.
Solución:
a) La ecuación de equilibrio es H2 (g) +I2 (g) ↔ 2 HI (g)
Podemos ver que el ∆n = 0, por lo que Kp = Kc = 50
b) Como en la reacción no hay variación de moles, los moles en el equilibrio son los iniciales,
es decir: n = 0,2 + 0,2 = 0,4 moles.
Aplicando la ecuación de los gases perfectos (PV=nRT) podemos hallar la presión total en la
cámara:
P = 0,4 ⋅ 0.082 ⋅ 713 / 10 = 2,34 atm
c) Llamando x a los moles de I2 que reaccionan con x moles de H2, para formar con 2x moles
de HI, quedarán en el equilibrio (sin reaccionar), 0.2-x moles de I2 y de H2.
H2(g) + I2(g) D 2HI (g)
n0 0,2 0,2
nr x x
neq 0,2-x 0,2-x 2x
Sustituyendo en la expresión de Kc, prescindiendo , para simplificar del volumen, que no
influye al no variar el número de moles, tendremos:
Kc = [HI]2
/ [H2][I2] 50 = (2x)2
/ (0,2-x)2
x = 0,156 mol
n I2 sin reaccionar = 0,2 – 0,156 = 0,044 mol.
d) Para calcular las presiones parciales utilizamos la ley de Dalton: Pi = Xi · Pt
Sustituyendo valores resulta:
P H2 = P I2 = (0,044 / 0,4) ⋅ 2,34 = 0,257 atm.
P HI = (2⋅ 0,156 / 0,4) ⋅ 2,34 = 1,825 atm .](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-404-320.jpg)
![COMUNIDAD VALENCIANA / JUNIO 98. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Un determinado ácido orgánico monoprótico está disociado un 2,5 % en disolución
acuosa 0,2 molar. Calcula :
a) Su constante de disociación.
b) El grado de disociación en una disolución 0,05 molar.
c) ¿Cómo varía el grado de disociación de un ácido débil con la concentración?
d) Cómo varía la constante de disociación de un ácido debil con la concentración?
Solución:
a) Al ser es ácido monoprótico, lo podemos representar como HA. Si está disociado un 2,5%
su grado de disociación será: α = 0,025 .
Equilibrio de disociación:
HA + H2O D A−
+ H3O+
Co : 0,2 0 0
Ceq: 0,2(1−α) 0,2α 0,2α
Sustituyendo en la expresión de Ka:
Ka = [A] [H30+
] / [HA] = (0,2 ⋅ 0,025)2
/ 0,2 (1−0,025) = 1,3 ⋅ 10−4
b) En el caso de que la disolución sea de concentración inicial 0,05 M, tendremos:
1,3⋅ 10−4
= (0,05α)2
/ 0,05 (1−α) = (0,05 α)2
α = 0,051 (5,1%)
c) El grado de disociación de un ácido débil disminuye al aumentar la concentración inicial.
Lo podemos comprobar si comparamos los valores obtenidos para las disoluciones 0,05M y
0,2M
d) La constante de disociación (Ka) de un ácido débil solo depende de la temperatura y no
varía con la concentración. Por eso el valor Ka obtenido en a) sirve para calcular α en b).](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-405-320.jpg)


![VALENCIA/ SEPTIEMBRE 98. LOGSE/ QUÍMICA/ CINÉTICA Y EQUILIBRIO /
OPCIÓN A/ Nº2
www.profes.net es un servicio gratuito de Ediciones SM
2. El fosgeno. COCl2, se descompone a elevada temperatura dando monóxido de
carbono, CO, y cloro, C12. En una experiencia se inyectan 0,631 gramos de fosgeno
en un recipiente rígido de 472,0 cc a 1000 K. Cuando se alcanza el equilibrio se
observa que la presión total es 2,175 atm.
a) Calcular la Kc para la reacción COCl2 (9) CO (g) + Cl2 (g) a 1000 K
b) Una vez alcanzado el equilibrio se disminuye el volumen a la mitad
manteniendo la temperatura constante. Indicar cualitativamente qué sucederá
con el número de moles y con la concentración de las especies existentes.
Pesos atómicos: C =12; 0=16; Cl=35,5
Solución 2:
a) COCl2 (g) -- CO (g) + Cl2 (g)
n0 =
gr
M
=
0,631
98
= 6,44 ⋅10
−3
n0 n0
nr n0α
neq n0(1-α) n0α n0α nt =n0(1+α)
Aplicando la ecuación de los gases ideales P·V=n·R·T y sustituyendo sus valores obtenemos
lo siguiente:
2,175 ⋅0,472 = 6,44 ⋅10
−3
1+ ∝( )⋅0,082 ⋅1000
Despejando α = 0,944 y sustituyendo este valor en Kc obtenemos
kc =
Cl2[ ] CO[ ]
COCL 2[ ]
=
n0 ∝
V
⋅
n0 ∝
V
n0 1−∝( )
V
=
n0 ∝2
V 1− ∝( )
=
6,44 ⋅10−3
⋅ 0,944( )2
0,472 ⋅0,056
= 0,217 mol l
b) Si se reduce el volumen del recipiente a la mitad, se duplica la presión, el equilibrio se
desplaza en el sentido en que se produzcan menor número de moles, es decir, en el sentido
de la formación de COCl2. Kc permanece constante, al no variar la temperatura.
El número de moles de CO y Cl2 diminuye, mientras que los de COCl2 aumentan.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-408-320.jpg)
![VALENCIA/ SEPTIEMBRE 98. LOGSE/ QUÍMICA/ CINÉTICA Y EQUILIBRIO /
OPCIÓN A/ Nº2
www.profes.net es un servicio gratuito de Ediciones SM
Puesto que la concentración se expresa mediante la fórmula:
[ ]=
n
V
La concentración de la sustancia COCl2 al disminuir el volumen tenderá a aumentar.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-409-320.jpg)


![EXTREMADURA / JUNIO 00. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- Se tienen 100 mL de agua destilada. Se añade 1 mL de ácido clorhídrico 5 M. Se
añaden a continuación 5 mL de hidróxido sódico 5 M. Finalmente, se añaden 106 mL de
agua destilada. Calcule el pH inicial del agua y los sucesivos pH tras las adiciones.
Considere que los volúmenes son aditivos.
Solución:
El agua pura tiene carácter neutro, luego el pH inicial será 7, ya que [H3O+
] = [OH-
] = 10-7
M
1) Si se añade 1 mL de HCl5 M.
El HCl es un ácido fuerte, totalmente disociado, luego la cantidad de protones liberados será
la misma que de ácido inicial:
HCl + H2O Cl-
+ H3O+
En 1 L (1000 mL) de HCl 5 M, habrá 5 moles de ácido, luego en 1 mL habrá:
(5 / 1000) · 1 = 5·10-3
moles
Como el volumen final es 100 mL de agua + 1 mL de HCl = 101 mL, la concentración molar
de protones será:
[H3O+
] = 5·10-3
/ 0,101 = 4,95·10-2
M
Y el pH es:
pH = -log [H3O+
] = -log (4,95·10-2
) = 1,3
Es, por tanto, una disolución fuertemente ácida.
2) Siahora se adicionan5 mL de NaOH.
La base reaccionará con el ácido, formando una sal y agua; el reactivo que esté en exceso,
será el que determine el carácter ácido o básico de la disolución:
HCl + NaOH NaCl + H2O
Se calculan los moles de base añadidos en los 5 mL:
En 1 L de NaOH 5 M, habrá 5 moles de base, luego en 5 mL habrá:
(5 / 1000) · 5 = 2,5·10-2
moles](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-412-320.jpg)
![EXTREMADURA / JUNIO 00. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
Por tanto, el ácido es el reactivo limitante, cuando se consuma, la reacción termina, quedando
en exceso la base:
2,5·10-2
- 5·10-3
= 0,02 moles de NaOH
La reacción será:
HCl + NaOH NaCl + H2O
Moles iniciales 5·10-3
2,5·10-2
-- --
Moles finales -- 0,02 0,02
Los 0,02 moles de NaCl están en un volumen total de 101 + 5 = 106 mL, y como es una sal
que procede de ácido y base fuertes, no sufrirá hidrólisis, luego el pH de la disolución lo
determinarán los iones OH-
procedentes del exceso de base:
[NaOH] en exceso = 0,02 / 0,106 = 0,189 M
El hidróxido de sodio es una base fuerte, totalmente disociada:
NaOH Na+
+ OH-
[OH-
] = 0,189 M
pOH = -log [OH-
] = 0,7
pH = 14 – pOH = 13,3
En este segundo paso, se consigue una disolución básica.
3) Adiciónde 106 mL de agua destilada a los 106 mL de disoluciónbásica anterior.
El agua añadida es neutra, como ya se explicó, luego lo único que varía es el volumen final de
disolución que se duplica:
V final = 106 + 106 = 212 mL = 0,212 L
Luego, la nueva concentración de iones OH-
será la mitad:
[OH-
] = 0,189 / 2 = 0,0945 M
pOH = 1,02
pH = 12,98
La disolución es menos básica que en el paso 2.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-413-320.jpg)

![EXTREMADURA / JUNIO 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
De estos dos iones, el Na+
procede del hidróxido de sodio, que es una base fuerte, luego no se
hidrolizará; pero el CN-
es la base conjugada del ácido débil HCN, por lo que sí se hidroliza:
CN-
+ H2O ‡ HCN + OH-
Como se desprenden iones OH-
, la disolución tendrá carácter básico, con un pH 7.
b) Se calculan los moles de NaOH contenidos en los 0,5 g, y con ellos y el volumen de
disolvente expresado en litros, y se calcula la concentración molar de la sosa:
n NaOH = 0,5 / 40 = 1,25 moles
M NaOH = n / V = 1,25 / 0,5 = 2,5·10-2
M
Como es una base fuerte, estará totalmente disociada en sus iones, por lo que la concentración
final de éstos será la concentración inicial de la base:
NaOH Na+
+ OH-
[ ]inicial 2,5·10-2
[ ]final -- 2,5·10-2
2,5·10-2
Luego , se conoce ya la concentración de iones OH-
, que marcará el pH de la disolución:
[OH-
] = 2,5·10-2
M
pOH = -log [OH-
] = 1,6
pH = 14 - pOH = 12,4
Confirmándose que el carácter de la disoluciónes básico.
Si se añaden 500 mL (0,5 L) de HCl 0,05 M, se habrán añadido:
n HCl = V · M = 0,5 · 0,05 = 2,5·10-2
moles
La reacción de neutralización que tiene lugar entre el ácido y la base es:
NaOH + HCl NaCl + H2O
Moles iniciales 1,25·10-2
2,5·10-2
-- --
Moles finales -- 1,25·10-2
1,25·10-2
La base es el reactivo limitante, luego sobrará ácido:
n exceso =1,25·10-2
moles de HCl, que estarán disueltos en el volumen total:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-415-320.jpg)
![EXTREMADURA / JUNIO 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
VT = 0,5 + 0,5 = 1 L
Por tanto, la concentración de HCl, que, al ser un ácido fuerte, coincidirá con la de protones
liberados en su total disociación, será:
M HCl = 1,25·10-2
/ 1 = 1,25·10-2
M
[H3O+
] = 1,25·10-2
M
pH = -log [H3O+
] = 2,9
Siendo la disolución final ácida.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-416-320.jpg)

![EXTREMADURA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
Luego los moles de protones en disolución serán los mismos que del ácido, y su
concentración se halla dividiéndolos entre el volumen total (0,5 L):
[H3O+
] = 0,015 / 0,5 = 0,03 M
pH = -log [H3O+
] = -log (0,03) = 1,52
El valor obtenido de pH, lo que confirma el carácter ácido de la disolución final.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-418-320.jpg)
![EXTREMADURA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- En un recipiente de 2 litros se introducen 0,020 moles de N2O4. Una vez cerrado y
calentado a 30ºC, el N2O4 gaseoso se disocia parcialmente en NO2 según la reacción:
N2O4 (g) 2 NO2 (g)
En el equilibrio existen 0,012 moles de NO2.
a) ¿Qué porcentaje de N2O4se ha disociado (expresar cono % en moles)?
b) Calcule la constante Kc a la temperatura indicada.
Solución:
a) Se llama a al porcentaje en moles (en tanto por uno) de N2O4 disociado, o de NO2
formado; y se escribe el equilibrio entre ambas especies, especificando los moles iniciales y
los del momento del equilibrio:
N2O4 (g) 2 NO2 (g)
Moles iniciales 0,02 --
Moles disociados 0,02 · a
Moles equilibrio 0,02 · (1 - a) 2· 0,02 ·a
El enunciado dice que los moles de producto en el equilibrio son 0,012, luego igualando este
valor a la expresión de los moles en función de a, se puede determinar lo que vale a:
0,012 = 2 · 0,02 · a
a = 0,3 = 30%
b) La expresión de Kc para este equilibrio es:
Kc = [NO2]2
/ [N2O4]
Luego sustituyendo las concentraciones por sus valores (moles en el equilibrio/ volumen
total), se tiene el dato pedido:
n N2O4= 0,02 · (1 – 0.3) = 0,014 moles
n NO2 = 2 · 0,02 · 0,3 = 0,012 moles
Kc = (0,012 / 2)2
/ (0,014 / 2)
Kc = 5,14·10-3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-419-320.jpg)
![EXTREMADURA / JUNIO 02. LOGSE / QUÍMICA /
ESTEQUIOMETRÍA / OPCIÓN A / CUESTIÓN Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
CUESTIÓN 2
2.- En un recipiente de 5 litros se introduce 1 mol de SO2 y 1 mol de O2. Se calienta a 727
ºC, con lo que tiene lugar la reacción: 2 SO2 + O2 2 SO3.
Una vez alcanzado el equilibrio, se analiza la mezcla y se encuentran 0,150 moles de SO3.
Calcule:
a) La concentración de SO2 en el equilibrio.
b) La constante de equilibrio Kc a 727 ºC.
Solución
a) El equilibrio que tienen lugar es el siguiente, donde se ha denominado “x” a los moles que
reaccionan de los reactivos, y por tanto, de productos formados:
2 SO2 + O2 2 SO3
moles iniciales 1 1 --
moles equilibrio 1 – 2· x 1 – x 2· x
Como se conoce el dato de los moles que quedan de SO2 en el equilibrio, se halla “x”:
1 - 2· x = 0,150
De donde:
x = 0,425 moles reaccionan.
Se determinan los moles de SO3 en el equilibrio, con el volumen total su concentración molar,
que es el dato pedido:
[SO3] = (2 · 0,425) / 5 = 0,17 moles / L
b) La expresión de Kc para el equilibrio dado es:
Kc = [SO3]2
/ ([SO2]· [O2])
Con el valor de “x” del apartado anterior, se hallan todas las concentraciones, y se sustituye
en Kc:
Kc = (0,17)2
/ [(0,03)2 · 0,115] = 279,2
La relación entre Kc y Kp, permite hallar esta última:
Kp = Kc · (R· T)Dn](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-420-320.jpg)




![EXTREMADURA / JUNIO 99.COU / QUIMICA / CINETICA Y EQUILIBRIO /
OPCION A / Nº4
www.profes.net es un servicio gratuito de Ediciones SM
4.- Una disolución saturada de hidróxido de calcio contiene 0,165 g de soluto por cada
200mL de disolución. Calcular:
a) El producto de solubilidad del hidróxido de calcio.
b) El pH de la disolución.
Solución:
Equilibrio de solubilidad: Ca(OH)2 → Ca2+
+ 2 OH-
S 2S
Kps = [Ca2+
]·[OH-
]2
= S · (2S)2
= 4 S3
La concentración inicial del hidróxido de calcio es:
M = nº moles / V(L)
Nº de moles de Ca(OH)2 = m (g) / Pm
moles = 0,165 g / 74,1 = 0,0022 moles
M = 0,0022 / 0,2 = 1,11·10-2
mol/L
S = 1,11·10-2
mol/L
El produscto de solubilidad será:
Kps = 4 · (1,11·10-2
)3
= 5,47·10-6
b) Como el hidróxido de calcio es soluble, se disocia completamente dando lugar a una
concentración de iones :
[Ca2+
] = 1,11·10-2
mol/L
[OH-
] = 2 · 1.11·10-2
= 2.22·10-2
mol/L
Por lo tanto: pOH = - log [OH-
] = - log (2,22·10-2
) = 1,65
pH = 14 – 1,65 = 12,35.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-425-320.jpg)


![EXTREMADURA / SEPTIEMBRE 00. COU / QUÍMICA / BLOQUE A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- Se tiene una disolución saturada de hidróxido de magnesio, Mg(OH)2, cuya constante
del producto de solubilidad es Kps = 10 –11,4
. Calcule:
a) La solubilidad del hidróxido de magnesio en agua, expresada en gramos por litro.
b) La concentración de iones OH-
, y el pH de la disolución.
Solución:
Se escribe el equilibrio entre el sólido y los iones del hidróxido insoluble, llamando s
(solubilidad)a los moles por litro de iones disociados, y teniendo en cuenta la estequiometría
de la reacción:
Mg(OH)2 (s) l Mg2+
(ac) + 2 OH-
(ac)
s 2s
Por definición: Kps = [Mg2+
] · [OH-
]2
Kps = s · (2 s)2
= 10-11,4
4 s3
= 10-11,4
s = 1,58·10-4
mol/L
Para pasar de moles/L a g/L, basta con multiplicar por la masa molecular del compuesto:
s = 1,58·10-4
mol/L · 58,3 g/mol
s = 9,21·10-3
g/L
b) La concentración de iones OH-
, (en mol/L), es 2s = 3,16·10-4
mol/L
Por lo que pOH = -log [OH-
] = - log (3,16·10-4
) = 3,5
Y como: pH + pOH = 14
pH = 14 – 3,5 = 10,5
Como era de esperar, la disoluciónes básica.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-428-320.jpg)

![EXTREMADURA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- a) Determine el pH de una disolución 3,2·10-2
M de ácido metanoico; HCOOH, que
está ionizado al 4,75%.
b) ¿Cuál es el valor de la constante de ionización del ácido metanoico?
Solución:
a) El ácido metanoico es un ácido débil, luego estará parcialmente disociado en el equilibrio.
Se conoce su concentración inicial, y el grado de disociación (a), que indica el porcentaje en
que está disociado en sus iones; luego si se escribe el equilibrio y las concentraciones de todas
las especies, tanto en el momento inicial como en el del equilibrio, se tendrá:
HCOOH + H2O D HCOO-
+ H3O+
[ ]inicial 3,2·10-2
-- --
[ ]equilibrio 3,2·10-2
·(1 -a) 3,2·10-2
· a 3,2·10-2
·a
Y como se tiene:
a = 4,75 % = 0,0475
Se está ya en disposición de conocer la concentración de protones en el equilibrio, a partir de
la cual se determina el pH:
[H3O+
] equilibrio = 3,2·10-2
· 0,0475 = 1,52·10-3
mol/L
pH = -log [H3O+
]= 2,81
Como era de esperar, el pH de la disolución es inferior a 7, lo que indica que es una
disolución ácida.
b) La expresión de la constante de acidez para el ácido metanoico es la siguiente:
Ka = ([HCOO-
] · [H3O+
]) / [HCOOH]
Y sustituyendo las concentraciones por los valores numéricos del momento del equilibrio se
llega a:
Ka = 7,58·10-4](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-430-320.jpg)



![EXTREMADURA / SEPTIEMBRE 98.COU / QUIMICA / CINETICA Y EQUILIBRIO /
OPCION A / Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- 20 mL de disolución de cloruro de sodio 10-4
M se mezclan a 25ºC con 40 mL de
disolución de nitrato de plata 10-4
M. Razonar: A) ¿Se produciría precipitado de cloruro
de plata al efectuar esta operación? (1 punto). B) ¿Se produciría precipitado si la
concentración de la disolución de nitrato de plata fuese 10-6
M?. (1 punto). Supóngase
que los volúmenes son aditivos y que ambas sales están totalmente disociadas.
Solución:
A) Se formará precipitado siempre que el producto iónico sea mayor que el valor de la constante
de solubilidad
Como las dos sales están totalmente disociadas, los moles de los iones serán los mismos que los
de las sales de las que provienen.
ClNa → Cl-
+ Na+
moles de ClNa = moles de Cl-
= 10-4
· 0,02 = 2 · 10-6
moles
Ag(NO3) → Ag+
+ NO-
3 moles de Ag(NO3) = moles de Ag+
= 10-4
· 0,04 = 4 · 10-6
moles
Volumen total de la disolución = 60 mL = 0,06 L
El producto iónico Q = [Cl-
][Ag+
] = (2 · 10-6
/ 0,06) · (4 · 10-6
/ 0,06) = 2,22 · 10-5
Como Q Kps, podemos afirmar que se formará precipitado de ClAg.
B) Siguiendo el mismo razonamiento anterior, calculando previamente la concentración de iones
Ag+
.
Q = (2 · 10-4
/ 0,06) · (4 · 10-6
/ 0,06) = 2,22 · 10-11
Como en este caso Kps Q, podemos afirmar que no se formará precipitado.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-434-320.jpg)
![EXTREMADURA / SEPTIEMBRE 99. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Comentar, brevemente, cada uno de los factores que influyen en la velocidad de una
reacción. (2 puntos)
Solución:
La velocidad de una reacción se define como la variación de las concentraciones de reactivos,
o productos en la unidad de tiempo.
aA + b B cC
Se define matemáticamente como una derivada. Por ejemplo para la reacción anterior se
pueden definir las velocidades de desparición de los reactivos A y B, o la velocidad de
aparición del producto C:
vr = -1/a d[A]/dt = -1/b d[B]/dt = 1/c d[C]/dt
La ecuación de velocidad relaciona vr con las concentraciones de los reactivos:
vr = K · [A] · [B]
Los factores que pueden modificarla son:
a) Naturaleza de los reactivos: la velocidad depende de la facilidad de ruptura y creaciónde
enlaces en el proceso. Esto es funcióndel tipo de enlaces y de los átomos enlazados. Este
factor influye, por tanto, en la energía de activación (Ea).
b) La concentración de los reactivos: al aumentar ésta, es más probable el choque entre sus
partículas, favoreciendo la reacción, y aumentando así la velocidad. Véase la ecuaciónde
velocidad.
c) El estado físico de los reactivos: en general se cumple que la velocidad de reacción es
mayor si los reactivos se presentan en estado gas que si estan en fase líquida o sólida.
vr (g) vr (l) vr (s)](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-435-320.jpg)

![EXTREMADURA / SEPTIEMBRE 99. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- La aspirina o ácido acetilsalicílco, AH, es un ácido monoprótico débil, cuya fórmula
es C9H8O4, que está disociada un 3,2% a 293 K.
a) Hallar el pH de una disolución preparada disolviendo totalmente, a 293 K, un
comprimido de aspirina de 0,500 gramos en un poco de agua, hasta tener 0,1 litros de
disolución. (1 punto)
b)
c) La constante de ionización del ácido acetilsalicílico a esa temperatura. (1 punto)
Solución:
Primeramente se calcula la concentración de la disolución preparada, utilizando para ello la
masa de aspirina disuelta, su masa molecular, y el volumen de disolución logrado:
Mm C9H8O4 = 180 g
n aspirina = m / Mm
n aspirina = 0,500 / 180 = 2,7·10-3
moles
V disolución = 0,1 L
M = moles soluto / V disolución
M = 2,7·10-3
/ 0,1 = 0,027 M
a) Se escribe el equilibrio de disociación del ácido acetilsalicílico HA, con su concentración
inicial, y la del equilibrio (dada por el grado de ionización en tanto por uno)
a = 3,2 % = 0,032
HA + H2O D H3O+
+ A-
[ ]inicial 0,027 -- --
[ ]disoc. 0,027· 0,032
[ ]equil. 0,027 · (1 – 0,032) 0,027 · 0,032 0,027 · 0,032
[H3O+
] equil = 0,027 · 0,032 = 8,64·10-4
pH = -log [H3O+
]
pH = -log (8,64·10-4
) = 3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-437-320.jpg)
![EXTREMADURA / SEPTIEMBRE 99. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
b) La constante de ionización de un ácido débil monoprótico se define como:
Ka = [H3O+
] · [A-
] / [HA]
Sustituyendo por los valores de las concentraciones en el equilibrio, se tiene:
Ka = (8,64·10-4
) ·(8,64·10-4
) / [0,027 · (1 – 0,032)]
Ka = 2,85·10-5](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-438-320.jpg)



![EXTREMADURA / SEPTIEMBRE 99. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- Considere la reacción: A (g) + 3 B (g) D C(g) + 2 D (g), donde A,B,C,y D,
representan especies químicas en equilibrio. Se introducen 6 moles de A y 9 moles de B
en un recipiente de 2 litros. Cuando se alcanza el equilibrio a 400ºC, el recipiente
contiene 4 moles de D. Calcular:
a) Los moles de cada sustancia en el equilibrio.
b) El valor de la Kc a 400ºC.
Solución:
a) Se escribe el equilibrio, señalando los moles iniciales de cada uno de los reactivos (A y B),
y los moles en el equilibrio de reactivos y productos, llamando x a la cantidad de moles de
reactivos que han reaccionado.
Teniendo en cuenta la estequiometría de la reacción.
A (g) + 3 B (g) D C(g) + 2 D (g)
Moles iniciales 6 9 -- --
Moles reaccionan x 3x
Moles equilibrio 6 – x 9 – 3x x 2x = 4
Como se conoce el número de moles de D en el equilibrio (4 moles), y se sabe que por la
estequiometría de la reacción se habrán formado 2x moles, x = 2 moles.
Así la composición del equilibrio será:
n A = 6 – x = 6 – 2 = 4 moles
n B = 9 – 3·x = 9 – 3·2 = 3 moles
n C = x = 2 moles
n D = 4 moles
b) La constante Kc se expresa en función de las concentraciones de reactivos y productos
en el equilibrio:
[C] · [D]2
Kc =
[A] · [B]3
Con los moles de cada especie en el equilibrio, y el volumen total del recipiente (2 litros),
se hallan las concentraciones de A, B, C, y D, y con ellas Kc:
[A] = 4 / 2 = 2 M
[B] = 3 / 2 M
[C] = 2 / 2 = 1 M
[D] = 4 / 2 = 2 M
Kc = (1 · 22
) / (2 · (3/2)3
) = 0,6 (mol/L)-1](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-442-320.jpg)
![EXTREMADURA / SEPTIEMBRE 99. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- Se agregan 20 mL de una disolución 0,01 M de nitrato de plata, a 80 mL de otra
disolución 0,05 M de cromato potásico, ¿se formará precipitado?. Razone la
respuesta. Kps(Ag2CrO4) = 3,9·10-12
Solución:
Se tienen dos sales, de las que se conocen volumen y concentración molar, luego se calcula el
número de moles antes de mezclarlas:
n = V · M
n AgNO3 = 0,01 · 0,02 = 2·10-4
moles
n K2CrO4 = 0,05 · 0,08 = 4·10-3
moles
Al mezclarlas, el volumen cambia (Vfinal = 80 + 20 = 100 mL = 0,1 L), y por tanto, también
las concentraciones, siendo los nuevos valores:
M´ AgNO3 = 2·10-4
/ 0,1 = 2·10-3
M
M´ K2CrO4 = 4·10-3
/ 0,1 = 0,04 M
Ambas sales solubles estarán totalmente disociadas en disolución:
AgNO3 Ag+
+ NO3
-
K2CrO4 2 K+
+ CrO4
2-
Luego la concentración de los iones implicados en la posible precipitación es:
[Ag+
] = 2·10-3
M
[CrO4
2-
] = 0,04 M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-443-320.jpg)
![EXTREMADURA / SEPTIEMBRE 99. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
La reacción que tiene lugar al mezclar ambas sales es:
2 AgNO3 + K2CrO4 Ag2CrO4 $ + 2 KNO3
El posible precipitado sería de la sal insoluble cromato de plata (Ag2CrO4).
El equilibrio de solubilidad de esta sal y su Ks es:
Ag2CrO4 $ D 2 Ag+
+ CrO4
2-
Ks = [Ag+
]2
· [CrO4
2-
] = 3,9·10-12
Calculamos el producto iónico real:
[Ag+
]2
real · [CrO4
2-
] real = (2·10-3
)2
· 0,04 = 1,6·10-7
3,9·10-12
Luego sí precipita la sal Ag2CrO4.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-444-320.jpg)


![EXTREMADURA / JUNIO98.COU / QUIMICA / CINÉTICA Y EQUILIBRIO / OPCION
A / Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- La Kc del siguiente equilibrio:
N2 (g) + O2 (g) 2NO (g)
es 8,8 10-4
a 2.200 K. Calcular el número de moles de cada una de las especies en el
equilibrio, cuando se introducen en un recipiente de 1 litro, 2 moles de N2 y 2 moles de
O2, y se calienta hasta 2.200 K.(Hasta dos puntos)
Solución:
La tabla del equilibrio sería:
N2 (g) + O2 (g) ß 2NO (g)
no 2 2
nr x x
neq 2-x 2-x 2x
Kc =
[NO]eq
2
[N2 ]eq ⋅[O2 ]eq
8,8 ⋅10
−4
=
4x2
1
(2 − x)
2
1
De donde se despeja x = 0,029 mol
Y así la composición del equilibrio sería esta:
n eq(N2) = n eq(O2) = 2 – 0,029 = 1,971 moles
n eq(NO) = 2 · 0,029 = 0,058 moles](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-447-320.jpg)
![GALICIA / JUNIO 00. LOGSE / QUÍMICA / CINETICA Y EQUILIBRIO / OPCION A
/ CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- La constante de equilibrio de la reacción que se indica , vale 0’022 a 200ºC y 34’2 a
500ºC .
PCl5(g) D PCl3(g) + Cl2
a)Indicar si el PCl5, es mas estable , es decir , si se descompone más o menos , a
temperatura baja.
b)¿La reacción de descomposición del PCl5 es endotérmica o exotérmica ?.
c)¿Corresponderá mayor o menor energía de activación a la descomposición o a la
formación de PCl5? .Razonar las respuestas.
Solución:
Valores de K según la T: K = 0,022 (200ºC)
K = 34,2 (500ºC)
Expresíon de la constante de equilibrio:
K = [PCl 3] · [Cl2] / [PCl5]
a) Si se aumenta la temperatura, el valor de K es mayor, lo que significa desplazamiento del
equilibrio hacia la derecha, y esto hace que el PCl5 se descomponga siendo, por tanto, más
inestable a alta T.
b) Según el Principio ce Le Chatelier ,que dice que cuando se produce una modificación en
alguno de los factores que influyen en el equilibrio el sistema desplaza el equilibrio en el
sentido en el cual se contrarreste dicha modificación.
A T más alta la K es mayor lo que indica que el equilibrio se desplaza hacia la derecha, luego
la reacción de descomposición es endotérmica. En estas reacciones (DH0) las T altas
favorecenel rendimiento.
c) En la descomposición la reacción es endotérmica , luego los productos poseen mayor
energía , la energía de activación (Ea) será mayor que en la reacción de formación en la cual
los reactivos tendrán mayor energía , pues esta reacción es exotermica.
La Ea´ para pasar de los reactivos,PCl3 y Cl2 al complejo de activación será por tanto menor
que para pasar del reactivo PCl5 al complejo activado (Ea).
Conclusión:
La energía de activaciónes mayor en el proceso de descomposiciónque en el de formación.
Veamos el diagrama de energías aproximado de esta reacción reversible:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-448-320.jpg)
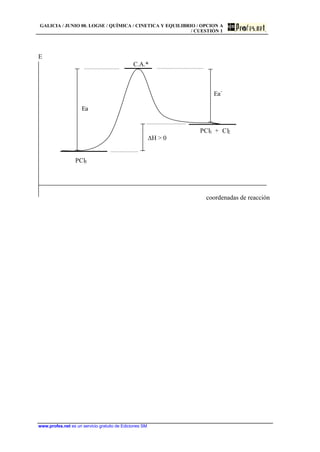
![GALICIA / JUNIO 00. LOGSE / QUÍMICA / CINETICA Y EQUILIBRIO / OPCION A
/ CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- A 25ºC el grado de ionización ce una disolución acuosa de ácido etanoico ( ácido
acético) 0,0101M vale 0,0099. Calcúlese el pH de la misma y la constante de ionización
del ácido etanoico a dicha temperatura.
Solución:
El ácido acético es el ácido más pequeño que contiene el grupo carboxílico –COOH.
En disolución acuosa se descompone en ion acetato CH3-COO- y en iones hidronio H3O+
.
La tabla de equilibrio es la siguiente:
CH3-COOH D CH3-COO-
+H3O+
CO 0.101
CR 0,101a
CEQ 0,101(1- a) 0,101a 0,101a
Siendo a = 0,0099
Ka= [CH3-COO-
] · [H3O+
] / [CH3-COOH]
Ka = (0,101· (0,0099))2
/ (0,101 (1 - 0,0099))
Ka = 1,0 ·10-5
Esta es la constante de ionización, su valor refleja que es un ácido no demasiado débil.
El pH se halla mediante su definición:
pH = -log [H3O+
]
[H3O+
] = 0,101 · 0,0099 = 9,9·10-4
pH = -log (9,9·10-4
) = 3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-450-320.jpg)






![GALICIA / JUNIO 99 COU / QUÍMICA / ELECTROQUÍMICA / OPCIÓN 1 /
Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.-Calcule: a) la concentración molar, b) el pH de una disolución de ácido etanoico
(ácido acético) si éste se encuentra disociado en un 2,53 %.
Datos: Ka=1,85·10-5
Solución:
La reacción propuesta es:
H2O + CH3-COOH D CH3-COO- + H3O+
α(grado de disociación)=2,53%
a) De acuerdo con la Ley de Dilución de Ostwald: Ka = (Cα)2
/C(1-α)
Como a es un número muy inferior a 1, el denominador de la ecuación se toma como 1,
Ka = Cα2 , despejando se obtiene: C = Ka/α2
C = 1,85·10-5/(2,53·10-2)2 ; C = 0,029 M
b) Ka = [CH3-COO-]·[H3O+]/ [CH3-COOH]
De acuerdo con la Ley de Dilución de Ostwald: Ka = Cα·Cα/C(1-α)
Por lo tanto, [H3O+] = Cα
[H3O+] = 0,029·0,0253 M
[H3O+] = 0,73·10-3
pH = -log [H3O+]
Sustituyendo por el valor obtenido anteriormente:
pH = 3,13](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-457-320.jpg)
![GALICIA / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN I / EJERCICIO 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- En cada una de las siguientes reacciones: 2 NO (g) + O2 (g) D 2 NO2 (g) DH 0
2 BaO2 (s) D 2 BaO (s) + O2 (g) DH 0
a) Escriba la expresión de las constantes de equilibrio.
b) ¿En qué sentido se desplazará el equilibrio si se eleva la temperatura?.
c) ¿Cómo evoluciona el equilibrio si se eleva la presión?.
Razone las respuestas.
Solución:
a) Aplicando la Ley de Acción de Masas (LAM):
La expresión de la constante de los equilibrios homogéneos se pueden realizar en función de
las concentraciones (Kc) o de las presiones parciales (Kp) de los reactivos y productos.
2 NO (g) + O2 (g) D 2 NO2 (g)
[NO2]2
Kc =
[NO]2
· [O2]
(P NO2)2
Kp =
(P NO)2
· (P O2)
La expresión de la constante de los equilibrios heterogéneos se pueden realizar en función de
las concentraciones (Kc) o de las presiones parciales (Kp) exclusivamente de los componentes
gaseosos, ya que los sólidos al ser su densidad constante, lo es también su concentración, y
esta se encuentra englogada en el valor de la K.
2 BaO2 (s) D 2 BaO (s) + O2 (g)
Kc = [O2]
Kp = P O2
b) La primera reacción, de combinación del dióxido de nitrógeno y oxígeno, es exotérmica y,
por tanto, según el Principio de Le Chatelier, al elevar la T se desplazará hacia la izquierda
(reactivos) con objeto de contrarrestar dicha variación.
La segunda reacción, de descomposición del peróxido de bario, es endotérmica y, por tanto,
según el Principio de Le Chatelier, al elevar la T se desplazará hacia la derecha (productos)
con objeto de contrarrestar dicha variación.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-458-320.jpg)

![GALICIA / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN I / EJERCICIO 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Se tiaene una disolución de ácido etanoico (ácido acético) 0,055M. Calcular:
a) El pH de la misma.
b) El grado de disociación, en tanto porciento.
c) La molaridad que deberá tener una disolución de HCl para que su pH fuera igual al
de la disolución de ácido etanoico anterior.
Ka = 1,86 · 10-5
Solución:
a) El equilibrio de disociación de este ácido débil es:
CH3 – COOH + H2O D CH3 – COO-
+ H3O+
Conc. inicial 0,055
Conc. reacc. x
Conc. final 0,055 – x x x
[CH3 – COO-
] · [H3O+
]
Ka =
[CH3 – COOH]
1,86·10-5
= (x · x ) / (0,055 – x)
x = 1,42 ·10-3
pH = -log [H3O+
] = -log (1,42·10-3
) = 2,84
b) El grado de disociación es a y se calcula así:
x = Co · a
a = x / Co = (1,42 ·10-3
) / 0,055 = 0,0258
Es decir se ha disociado un 2,58 %.
c) El ácido clorhídrico es un ácido fuerte, es decir totalmente disociado:
HCl + H2O Cl-
+ H3O+
Si el pH del ácido clorhídrico ha de ser igual, se cumplirá: pH = 2,84
[H3O+
] = 10-pH
[H3O+
] = 10-2,84
= 1,42·10-3
M
Luego la concentración de clorhídrico será la misma: [HCl] = 1,42·10-3
M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-460-320.jpg)


![GALICIA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN 1 / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- La constante de equilibrio para la reacción:
H2 (g) + CO2 (g) H2O (g) + CO (g) es Kc = 1,6 a 986ºC.
Un recipiente de un litro contiene inicialmente una mezcla de 0,2 moles de H2; 0,3 moles
de CO2; 0,4 moles de agua y 0,4 moles de CO a 986ºC.
a) Justificar por qué esta mezcla no está en equilibrio.
b) Si los gases reaccionan hasta alcanzar el estado de equilibrio a 986ºC, calcular las
concentraciones finales.
c) Calcular la presión inicial y la presión final de la mezcla gaseosa.
Dato: R = 0,082 atm·L· mol-1
· K-1
Solución:
a) Para determinar si la mezcla se encuentra en equilibrio, se calcula el valor de la constante
para el experimento realizado, y se compara con la Kc teórica dada como dato.
Como el volumen total es 1 litro, coinciden moles y concentraciones, pudiendo escribir:
H2 (g) + CO2 (g) H2O (g) + CO (g)
Kc = ([CO]· [H2O]) / ([CO2]·[H2])
Kc exper. = (0,4 · 0,4) / (0,2 · 0,3) = 2,66
Kc exper. Kc teórica; luego la mezcla no está en equilibrio, y para alcanzarlo evolucionará
hacia la izquierda.
b) Se escribe el equilibrio, llamando x a la concentración de reactivos que se consumen, y por
tanto, de productos que se forman:
H2 (g) + CO2 (g) H2O (g) + CO (g)
[ ] iniciales 0,2 0,3 -- --
[ ] equilibrio 0,2 + x 0,3 + x 0,4 - x 0,4 - x
Como para alcanzar el equilibrio la mezcla evoluciona de derecha a izquierda, se debe de
trabajar con la inversa de Kc, cuya expresión sería:
Kc´ = ([CO2]·[H2]) / ([CO]· [H2O])
Luego se sustituyen las concentraciones en el equilibrio correspondientes:
Kc´ = [(0,2 + x )· (0,3 + x)] / (0,4 – x)2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-463-320.jpg)
![GALICIA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN 1 / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
Y como Kc´= 1 / Kc = 0,625
Se tiene:
x = 0,0394 M
Por tanto:
[CO] en el equilibrio = [H2O] en el equilibrio = 0,4 – 0,0394 = 0,36 M
[H2] en el equilibrio = 0,2 + 0,0394 = 0,24 M
[CO2] en el equilibrio = 0,3 + 0,0394 = 0,34 M
Para averiguar la presión total en el recipiente se recurre a la ecuación de los gases perfectos:
P·V = n·R·T
En el momento inicial, ,os moles totales son: 0,2 + 0,3 + 0,4 + 0,4 = 1,3 moles; luego:
P = (1,3 · 0,082 · 1259) / 1 = 134,2 atm
En el momento en que se alcanza el equilibrio, se tiene n = nº total de moles en el equilibrio =
0,24 + 0,34 + 0,36 + 0,36 = 1,3 moles
P = (1,3· 0,082 · 1259) / 1 = 134,2 atm.
Es decir, no se aprecia cambio en la presión total de la mezcla, puesto que apenas se
modifican los moles de los gases en el equilibrio.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-464-320.jpg)


![GALICIA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN 1 / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- La constante de equilibrio para la reacción:
H2 (g) + CO2 (g) H2O (g) + CO (g) es Kc = 1,6 a 986ºC.
Un recipiente de un litro contiene inicialmente una mezcla de 0,2 moles de H2; 0,3 moles
de CO2; 0,4 moles de agua y 0,4 moles de CO a 986ºC.
a) Justificar por qué esta mezcla no está en equilibrio.
b) Si los gases reaccionan hasta alcanzar el estado de equilibrio a 986ºC, calcular las
concentraciones finales.
c) Calcular la presión inicial y la presión final de la mezcla gaseosa.
Dato: R = 0,082 atm · L· mol-1
· K-1
Solución:
a) Para determinar si la mezcla se encuentra en equilibrio, se calcula el valor del coeficiente
de concentración (Q) para el experimento realizado, y se compara con la Kc teórica dada
como dato.
Como el volumen total es 1 litro, coinciden moles y concentraciones, pudiendo escribir:
H2 (g) + CO2 (g) H2O (g) + CO (g)
Kc = ([CO]· [H2O]) / ([CO2]· [H2])
Q exper. = (0,4 · 0,4) / (0,2 · 0,3) = 2,66
Q exper. Kc teórica; luego la mezcla no está en equilibrio, y para alcanzarlo evolucionará
hacia la izquierda.
b) Se escribe el equilibrio, llamando x a la concentración de reactivos que se consumen, y por
tanto, de productos que se forman:
H2 (g) + CO2 (g) H2O (g) + CO (g)
[ ] iniciales 0,2 0,3 -- --
[ ] equilibrio 0,2 + x 0,3 + x 0,4 - x 0,4 - x
Como para alcanzar el equilibrio la mezcla evoluciona de derecha a izquierda, se debe de
trabajar con la inversa de Kc, cuya expresión sería:
Kc´ = ([CO2]· [H2]) / ([CO]· [H2O])
Luego se sustituyen las concentraciones en el equilibrio correspondientes:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-467-320.jpg)
![GALICIA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN 1 / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
Kc´ = [(0,2 + x )· (0,3 + x)] / (0,4 – x)2
Y como Kc´= 1 / Kc = 0,625
Se tiene:
x = 0,0394 M
Por tanto el correspondiente estado de equilibrio es:
[CO] eq = [H2O] eq = 0,4 – 0,0394 = 0,36 M
[H2] eq = 0,2 + 0,0394 = 0,24 M
[CO2] eq = 0,3 + 0,0394 = 0,34 M
c) Para averiguar la presión total en el recipiente se recurre a la ecuación de los gases
perfectos:
P· V=n· R· T
En el momento inicial, los moles totales son: 0,2 + 0,3 + 0,4 + 0,4 = 1,3 moles
Luego la presión inicial es :
P = (1,3 · 0,082· 1259) / 1 = 134,2 atm
En el momento final en que se alcanza elequilibrio, se tiene que:
n = nº total de moles en el equilibrio = 0,24 + 0,34 + 0,36 + 0,36 = 1,3 moles
Luego la presión final es la misma:
P = (1,3· 0,082· 1259) / 1 = 134,2 atm.
Es decir, no se aprecia cambio en la presión total de la mezcla, puesto que apenas se
modifican los moles de los gases en el equilibrio.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-468-320.jpg)












![ISLAS BALEARES / JUNIO 98. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Se prepara una disolución mezclando 100mL de amoniaco 0,1M con 200mL de cloruro de
amonio 0,05M, y algunos mililitros de agua. Calcula el pH de la disolución.
(Ka del ion amonio 6·10-10
)
Solución:
Se forma de este modo una disolución reguladora de pH, formada por una base débil (amoniaco) y su
ácido conjugado (ion amonio).
El amoniaco es una base poco disociada, y lo es menos por efecto del ion común NH4
+
. Por tanto, las
concentraciones en el equilibrio son prácticamente iguales a las iniciales de la mezcla.
En este caso [NH3] = (0,1 · 0,1) / 0,3 = 0,033 M
[NH4
+
] = (0,05 · 0,2) / 0,3 = 0,033 M
De este modo [NH3] = [NH4
+
]
Ya que se mezcla el doble de cloruro de amonio ( cuya concentración es la mitad) que de amoniaco.
El equilibrio de disociación es: NH4
+
+ H2O ⇔ NH3 +H3O+
Ka = 6·10-10
La ley del equilibrio nos indica Ka = [NH3] · [H3O+
] / [NH4
+
]
[H30+
] = 6·10-10
pH = 9,2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-481-320.jpg)
![ISLAS BALEARES / JUNIO 99. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- El yoduro de hidrógeno se descompone según el equilibrio siguiente:
2 HI (g) D H2 (g) + I2 (g)
Dentro de un recipiente cerrado, en equilibrio, hay: 0,38 moles de I2 (g), 0,08 moles de
H2 (g), y 1,24 moles de HI (g).
Se añaden 0,30 moles de H2 (g), se establece de nuevo el equilibrio.
Calcula el número de moles de cada gas en el equilibrio (que se establece después de la
adición del hidrógeno).
Solución:
El equilibrio de descomposición del yoduro de hirógeno es:
2 HI (g) D H2 (g) + I2 (g)
Se halla primero la constante de equilibrio (Kc).
Kc = [ H2 ] · [ I2 ] / [ HI ]2
Kc = (0,38/V) · (0,08/V) / (1,24/V)2
Kc = 0,02
Como la constante no varía se escribe la tabla del 2º equilibrio, en la que calculamos el valor
de x (número de moles que se descomponen). Según el principio de Le Chatelier, al añadir
una concentración de producto el equilibrio se desplazará hacia la izquierda por tanto:
2 HI D H2 + I2
[ ]o 1,24 0,38 0,38
V V V
[ ]r 2x x x
[ ] eq 1,24 + 2x 0,38 - x 0,38 - x
V V V
Kc = 0,02 = ((0,38 – x ) / V )2
/ ((1,24 + 2x) /V)2
x = 0,16 mol
En el nuevo equilibrio la composición es :
n I2 = n H2 = 0,38 - 0,16 = 0,22 moles
n HI = 1,24 + (2 · 0,16) = 1,56 moles](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-482-320.jpg)
![ISLAS BALEARES / SEPTIEMBRE 00. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCION A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- De los siguientes conceptos: entalpía de enlace, entalpía de reacción, energía de
activación, constante de equilibrio, y pH,
a) ¿cuáles no pueden ser negativos?.
b) ¿cuáles pueden ser negativos y positivos?.
Justificar la respuesta.
Solución:
a) La energía de activación es la energía mínima necesaria para que se rompan los enlaces de
los reactivos, pasando por el estado de complejo activado, y finalmente puedan formarse los
productos, es decir, tenga lugar una reacción química. Por tanto es siempre una energía que se
absorbe, y será un valor positivo (Ea 0)
La constante de equilibrio es un cociente entre concentraciones de productos y reactivos, que
nunca pueden ser negativas, luego tampoco podrá serlo dicha constante (K 0).
La entalpía de enlace, es la energía necesaria para romper un mol de un tipo determinado de
enlace. En este caso siempre se absorbe energía, por lo que este valor es siempre es positivo
(DH enlace 0).
b) Los valores de entalpía de reacción pueden ser positivos o negativos, puesto que para que
la reacción tenga lugar, o bien el sistema absorbe energía ( reacción endotérmica, con entalpía
positiva), o bien se la cede al entorno (reacción exotérmica, con entalpía negativa).
El concepto de pH se define así: pH = - log [ H3O+
]
Las concentraciones de protones más usuales varían entre 10-14
M en una disolución de una
base fuerte, y 1 M en la de un ácido fuerte, casos en los que el pH varía entre 14 y 0. Sin
embargo, siempre que la concentración de protones sea superior a 1M, el pH sería negativo.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-483-320.jpg)

![ISLAS BALEARES / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCION A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
A2.- Calcular la concentración de todas las especies de una disolución de ácido fórmico
de pH = 3,74. (Ka =1,82 x 10-4
)
Solución:
HCOOH + H2O D HCOO-
+ H3O+
Inicialmente: C0
Se disocian: C0α
Se forman: C0(1-α) C0α C0α
Ka = [HCOO-
]·[H3O+
]/[HCOOH] = 1,82·10-4
pH = -log [H3O+
] = 3,74
Por lo tanto [H3O+
] = 10-pH
= 10-3,74
= 1,819·10-4
Las concentraciones de H3O+
y HCOO-
que se forman son:
[HCOO-
] = [H3O+
] = 1,819· 10-4
mol/litro
Sustituyendo en la Ka obtendremos el valor de la concentración de HCOOH
[HCOOH] = 0,9998 mol/litro.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-485-320.jpg)
![ISLAS BALEARES / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCION A / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
A3.- En que sentido se desplaza el equilibrio
SO2(g) + ½O2 DD SO3(g) ∆∆H =-100 kJ/mol
Cuando se perturba por:
a. Aumento de volumen del recipiente (es decir, diminución de la presión)
b. Adición de SO3
c. Aumento de la temperatura
En cual/cuales de las perturbaciones efectuadas ha cambiado la Kc
Solución:
Según el principio de Le Chatelier: “Si en un sistema se modifica alguno de los factores que
influyen en el mismo, el equilibrio se desplaza en el sentido que contrarreste dicha variación”.
SO2(g) + ½O2 D SO3(g) ∆H =-100 kJ/mol
a. En el caso de que se produzca un aumento de volumen, es decir una disminución de la
presión, en un sistema gas como éste en el que el incremento de número de moles gaseosos es
negativo el equilibrio se desplaza hacia la IZQUIERDA.
El incremento de moles gaseosos en esta reacción es:
∆n = n SO3 – (n SO2 + n O2) = 1-3/2 = - 1/2.
b. Si aumentamos la concentración del producto (SO3) para que la Kc permanezca constante,
el equilibrio tiene que desplazarse hacia la IZQUIERDA para así aumentar la concentración
de los reactivos;
Kc = [SO3]/[SO2]·[O2]1/2
c. Esta reacción al tener un incremento de entalpía menor que cero, es exotérmica, es decir
desprende calor, algo que influye en el desplazamiento del equilibrio en caso de que haya
cambio de temperatura. Si aumentamos la temperatura, el equilibrio se desplaza hacia la
IZQUIERDA, ya que es en este sentido en el que absorbe calor; esto producirá una
disminución de la Kc.
La Kc depende sólo de la temperatura por lo tanto sólo variará en éste último caso.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-486-320.jpg)
![ISLAS BALEARES / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Responder, razonadamente, las cuestiones siguientes:
a) La constante de acidez del ácido acético es 1,8· 10-5
. ¿Su base conjugada, será fuerte o
débil?
b) Calcular el pH de una disolución 10-8
M de ácido clorhídrico.
Solución:
a) Se representa el ácido acético como HAc, y se escribe su equilibrio de disociación, ya que
es un ácido débil:
HAc + H2O Ac-
+ H3O+
Si es un ácido débil, el equilibrio esta poco desplazado. Es decir, la reacción de disociación
(de izquierda a derecha) tiene muy poca tendencia a producirse, luego será la de sentido
contrario (captación de protones por parte de la base conjugada A-
) la que se lleve a cabo: de
lo que se concluye que el ión acetato (Ac-
) será una base algo fuerte.
También puede deducirse a partir del valor de la Kb, que se determina con el de la Ka y el
producto iónico del agua, Kw:
Kw = Ka · Kb
Kb = 5,55· 10-10
b) El ácido clorhídrico es un ácido fuerte, totalmente disociado, luego habrá la misma
concentración de protones que de disolución inicialmente:
HCl + H2O τ H3O+
+ Cl-
[HCl] inicial = [H3O+
] disoc. ácido = 10-8
M
El agua también aporta protones de su disociación:
[H3O+
] disoc. agua = 10-7
Luego la concentración total de protones es:
[H3O+
] total = 10-7
+ 10-8
Y por la expresión de pH, se deduce su valor:
pH = - log [H3O+
] total = 6,96
Es una disolución muy ligeramente ácida, pues el valor de pH es muy próximo a 7.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-487-320.jpg)

![ISLAS BALEARES / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
Kc = 54,8 = ((25 + 2 · x) / 20)2
/ ((15 - x) / 20) · ((2 - x) / 20))
De donde se tiene el valor de x:
x = 1,24 moles reaccionan.
Ya se pueden calcular las concentraciones de las tres especies en el equilibrio:
[I2 ] = (15 - 1,24) / 20 = 0,688 M
[H2 ] = (2 - 1,24) = 0,038 M
[HI] = (25 + 2 · 1,24) / 20 = 1,374 M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-489-320.jpg)
![ISLAS BALEARES / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- Razonar si son ciertas o falsas las siguientes afirmaciones:
a) Cuanto mayor sea la concentración inicial de ácido acético, mayor lo será la de iones
acetato.
b)El grado de disociación del ácido acético es independiente de la concentración inicial
del ácido.
c) Una disolución de cloruro de amonio tendrá un pH básico.
d) Si se adiciona acetato de sodio a una disolución de ácido acético, el pH aumenta.
Solución:
a) Verdadero, al ser un ácido débil se disocia parcialmente, y la fracción disociada depende
sólo de la concentración inicial, puesto que la Ka permanece constante (salvo que se
modifique la temperatura)
HAc + H2O H3O+
+ Ac-
[ ]inicial Ci -- --
[ ]equilibrio Ci - x x x
La expresión de Ka es:
Ka = ([H3O+
]· [Ac-
]) / [HAc]
Ka = x2
/ (Ci - x)
Ka = 1,8 · 10-5
Luego para que Ka sea constante, a mayor Ci, mayor valor de x
b) Falso, pues la expresión del grado de disociación es:
x = Ci · a
Es decir, existe relación entre él y la Ci.
c) Es falso.
La sal está completamente disociada en sus iones:
NH4Cl τ NH4
+
+ Cl-](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-490-320.jpg)

![ISLAS BALEARES / SEPTIEMBRE 03. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
2.- ¿Qué concentración de metilamina será necesaria para obtener una disolución de
pH = 11, si su Kb = 5 · 10-4
?
Solución:
La metilamina es una base débil, luego a partir del dato de pH, se calcula el de pOH, y con él,
la concentración de iones OH-
en disolución:
pH + pOH = 14
pOH = 14 - 11 = 3
pOH = - log [OH-
] = 3
[OH-
] = 10-3
M
El equilibrio de disociación de la metilamina, para una concentración inicial (Ci) desconocida
será:
CH3NH2 + H2O ‡ CH3NH3
+
+ OH-
[ ]inicial Ci -- --
[ ]equil. Ci - 10-3
10-3
10-3
La expresión de la Kb es:
Kb = ([CH3NH3
+
] · [OH-
]) / [CH3NH2]
Sustituyendo los datos conocidos, se está en disposiciónde despejar la Ci desconocida:
5 · 10-4
= (10-3
)2
/ (Ci - 10-3
)
De donde:
Ci = 3 · 10-3
M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-492-320.jpg)


![ISLAS BALEARES / SEPTIEMBRE 98. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- a) Calcular la concentración de una disolución de hidróxido de sodio, sabiendo que al
valorar 50 ml, se consumieron 35 ml de ácido clorhídrico 0,05 M.
b) ¿Cuál es el pH de la disolución de hidróxido de sodio?
c) ¿Cuál es el pH en el punto de equivalencia?
Solución:
a) En una valoración, cuando se alcanza el punto de equivalencia, el número de equivalentes
de ácido y de base que han reaccionado es el mismo:
nº equiv. ácido = nº equiv. base
Y como: N = nº equiv. / V disolución (L)
Podemos escribir:
(N · V) ácido = (N · V) base
Se conoce todo menos la concentración de base, luego:
N base = (0,05 · 0,035) / 0,05 = 0,035 N
Y expresada en M (moles / l), dado que la valencia del hidróxido de sodio es la unidad, se
tiene:
M NaOH = 0,035 mol/L
b) El NaOH es una base fuerte, totalmente disociada en sus iones:
NaOH Na+
+ OH-
[ ]inicial 0,035 -- --
[ ]final -- 0,035 0,035
Con la [OH-
] se determina el pOH:
pOH = – log [OH-
] = – log (0,035) = 1,45
Y como: pH + pOH = 14
pH = 12,55
Como era de esperar, el pH es mayor que 7, lo que indica que se está ante una base.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-495-320.jpg)


![ISLAS BALEARES / SEPTIEMBRE 98. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE A / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
Luego, se escriben las expresiones de las presiones parciales de los 2 gases del problema, y
posteriormente, la de Kp:
P(NO2) = Ptot · [2 · (ni / 2 ) / 3/2 · ni ] = Ptot · 2/3
P(N2O4) = Ptot · [(ni / 2 ) / 3/2 · ni ] = Ptot / 3
Kp = (Ptot · 2/3)2
/ (Ptot / 3) = 4/3 · Ptot
4/3 · Ptot = 0,141
De donde se deduce:
Ptot = 0,105 atm](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-498-320.jpg)
![ISLAS BALEARES / SEPTIEMBRE 98. COU /QUÍMICA /CINÉTICA Y EQUILIBRIO
/ OPCIÓN A / Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Calcular el pH de la disolución formada por 100 mL de ácido clorhídrico 0,1 M, 100
mL de ácido nítrico 0,1 M y agua hasta completar los 500 mL.
Solución:
Se trata de dos ácidos fuertes y por tanto completamente disociados.
HCl + H2O Cl-
+ H3O+
HNO3 + H2O NO3
-
+ H3O+
[HCl] = [H3O+
] = 0,1 M
[HNO3] = [H3O+
] = 0,1 M
Se hallan los moles de iones hidronio:
n = V · M
n total H3O+
= (0,1 · 0,1) + (0,1 · 0,1) = 0,02 moles
V total = 0,5 L
[H3O+
] total = 0,02 / 0,5 = 0,04 M
pH = -log [H3O+
] = -log (0,04)
pH= 1,39](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-499-320.jpg)
![ISLAS BALEARES / SEPTIEMBRE 98. COU /QUÍMICA /CINÉTICA Y EQUILIBRIO
/ OPCIÓN B / Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- El producto de solubilidad del hidróxido de calcio es 8·10-6. En una disolución de
cloruro de calcio 0,1 M , ¿a partir de qué pH comenzará a precipitar el hidróxido de
calcio?
Solución:
El equilibrio de solubilidad del hidróxido insoluble es el siguiente:
Ca(OH)2 (s) D Ca2+ + 2 OH-
Para que se produzca precipitado, el producto real de las concentraciones de los reactivos
(según la ley del equilibrio) debe ser mayor que Ks.
Ks = 8·10-6
Para que haya precipitación se ha de cumplir que: [Ca2+] · [OH-]2
8·10-6
Los iones Ca2+presentes en el medio se deben, prácticamente, a la sal soluble CaCl2, que esta
disociada completamente:
CaCl2 Ca2+ + 2 Cl-
[CaCl2] = [Ca2+] = 0,1 M
En la saturación se cumpliría: (0,1) · [OH-]2
= 8·10-6
[OH-]2
= 8·10-7
[OH-] = 8,9 · 10-4
pOH = - log (8,9 · 10-4
) = 3,04
pH = 14 – pOH = 14 – 3,4 = 10,6
El hidróxido de calcio comenzará a precipitar a partir de un pH de 10,6.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-500-320.jpg)
![ISLAS BALEARES / SEPTIEMBRE 99. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- Al introducir 1 mol de PCl5 en un recipiente de 1 litro se produce la disociación del
gas y se establece el equilibrio siguiente:
PCl5 D PCl3 + Cl2 ∆H 0 (la disociación consume calor)
En el equilibrio se encuentran 0,2 moles de PCl5. Calcula el grado de disociación del
PCl5. Contesta razonadamente si el grado de disociación del PCl5 aumenta, disminuye o
no cambia cuando:
a) Aumenta la presión
b) Disminuye la temperatura.
Solución:
La tabla de este equilibrio homogéneo es:
PCl5 D PCl3 + Cl2
[ ]inic. 1
[ ]r. α
[ ]eq. 1 – α α α
Como en el equilibrio se encuentran 0,2 moles de PCl5 :
0,2 = 1 – α
α = 0,8 (80%)
a) Si aumenta la presión el equilibrio, disminuye el volumen y por ello el número de moles.
Es decir el equilibrio se desplazará hacia izquierda, según el principio de Le Chatelier, por
lo tanto el grado de disociación disminuirá.
b) Si disminuimos la temperatura, al ser la reacción endotérmica el sistema reaccionará,
según el mismo principio aumentándola, es decir, desplazándose hacia la izquierda
también y disminuirá el grado de disociación.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-501-320.jpg)

![ISLAS BALEARES / SEPTIEMBRE 99. COU / QUIMICA / CINETICA Y EQUILIBRIO /
OPCION B / Nº 3.
www.profes.net es un servicio gratuito de Ediciones SM
3B.- Se dispone de una disolución que contiene Ca (II). La concentración de este ion es
2·10-3
M. Calcular la cantidad máxima de sulfato potásico sólido, expresada en gramos, que
se puede añadir a 2 L de la disolución mencionada que nos permita asegurar que no se
forma sulfato de calcio sólido. Suponga que la adición del sólido no incrementa el volumen
de la disolución (Kps = 2,5·10-5
)
Solución:
Para que no aparezca precipitado el producto ionico Q tiene que ser menor que el valor de Kps
CaSO4 D Ca+2
+ SO4
-2
Siendo Q = [Ca+2
] · [SO4
-2
]
Kps [Ca+2
][SO4
-2
]
Por lo tanto: 2,5·10-5
2·10-3
· [SO4
-2
]
[SO4
-2
] 2,5·10-5
/ 2·10-3
[SO4
-2
] 0,0125 M
Como el sulfato potásico es una sal soluble se disocia completamente de manera que :
moles máximos de SO4
-2
= moles máximos de K2SO4 = M · V = 0,0125 · 2 = 0,025 moles
m K2SO4 = moles · Pm = 0,025 · 174,3 = 4,36 g
El máximo de sulfato potásico que pueden añadirse a los 2 litros de disolución inicial para asegurar
que no se forma precipitado de sulfato de calcio, son 4,36 g.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-503-320.jpg)

![ISLAS BALEARES / JUNIO 98. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- En un depósito de 1 litro se introducen 0,003 moles de tetraóxido de dinitrógeno. Se
termostatiza a 273 K. Pasado un cierto tiempo, se establece el equilibrio siguiente:
N2O4 (g) 2NO2 (g)
Se sabe que en el equilibrio el recipiente soporta una presión de 0,1 atm. Calcule:
a) Número de moles de cada gas en el equilibrio.
b) Ke.
Solución:
a) Es un equilibrio homogéneo en fase gaseosa:
N2O4 (g) 2NO2 (g)
no 0,003
nr x
neq 0,003-x 2x
nT = 0,003-x + 2x = 0,003 + x
PT · V = nT · R · T 0,1 · 1 = (0,003 + x) · (0,082 · 273)
x = 0,00147
n N2O4 = 0,003 – 0,00147 = 1,5 · 10-3
moles de N2O4
n NO2 = 2 · 0,00147 = 2,9 · 10-3
moles de NO2
b) La expresión de la K de equilibrio es:
Kc = [NO2]2
/ [N2O4] y puesto que el volumen es 1 litro al sustituir se tiene:
Kc = (2,9 · 10-3
/ 1)2
/ (1,5 · 10-3
/ 1)
Kc = 5,616 · 10-3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-505-320.jpg)
![LA RIOJA / JUNIO 00. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCION A / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Se necesitaron 36,4 ml de una disolución de NaOH de concentración desconocida
para valorar 50 ml de ácido acético 0,125M, con fenolftaleína (vira entre 8 y 9,5) como
indicador.
a) ¿Cuál es el pH de la disolución de NaOH?
b) ¿Cuál es el pH en el punto de equivalencia (considere los volúmenes aditivos)?
c) ¿Por qué se ha utilizado fenolftaleína como indicador?
Ka ác.acético = 1,8·10-5
Solución:
a) En toda valoración se cumple que:
nº equivalentes ácido = nº equivalentes base
Va · Na = Vb · Nb
Conocemos:
V base = 36,4 ml
V ácido = 50 ml
M ácido = N ácido = 0,125 N
Despejando la concentración de la base:
Nb = (50 ·10-3
· 0,125) / (36,4 · 10-3
) = 0,17 eq/L
Mb = 0,17 mol/L
Como el NaOH es una base fuerte, estará totalmenta disociada, pudiendo conocer la
concentración de OH-
, y con ella el pH:
NaOH Na+
+ OH-
[ ]inicial 0,17 -- --
[ ]final -- 0,17 0,17
[OH-
] = 0,17 M
pOH = -log [OH-
] = 0,77
pH = 14 – pOH = 13,23
Como cabía esperar, es un pH muy básico.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-506-320.jpg)
![LA RIOJA / JUNIO 00. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCION A / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
b) Hasta alcanzar el punto de equivalencia, habrán reaccionado el ácido y la base:
NaOH + CH3COOH CH3COONa + H2O
Calculamos los moles de cada sustancia antes de la mezcla, y las nuevas concentraciones
después de la mezcla:
Moles iniciales de NaOH = 0,17 · 0,0364 = 6,2·10-3
moles
Moles iniciales de CH3COOH = 0,125 · 0,05 = 6,2·10-3
moles
V final = 0,0364 + 0,05 = 0,0864 L
Las concentraciones después de la mezcla son:
M´(NaOH) = 6,2·10-3
/ 0,0864 = 0,071 M
M´(CH3COOH) = 6,2·10-3
/ 0,0864 = 0,071 M
Con estos datos, volvemos a la reacciónentre el ácido y la base:
NaOH + CH3COOH CH3COONa + H2O
[ ]inicial 0,071 0,071 --- ---
[ ]final --- --- 0,071
Tenemos, pues, una sal soluble de concentración 0,071M, que estará totalmente disociada
en sus iones:
CH3COONa Na+
+ CH3COO-
[ ]inicial 0,071 -- --
[ ]final -- 0,071 0,071
Los iones CH3COO-
proceden de un ácido débil, y se hidrolizan, liberándose iones OH-
, a
partir de los cuales determinamos el pH:
CH3COO-
+ H2O D CH3COOH + OH-
[ ]inicial 0,071 -- --
[ ]final 0,071 – x x x](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-507-320.jpg)
![LA RIOJA / JUNIO 00. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCION A / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
La constante de hidrólisis se calcula a partir de la Kw, y de la Ka del acético.
Kh = Kw / Ka = 10-14
/ 1,8·10-5
= 5,5·10-9
5,5·10-9
= x2
/ (0,071 – x)
x = 1,96·10-5
M
pOH = -log [OH-
]= -log (1,96·10-5
) = 4,7
pH = 14 – pOH = 14 – 4,7 = 9,3
c) Se emplea como indicador ácido-base la fenolftaleína porque su intervalo de viraje está
entre 8 y 9,5. Este intervalo de pH abarca elpH del punto de equivalencia, correspondiente a
la reacciónentre el ácido acético y la sosa.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-508-320.jpg)
![LA RIOJA / JUNIO 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCION A /
EJERCICIO 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Dispone de ácido nítrico comercial del 45% de riqueza y 1,28 g/mL de densidad, y
agua destilada. Cómo prepararía: a) 250 mL de una disolución de ac. nítrico 3 M.
b) 2,5 L de una disolución de pH = 1,20?.
Solución:
a) Definición de molaridad: M = moles de soluto / litro de disolución
M = [densidad (g/L) · %] / Pm
Hallamos la molaridad inicial del ácido concentrado:
M conc. = (1, 28 ⋅ 1000 ⋅ 0,45) / 63 = 9,14 mol / L
N conc. = M · val = 9,14 · 1 = 9,14 eq / L
N dil. = 3 · 1 = 3 eq / L
La dilución se basa en una ecuación de igualdad de equivalentes:
nº equivalentes concentrado = nº equivalentes de diluido
V · N = V´ · N´
V · 9,14 = (250·10-3
) · 3
V = 0,082 L = 82,0 mL HNO3 comercial
Se mide este volumen en una probeta de 100 mL y se transvasa a un matraz o probeta.
Después se añade agua hasta completar los 250 cc.
Las precauciones son: nunca utilizar pipetas donde se succione con la boca sino mediante pera
de goma. Por otro lado, se debe añadir el agua sobre el ácido y nunca al revés, para evitar
proyecciones de gotas de dicho ácido fuerte.
b) Según la definición: pH = -log [H3O+
]
Es decir que [H3O+
] = 10-pH
= 10-1,2
= 0,063 mol / L
El ácido nítrico es un ácido fuerte totalmente disociado:
HNO3 + H2O → NO3
-
+ H3O+
Por lo que[HNO3] = 0,063 mol / L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-509-320.jpg)

![LA RIOJA / JUNIO 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCION A /
EJERCICIO 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- A 50 mL de una disolución de nitrato de plata se añaden 50 mL de ácido clorhídrico
3 M, con lo que precipitan 0,652 g de cloruro de plata.
a) ¿Cuál era la concentración molar de la disolución de nitrato de plata?.
b) ¿Qué cantidad (g/L) de plata permanecerá disuelta? (Suponga los vol. aditivos).
Solución:
a) La reacción es la siguiente:
AgNO3 (ac) + HCl (ac) → AgCl (s) + HNO3 (ac)
Sabiendo la molaridad del HCl podemos obtener los moles que hay de éste y, por tanto, los
de AgNO3, ya que reaccionan en la misma proporción:
M = nº moles / L disolución
n HCl = V · M = 0,050 · 3 = 0,15 moles HCl
n AgNO3 = 0,15 moles
M AgNO3 = 0,15 / 0,050
Molaridad AgNO3 = 3 mol / L
b) El cloruro de plata es una sal insoluble que esta muy poco disociada, ello se expresa
mediante el equilibrio de solubilidad siguiente:
AgCl (s) D Ag+
+ Cl-
m AgCl (s) = 0,652 g
Pm AgCl = 143,4
n AgCl = m / Pm =0,652 / 143,4 = 4,546 · 10-3
moles
El nitrato de plata es una sal soluble, es decir, totalmente disociada:
AgNO3 → Ag+
+ NO3
-
n AgNO3 = 0,15 moles = n Ag (iniciales)
De los 0,15 moles de plata que teníamos precipitan 4,546 · 10-3
por lo que quedan 0,145454
moles sin precipitar, es decir, disueltos.
m Ag (disuelta) = n · Pat = 0,145454 · 107,87 = 15,694 g
[Ag +
] = m / V total =15,694 / (0,050 + 0,050) = 156,94 g / L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-511-320.jpg)
![LA RIOJA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- En la reacción 2 NO + O2 šš 2 NO2 a una determinada temperatura, se ha obtenido
la siguiente información:
[NO] inicial (m / l) [O2] inicial (m / l) velocidad inicial (m / l· s)
0,020 0,010 0,028
0,020 0,020 0,057
0,040 0,020 0,224
0,010 0,020 0,014
Calcular el orden total de la reacción y su constante de velocidad.
Solución:
La ecuación de velocidad para esta reacción será:
v = k · [NO]x
· [O2]y
Siendo x, e y, los órdenes parciales de reacción, cuyo valor se ha de calcular y sumar para
obtener el orden total.
Para ello, se realiza el cociente entre velocidades de reacción, tomadas 2 a 2, manteniendo la
concentración de uno de los reactivos constante, de la siguiente manera:
v2 / v1 = 0,057 / 0,028 = 2
Y a su vez, expresando las velocidades en función de las ecuaciones de velocidad, se puede
escribir:
v2 / v1 = [k · (0,020)x
· (0,020)y
] / [k · (0,020)x
· (0,010)y
]
Igualando ambas expresiones se tiene:
2y
= 2
y = 1
Igualmente se procede con otro par de valores, y expresiones de velocidad:
v3 / v2 = 0,224 / 0,057 = 3.94 ϕ 4
v3 / v2 = [k · (0,040)x
· (0,020)y
] / [k · (0,020)x
· (0,020)y
]](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-512-320.jpg)
![LA RIOJA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
De donde:
2x
= 4 = 22
x = 2
Y la ecuación de velocidad, quedaría:
v = k · [NO]2
· [O2]
Siendo el orden total de reacción:
n = x + y = 2 + 1 = 3
De la expresión de velocidad para cualquiera de los datos dados, y puesto que ya se conocen
los órdenes parciales, se deduce el valor de k:
k = v1 / ([NO]x
· [O2]y
)1
k = 0,028 / ((0,020)2
· 0,010)
k = 7000 mol-2
· L2
· s-1](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-513-320.jpg)

![LA RIOJA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
/ OPCIÓN A / CUESTIÓN Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- En la reacción 2 NO + 2 H2 ττ N2 + 2 H2O, a 1100 K, se obtuvieron los siguientes
datos:
[NO]inicial (m/ L) [H2]inicial (m/ L) Velocidad inicial (m/ L · s)
0,005 0,0025 3· 10-5
0,015 0,0025 9· 10-5
0,015 0,010 3,6· 10-4
Solución
La ecuación de velocidad para la reacción dada será:
V = K · [H2]a
· [NO]b
Donde a y b son los órdenes parciales de la reacción, que sólo pueden determinarse
experimentalmente; para ello se recurre a los datos de la tabla:
Se plantean las ecuaciones de velocidad para dos casos en los que la concentración de uno de
los reactivos sea la misma, determinando el orden parcial del otro reactivo:
3· 10-5
= K · (0,005)a
· (0,0025)a
9· 10-5
= K · (0,015)a
· (0,0025)b
Dividiendo ambas expresiones, se tiene:
1/ 3 = (1/ 3)a
De donde: a = 1
Lo mismo se hace para averiguar el valor de b:
9· 10-5
= K · (0,015)a
· (0,0025)b
3,6· 10-4
= K · (0,015)a
· (0,010)b
1/ 4 = (1/ 4)b
Por lo tanto: b = 1
Luego:
Órdenes parciales: a = 1, b = 1
Orden total: a + b = 2
Y ahora la K se halla con una de las tres ecuaciones de velocidad:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-515-320.jpg)


![LA RIOJA / JUNIO 98. LOGSE / QUIMICA / CINÉTICA y EQUILIBRIO / Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- ¿Cuál será el pH de una disolución formada por 100mL de acetato sódico 0,250 M,
25mL de HCl del 12 % y densidad 1,06 g/mL, y cantidad suficiente de agua para completar
250mL?.
Datos: Ka ác.acético: 1,8·10-5
Solución:
El acetato sódico se encuentra totalmente disociado y aporta al medio iones acetato en una cantidad:
0,250 mol/L · 0,1L = 0,025moles del ión
Estos iones provienen de la disociación de un ác. débil, y al mezclarlos con HCl se produce la
neutralización:
HCl+CH3-COO-
→CH3-COO+Cl
Posteriormente calculamos la cantidad de HCl que nos hace falta para la disolución de 25 mL y de
este modo conoceremos la composición final de la mezcla. Esto último nos ayudara a saber el pH.
M=V·d=25mL·1,06g/mL=26,5g
romolesHClpux
xmol
ngdisolució
HClpuro
ngdisolució
087,0;
4,26
5,36/12
100
12
100
===
Al añadir HCl el acetato pasará a ser ácido acético pero hay parte de clorhidríco que no reacciona:
HCl(en exceso) = 0,087 - 0,025 = 0,062 moles
De este modo hemos conseguido una mezcla de ác.fuerte y débil, pero los iones hidroxilo que
suministra el acético se desprecian frente a los del HCl. Todo esto se debe a la presencia del ión
común que hace que el grado de disociación del acético disminuya.
Por lo tanto la disociación será máxima y la concentración será:
0,062 mol / 0,25 L = 0,248 mol/L de HCl
Como la disociación es mol a mol podemos calcular el pH:
61,0248,0log]log[ 3 =−=−= +
OHpH](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-518-320.jpg)
![LA RIOJA / JUNIO 98. LOGSE / QUIMICA / CINÉTICA y EQUILIBRIO /OPCIÓN A /
Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- En la reacción A + B à C + D, se comprueba experimentalmente que v = k[A]·[B], en
donde: k = K · e-Ea/RT
a) Explique el significado de cada uno de los términos que aparecen en la ecuación de
Arrhenius.
b) En unas determinadas condiciones la velocidad de la reacción es v = 0,01mol/s. Indique
razonadamente varias formas de conseguir que la reacción sea más rápida.
Solución:
a)El significado de cada uno de los elementos de la ecuación de Arrhenius es:
k: constante de Vr
K: factor preexponencial K = Z · P
Z: frecuencia de colisión
P: relacionado con % de moléculas activadas que chocan con orientación favorable
e: base del Ln
Ea: energía de activación
R: cte = 8,31 J/mol K
T: temperatura en grados Kelvin
Con esta ecuación se logra cuantificar el efecto de la temperatura sobre una reacción. Al aumentar la
Ea de las moléculas, y por tanto el % de choques eficaces, se incrementa el % de moléculas
activadas .
Vr aumenta con la temperatura, ya que el factor k influye en la ley de velocidad.
La ecuación exponencial de Arrhenius también se expresa de forma logarítmica:
Lk=LK-
RT
Ea
Esta ecuación sirve para calcular la Ea conociendo el valor de k a diferentes temperaturas. Según la
ecuación exponencial una ligera variación de la temperatura provoca un aumento exponencial de k,
que se refleja en Vr. Esta influencia de la temperatura es tanto mayor cuanto menor sea Ea.
T ↑→ EcMolecular ↑→ %Moléculas Activadas ↑→ Vr ↑
T ↓→ EcMolecular ↓→ %Moléculas Activadas ↓→ Vr ↓
b) Existen varios factores que, a parte de la temperatura, también influyen en la velocidad de una
reacción:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-519-320.jpg)


![LA RIOJA / JUNIO 98. LOGSE / QUIMICA / CINÉTICA y EQUILIBRIO / Nº 6
www.profes.net es un servicio gratuito de Ediciones SM
Sustituyendo en la expresión de la constante de equilibrio nos queda:
Kb=
3
-
4
[NH
]][OH[NH=
; 1,78·10-5
=
X
X
−286,0
2
≈
286.0
2
X
[ ] 35,11;65,210·26,2 3
==== −−
pHpOHOHX
b) El punto de equivalencia de la disolución formada por una valoración de un ácido fuerte y una
base débil es ácido. Esto se debe a la hidrólisis de del ión amonio procedente de la disociación de la
sal formada en la reacción de neutralización.
Por lo tanto el indicador debe virar a valores correspondientes al pH de un ácido débil, así que la
elección del indicador con zona de viraje en el intervalo 3-5 ha sido correcta.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-522-320.jpg)
![LA RIOJA / JUNIO 98.COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A / Nº
2
www.profes.net es un servicio gratuito de Ediciones SM
2.-Para la reacción A + B à C + D, se ha encontrado experimentalmente la siguiente ecuación
de velocidad: ν = k [A]
a) ¿Qué puede deducir acerca de su mecanismo?.
b) ¿Qué reactivos participan en el complejo activado?.
c) Si se dobla la concentración del reactivo B, ¿en qué proporción aumentará la velocidad de
la reacción?.
Solución:
a) Según se observa en la ecuación cinética, la velocidad de reacción depende sólo de la concentración
del reactivo A. Por esta razón, la etapa más lenta del mecanismo de reacción (etapa controlante de vr)
será la correspondiente a la ruptura de la molécula A.
b) En el complejo activado, según lo expuesto anteriormente, solamente participa la molécula del
reactivo A.
c) Si se dobla la concentración del reactivo B la velocidad de reacción no varía ya que [B] no influye en
la ecuación cinética.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-523-320.jpg)
![LA RIOJA / JUNIO 98.COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A / Nº
3
www.profes.net es un servicio gratuito de Ediciones SM
3.- 250 mL de ácido nítrico concentrado del 32% y densidad 1,19 g/mL , se colocan en un
matraz aforado de 1L y se añade agua destilada hasta enrasar. ¿Cuántos mL de la disolución
diluida de ácido nítrico serán necesarios para neutralizar 50 mL de una disolución de NaOH
cuyo pH es 13,93?.
Solución:
Hallamos primero los gramos de ácido nítrico concentrado sabiendo que su pureza es de un 32%:
250 mL · 1,19 g/mL · 0,32 = 95,2 g.
Traducido a moles, sabiendo que la masa molecular del ácido es 63.
n HNO3 = 95,2 / 63 = 1,51
Como el volumen de disolución es 1L, la concentración de la disolución es: 1,51 M.
La reacción será la siguiente: HNO3 + NaOH -- NaNO3 + H2O
Sabemos que el pH de la disolución de NaOH es 13,93 por lo que el pOH = 0,07
De ahí se deduce que [OH-
] = 0,85 M
Como la reacción se produce mol a mol aplicamos: V · M = V’ · M’
V · 1,51 = 50 · 0,85
V = 28,1 mL de disolución diluida de HNO3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-524-320.jpg)
![LA RIOJA / JUNIO 98.COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A / Nº
5
www.profes.net es un servicio gratuito de Ediciones SM
5.- a)¿Cuál es la solubilidad en agua (en g/L) del hidróxido de aluminio III, cuyo valor de Ks =
2,0·10-33
?.
b) ¿Cuál será la concentración del Al+++
que permanecerá disuelta si a una disolución de 95
mL de Al(NO3)3 1,25 M, se añaden 5 mL de NaOH 0,5M?.
Datos: Masas atómicas: H=1; N=14; O=16; Na=23; Al=27; S=32; Zn=65.
Solución:
a) Planteamos primero el equilibrio de solubilidad:
Al(OH)3 (s) ↔ Al3+ (aq) + 3OH-
(aq)
s s 3s
Ks = [Al3+
] · [OH-
]3
= s · (3s)3
= 27 s4
= 2,0 · 10-33
; s = 2,9 · 109
mol / L
b) Sabemos que en los 95 ml de Al(NO3) hay:
0,095 · 1,25 = 0,1188 moles de iones Al3+
, puesto que la sal esta totalmente disociada.
En los 5 mL de NaOH hay: 0,005 · 0,5 = 2,5 ·10-3
moles de iones OH-
Esos moles reaccionarán con 2,5 · 103
/ 3 = 8,3 · 10-4
moles de iones Al3+
para formar un precipitado
de Al(OH)3.
En disolución permanecerán: 0,1188 – 8,3 · 10-4
= 0,1180 mol de iones Al3+
, en un volumen de 95 + 5
= 100 mL.
La concentración de iones Al3+
que permanecerá disuelta será, por tanto:
0,118 / 0,100 = 1,18 mol / L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-525-320.jpg)
![LA RIOJA / JUNIO 99. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A
/ Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- a) ¿Cuál será el pH de una disolución preparada con 50 mL de ácido nítrico
comercial de 1,16 g/mL de densidad y 26% de riqueza y cantidad suficiente de agua
para completar 500 mL?.
b) Para valorar exactamente esa disolución se utiliza otra disolución de NaOH. Indique
qué material necesita y describa la forma de operar.
Solución:
a) Primero calculamos la masa del ácido a partir del volumen y la densidad,
m = V·d; m = 50 · 1,16 = 58 g.
De estos 58 g sólo el 26 % es ácido puro: 58 g · 0,26 = 15,08 g de HNO3
Para calcular la molaridad del ácido, calculamos el número de moles y lo dividimos entre el
volumen total de la disolución (500 mL):
Pm = 63 g/mol
M = (15,08/63) / 500·103 = 0,48 mol/L
La reacción que tiene lugar es la siguiente:
HNO3 + H2O NO3- + H3O+
Como el ácido nítrico es un ácido fuerte, se encuentra totalmente disociado y, por lo tanto:
[HNO3] =[H3O+]
pH = -log [H3O+] = -log 0,48 = 0,32
b) Disponemos de una disolución de NaOH de concentración conocida. Para hacer la
valoración se utilizará una bureta, una pinza, una pipeta, un embudo y un matraz erlenmeyer.
Deben seguirse los siguientes pasos:
1.- Se toma con la pipeta una cantidad exacta de ácido a valorar, por ejemplo, 25 mL.
2.- Se vierte el ácido en un matraz erlenmeyer y se añaden unas gotas de indicador. Puede
usarse, por ejemplo, la fenolftaleína, que en medio ácido es incolora y en medio básico se
vuelve rosada.
3.- Se enrasa una bureta de 50 mL con la disolución de la base, en este caso NaOH, con la
ayuda del embudo.
4.- Se añade lentamente la disolución de NaOH sobre la muestra de HNO3 contenida en el
erlenmeyer al tiempo que se agita la mezcla.
5.- El punto de equivalencia se alcanza cuando la mezcla adquiere un color rosado que](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-526-320.jpg)

![LA RIOJA / JUNIO 99. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A / nº
3
www.profes.net es un servicio gratuito de Ediciones SM
3.- a) Escriba los equilibrios químicos que se establecen al disolver 10 g de nitrato amónico
en la cantidad suficiente de agua para conseguir 250 mL de disolución.
b) ¿Cuál será el pH de la disolución?
Kb amoníaco: 1,8·10-5
.
Solución:
a) El equilibrio de solubilidad es el siguiente: NH4NO3 (s) D NH4
+
(aq) + NO3
-
(aq)
Este equilibrio está totalmente desplazado hacia la derecha, por ser una sal soluble.
El NO3
-
es una base débil, ya que su ácido conjugado es muy fuerte (HNO3), y no reacciona con el
agua. Sin embargo el NH4
+
es un ácido fuerte, ya que su base conjugada es débil (NH3), y reacciona
con el agua sufriendo hidrólisis ácida:
NH4
+
+ H2O D NH3 + H3O+
b) Para averiguar la concentración de nitrato amónico, pasamos su masa a moles y la dividimos entre
el volumen de la disolución:
10 / 80 = 0,125 moles
Co = 0,125 mol / 250·10-3
L = 0,50 M
NH4
+
+ H2O D NH3 + H3O+
Co 0,50
Cr x
Ceq 0,50−x x x
Kh ≡ Ka(NH4
+
) = [NH3] [H3O+
] /[NH4
+
] = Kw / Kb(NH3) = 1,0·10-14
/ 1,8·10-5
= 5,56·10-10
Sustituyendo los correspondientes valores se obtiene:
5,56·10-10
= x2
/ 0,50−x
Como x 1: 5,56·10-10
= x2
/ 0,50
x = 1,67·10-5
pH = -log [H3O+
]
[H3O+
] = x = 1,67·10-5
mol/L
pH = 4,8](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-528-320.jpg)




![LA RIOJA / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / EJERCICIO 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Calcule el volumen de una disolución acuosa saturada que contenga 0,44g de PbCl2,
cuyo Ks = 1,7·10-5
.
Solución:
El cloruro de plomo (II) es una sal poco soluble que tiene el siguiente equilibrio de
solubilidad:
PbCl2 (s) D Pb2+
+ 2 Cl-
C inicial s
C equilibrio s 2s
Aplicando la ley del producto de solubilidad, se tiene:
Ks = [Pb2+
] · [Cl-
]2
Ks = s · (2s)2
= 4·s3
1,7·10-5
= 4·s3
s = 1,61·10-2
mol/L
Como la masa molecular de esta sal es: Mm = 278,2
s = 1,61·10-2
mol/L · 278,2 g/mol = 4,47 g/L
Esta será la concentraciónde una disoluciónsaturada de cloruro de plomo (II).
m muestra = 0,44 g
Como la proporción m / V se tiene que mantener en la disolución saturada:
4,47 g / 1L = 0,44 g / V L
V = 0,0984 L
V disolución = 98,4 mL
Este será el volúmen de disolución saturada de esta sal que contendrá la masa citada en el
enunciado de 0,44 g.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-533-320.jpg)
![LA RIOJA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Una reacción tiene a 80ºC una energía de activación de 50 KJ / mol, y una velocidad
de 1,3·10-5
mol / L·s. ¿Cuál sería su velocidad si se añadiera un catalizador que redujera
su energía de activación en 1/3 de la original?. (R = 8,31 J / mol·K)
Solución:
Inicialmente: v = 1,3·10-5
mol / L·s
Ea = 50 KJ / mol = 50000 J / mol
T = 80ºC = 353 K
Al final, tras añadir un catalizador:
v´ = ¿
Ea ´ = 50000 / 3 J / mol
T = 353 K
Se escriben las expresiones de la constante de velocidad en función de la energía de
activación para los dos estados:
K = A · exp (- Ea / R·T)
K´ = A · exp (- Ea / R·T)
Y suponiendo que la reacción que tienen lugar es:
A + B š C
Se escriben las ecuaciones de velocidad:
V = K· [A]x
·[B]y
V´= K´· [A]x
·[B]y
Se dividen, en primer lugar, las expresiones de las constantes, y se sustituyen la temperatura,
R y la energía de activación, obteniendo:
K A · exp (- Ea / R·T) exp (- 50000 / 8,31·353)
= =
K´ A · exp (- Ea / R·T) exp (- (50000 / 3) / 8,31·353)](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-534-320.jpg)
![LA RIOJA / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
K / K´= exp (- 11,36) = 1,16·10-5
Y de igual forma, se dividen las expresiones de las velocidades:
v K· [A]x
·[B]y
=
v´ K´· [A]x
·[B]y
De donde se tiene:
v / v´= K / K´
Y como: K / K´= 1,16·10-5
v´= v / 1,16·10-5
=1,3·10-5
/ 1,16·10-5
v = 1,12 mol · L-1
· s-1
Como era de esperar, la velocidad aumenta al añadir un catalizador.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-535-320.jpg)

![LA RIOJA / SEPTIEMBRE 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
2.- Al calentar una mezcla de 4 moles de CO2 y 2 moles de H2 a en un recipiente de 1 L a
100 °C, se alcanza el equilibrio cuando se han formado 0,6 moles de CO y 0,6 moles de
H2O (g)
a) Calcular la constante de equilibrio de la reacción.
b) Si una vez alcanzado el equilibrio se reduce la presión total del sistema a la mitad,
¿aumentará la cantidad de CO formado?
c) ¿Cómo afectará a la reacción la introducción de 0,1 mol de H2O(g) una vez alcanzado
el equilibrio? Calcule las nuevas concentraciones cuando se restablezca el equilibrio.
Solución:
Se escribe el equilibrio, llamando x a la cantidad disociada:
CO2 (g) + H2 (g) ‡ CO (g) + H2O (g)
Moles iniciales 4 2 -- --
Moles equilibrio 4 - x 2 - x 0,6 0,6
Pero como se conocen los moles formados de productos, se tiene el valor de x:
x = 0,6 moles
a) La expresión de Kc será:
Kc = ([CO] · [H2O]) / ([CO2] · [H2])
Se sustituyen las concentraciones en el equilibrio, que coinciden con los moles, al ser V total
= 1 L, y se opera:
Kc = 0,62
/ [(4 - 0,6) · (2 - 0,6)] = 0,075
b) El Principio de Le´Chatelier, dice que si sobre un sistema en equilibrio se introduce alguna
modificación, el sistema tenderá a desplazarse en el sentido que se oponga a tal alteración:
Una disminución de la presión hará que el equilibrio se desplace en el sentido en que sea
mayor el número de moles de gases, para que se mantenga: P · V = cte.
En este caso, hay los mismos moles gaseosos en ambos lados, luego hacia el equilibrio no se
verá alterado.
c) Si aumenta la concentración de agua (producto), el sistema tenderá a disminuirla, es decir,
se desplazará hacia la izquierda.
El nuevo equilibrio será:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-537-320.jpg)
![LA RIOJA / SEPTIEMBRE 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
CO (g) + H2O (g) CO2 (g) + H2 (g)
Moles iniciales 0,6 0,6 + 0,1 3,4 1,4
Moles equilibrio 0,6 - x´ 0,7 - x` 3,4 + x´ 1,4 + x´
Donde x´ será la nueva parte disociada:
La expresión de la nueva Kc, a la que llamamos Kc´ será:
Kc´ = (CO2] · [H2]) / ([CO] · [H2O])
Se ve que es la inversa de la Kc antes hallada, luego, se sustituyen las concentraciones en el
equilibrio, que coinciden con los moles, al ser V total = 1 L, y se opera:
Kc´= 1 / Kc = 1 / 0,075 = [(3,4 + x´) · (1,4 + x´)] / [(0,6 - x´) · (0,7 - x´)] = 13,3
De donde:
x´= 0,039 M
Y las nuevas concentraciones en el equilibrio serán:
[CO] = 0,561 M
[H2O] = 0,661 M
[CO2]= 3,43 M
[H2] = 1,43 M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-538-320.jpg)
![LA RIOJA / SEPTIEMBRE 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / CUESTIÓN Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
3.- Dadas dos disoluciones de 30 mL de ácido acético y de ácido clorhídrico 0,5 M:
a) calcule el pH de ambas disoluciones.
b) ¿Qué cantidad de agua habrá que añadir a la más ácida para que ambas lleguen al
mismo pH?
Ka (CH3COOH) = 1,8 · 10-5
Solución:
a) El ácido acético (HAc) es débil, se disocia parcialmente:
HAc + H2O ‡ H3O+
+ Ac-
[ ]inicial 0,5 -- --
[ ]equilibrio 0,5 - x x x
La expresión de la constante de acidez es:
Ka = ([H3O+
] · [Ac-
]) / [HAc]
Ka = 1,8 · 10-5
= x2
/ (0,5 - x)
De donde se tiene:
x = 3 · 10-3
M
Por definición:
pH = - log [H3O+
] = 2,52
Sin embargo, el HCl está totalmente disociado, pues es fuerte, luego la concentración final de
protones será la inicial del ácido:
[H3O+
] = 0,5 M
pH = - log [H3O+
] = 0,30
b) Habrá que añadir agua al HCl, de menor pH, y por tanto, más ácido, para igualar los pH; se
debe diluir, cumpliéndose:
nº equivalentes concentrada = nº equivalentes diluida
O lo que es lo mismo:
(N · V)c = (N · V)d](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-539-320.jpg)

![LA RIOJA / SEPTIEMBRE 98.LOGSE / QUIMICA / CINETICA Y EQUILIBRIO /
CUESTION Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Una disolución acuosa 0,02 M de una base débil XOH, está disociada un 1,5%. Calcule
la constante de disociación de la base.
Solución:
Esta disociación seguiría el siguiente esquema:
XOH D X+
+ OH-
[inicial] 0,02
[reacionante] 0,02α
[equilibrio] 0,02(1-α) 0,02α 0,02α
Sabiendo que α es el grado de disociación y éste es un dato que nos dan en el problema podemos
calcular fácilmente la constante de disociación de la base teniendo en cuenta que si está disociada un
1,5% significa que α = 0,015
Este es el valor de la constante buscada.
LmolKb
XOH
OHX
Kb
/10568,4
)015,01(02,0
)02,0·015,0(
][
]][[
6
2
−
−+
⋅=
−
⋅
==](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-541-320.jpg)
![LA RIOJA / SEPTIEMBRE 98. COU / QUIMICA / CINETICA Y EQUILIBRIO / OPCION
A / Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- La constante de disociación de un ácido monoprótico HX es 0,68·10-5
y su Pm =46.
a) ¿Cuál será la concentración del ácido sin disociar en una disolución preparada con
1,3216 g de ácido y cantidad suficiente de agua para completar un litro de disolución?
b) ¿Cuál será el grado de disociación, y el pH de la disolución.?
Solución:
a) Concentración del ácido HX:
M = nº de moles / V(L)
M = ( m(g) / Pm ) / V(L)
[HX] = (1,3216 / 46) / 1 = 0,028 mol / L
b) Equilibrio de disociación: Co = 0,028 M
HX D H+
+ X-
Se disocia: 0,028α - -
Se forma: - 0,028α 0,028α
Equilibrio: 0,028 (1-α) 0,028α 0,028α
Aplicando la constante de disociación:
K = [H+
]·[X-
] / [HX]
K = (0,028α)2
/ 0,028(1-α)
K = 0,028 α2
/ (1-α)
0,68·10-5
= 0,028α2
/ (1-α)
0,028 α2
+ 0,68·10-5
α - 0,68·10-5
= 0
Resolviendo esta ecuación de segundo grado, se obtiene como valor químicamente correcto:
α = 0,015 = 1,5%
Para conocer el pH, sabemos que :
pH = -log [H+
]
[H+
] = 0,028 · 0,015 = 4,2·10-4
M
pH = -log (4,2·10-4
)
pH = 3,38.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-542-320.jpg)
![LA RIOJA / SEPTIEMBRE 99.LOGSE / QUIMICA/ CINETICA Y EQUILIBRIO /
CUESTIÓN Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- ¿Cuál es la concentración molar de una disolución de nitrato amónico, cuyo pH es el
mismo de una disolución 1,24 ·10-5
M de ácido clorhídrico?
Solución:
Disolución 1,24·10-5
M de HCl.
El HCl es un ácido fuerte, que en disolución acuosa se disocia totalmente.
HCl + H2O → H3O+
+ Cl-
Como la disociación es total, podemos decir que [H3O+
] = 1,24·10-5
Por lo que siendo pH = -log[H3O+
], el pH de la disolución de HCl será:
pH= -log 1,24·10-5
= 4,9.
De tal manera que tendremos una disolución de nitrato amónico de pH = 4,9.
El nitrato amónico es una sal soluble que se disocia completamente dando iones amonio e iones
nitrato:
NH4NO3 → NH4
+
+ NO3
-
El ión amonio es un ácido fuerte por lo que sufrirá hidrólisis, mientras que el ión nitrato es
una base débil que no sufrirá hidrólisis.
Hidrólisis del amonio:
NH4
+
+ H2O D NH3 + H3O+
La constante de hidrólisis se calcula a partir de la constante de la base (amoniaco)
Este dato no es facilitado por el enunciado del ejercicio.
Sabemos que Kb amoniaco = 1,8·10-5
, y que el producto iónico del agua es Kw =10-14
Kh = Kw / Kb
Kh = 10-14
/ 11,8·10-5
= 5,5·10-10
Aplicando la ley de acción de masas al equilibrio Kh =[NH3]·[H3O+
] / [NH4
+
]
Conocemos [H3O+
] = 1,24·10-5
, para que el pH sea pH = 4,9, y nos consta que en el equilibrio
tiene que cumplirse que [H3O+
] = [NH3] = 1,24·10-5
M
De modo que: [NH4
+
] = [NH3]·[H3O+
] / Kh
[NH4
+
] = (1,24·10-5
)2
/ 5,5·10-10
= 0,276 M
Como la concentración de amonio ha de ser la misma que la concentración de nitrato amónico:
[NH4NO3] = 0,276 M](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-543-320.jpg)
![COMUNIDAD DE NAVARRA /JUNIO 2004. LOGSE / QUÍMICA /CINETICA Y
EQUILIBRIO/OPCION B/CUESTION 3
B3. Defina velocidad, orden y molecularidad de una reacción química. Explique sus
posibles diferencias para el caso:
[ ][ ]2(g) 2(g) 2 (g) 2 22 NO + F 2NO F dónde v=k NO F
y justifique cómo se lograría aumentar más la rapidez de la reacción si duplicando la
cantidad inicial de dióxido de nitrógeno o duplicando la cantidad inicial de flúor.
SOLUCIÓN CUESTIÓN 3 (OPCIÓN B)
Se define la velocidad de reacción como el cambio en la concentración de reactivo o
producto por unidad de tiempo. Cuando los coeficientes estequiométricos no coinciden, como
ocurre en nuestro ejemplo, las concentraciones varían a diferentes velocidades:
[ ] [ ] [ ]2 21 1
2 2
NO F NO F
v
t t
∆ ∆
= = − = −
∆ ∆
2
t
∆
∆
Cuando la velocidad de una reacción química se puede expresar por una ecuación del tipo:
[ ] [ ]v k A B
α β
= , siendo A y B las sustancias reaccionantes, se llama orden de reacción a la
suma de α y β. Hay que tener en cuenta que α y β no tienen porque ser iguales a los
coeficientes estequiométricos. En nuestro ejemplo, el orden de reacción es 2.
La molecularidad de una reacción está relacionada con los mecanismos de reacción. En una
reacción elemental la molecularidad está relacionada con el número total de especies que
intervienen como reactivos en la etapa elemental. En nuestro ejemplo, como la ecuación de
velocidad indica que es un mecanismo por etapas y no se da información sobre los
intermedios de reacción, no se puede decir cual es la molecularidad.
(b) De acuerdo con la ecuación de la velocidad de reacción la velocidad de reacción se
aumentaría en el mismo grado duplicando la cantidad inicial de dióxido de nitrógeno que la
cantidad inicial de flúor.
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-544-320.jpg)
![COMUNIDAD DE NAVARRA /JUNIO 2004. LOGSE / QUÍMICA /CINETICA Y
EQUILIBRIO/OPCION B/CUESTION 4
B4. Razone que disolución será más ácida si una de acetato potásico 0,3 M u otra de
bromuro amónico 0,1 M, Datos: ácido acético Ka = 1,8 · 10-5
, amoniaco Kb = 1,8 · 10-5
SOLUCIÓN CUESTIÓN 4 (OPCIÓN B)
El acetato potásico es una sal de ácido débil y base fuerte que estará totalmente disociada
según la siguiente ecuación:
3 3CH COOK CH COO K− +
− → − +
En esta reacción, el catión, que proviene de una base fuerte, no se hidroliza, sin embargo, el
anión acetato es una base fuerte y se hidroliza según el siguiente equilibrio:
3 2 3CH COO H O CH COOH OH− −
− + − +
y el resultado es una disolución básica.
El bromuro amónico es una sal de ácido fuerte y base débil que estará totalmente disociada
según la siguiente ecuación:
4 4HN Br NH Br+ −
→ +
En esta reacción el anión bromuro no se hidroliza. Sin embargo, el catión amonio lo hace
según el siguiente equilibrio:
4 2 4NH H O NH OH H+ +
+ +
y el resultado es una disolución ácida. Luego podemos concluir que la disolución de bromuro
amónico es más ácida que la disolución de acetato potásico.
Cuantitativamente podemos calcular el Ph de las dos disoluciones para comprobarlo:
En el caso del acetato potásico, la hidrólisis del anión tiene la siguiente constante de
hidrólisis:
3 2 3CH COO H O CH COOH OH− −
− + − +
Concentración inicial 0,3 0 0
Concentración
equilibrio
0,3-X X X
[ ]
( )
14
3 10
5
3
2
10
1·10
5,556·10
1,8·10
·
5,556·10
0,3 0,3
w
h
a
h
CH COOH OH K
K
KCH COO
X X X
K
X
− −
−
−−
−
⎡ ⎤− ⎣ ⎦= = = =
⎡ ⎤−⎣ ⎦
= = ≈
−
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-545-320.jpg)
![COMUNIDAD DE NAVARRA /JUNIO 2004. LOGSE / QUÍMICA /CINETICA Y
EQUILIBRIO/OPCION B/CUESTION 4
De dónde X = [OH-
]=1,3 · 10-5
moles/litro.
El pOH = - log [OH-
] = - log (1,3 · 10-5
) = 5
Teniendo en cuenta que pOh + pH = 14, si el pOH es igual a 5, el pH es igual a 9. Por lo
tanto, la disolución 0,3 M de acetato potásico tiene carácter básico.
En el caso de la disolución de bromuro amónico:
4 2 4NH H O NH OH H+ +
+ +
Concentración inicial 0,1 0 0
Concentración
equilibrio
0,1-X X X
[ ]
( )
14
4 10
5
4
2
10
1·10
5,556·10
1,8·10
·
5,556·10
0,1 0,1
w
h
a
h
NH OH H K
K
KNH
X X X
K
X
+ −
−
−+
−
⎡ ⎤⎣ ⎦= = = =
⎡ ⎤⎣ ⎦
= = ≈
−
De dónde X = [H+
] =7,45 · 10-6
moles/litro.
El pH = - log [H+
] = - log (7,45 · 10-6
) = 5,12
Por lo tanto, la disolución 0,1 M de bromuro amónico tiene carácter ácido.
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-546-320.jpg)
![NAVARRA / JUNIO 00. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCION
A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- Calcule el pH que resulta cuando se añaden 0,8 litros de ácido acético 0,25 M a 0,2
litros de hidróxido sódico 1 M.
Datos: constante de disociación: ka = 1,8 · 10-5
Solución:
La reacción ácido-base que tiene lugar entre el ácido acético, CH3 - COOH, y el hidróxido
sódico, NaOH, es:
CH3-COOH + NaOH CH3-COONa + H2O
En los 0,8 L de ácido acético 0,25 M hay:
n = V · M = 0,8 · 0,25 = 0,2 moles de CH3-COOH
En los 0,2 L de NaOH 1 M habrá:
n = V · M = 0,2 · 1 = 0,2 moles de NaOH
Como reacciona 1 mol de ácido acético con 1 mol de sosa según la relación estequiométrica,
se producirá la neutralización de ambos, quedando en la disolución acuosa 0,2 moles de
acetato de sodio, sal totalmente disociada en sus iones: ion acetato, CH3-COO-
, e ión sodio,
Na+
.
La concentración de ambos iones será la misma que la de la sal formada; esto es:
0,2 mol / (0,8 + 0,2) L = 0,2 M
No obstante, al estar presente en la disolución el ion acetato, que procede de un ácido débil (el
ácido acético), este tendrá cierto carácter básico frente al agua. Por tanto, experimentará una
reacción de hidrólisis básica, y el pH de la disolución será alcalino (pH 7).
Llamando x al número de mol/L de ion acetato que experimenta la hidrólisis, podremos
escribir:
Equilibrio de hidrólisis: CH3-COO-
+ H2O D CH3-COOH + OH-
Concentración inicial 0,2 - 0 0
Concentración en equilibrio 0,2-x - x x
La expresión de la constante de equilibrio es:
Kh = [CH3- COOH] [OH-
]/ [CH3-COO-
] = x2
/ 0,2-x
La constante de hidrólisis se halla a partir del producto iónico del agua.
Kh = Kw / Ka = 10-14
/ 1,8·10-5
= 5,6·10-10](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-547-320.jpg)
![NAVARRA / JUNIO 00. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCION
A / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
De aquí se obtiene:
5,6·10-10
= x2
/ 0,2 – x j x2
/ 0,2 (ya que el valor de la x es despreciable con respecto a 0,2)
De aquí obtenemos que:
x = 1,06 - 10-5
M
Es decir: [OH-
1 = 1,06 · 10-5
M
Por lo que:
pOH = -log [OH-
] = -log (1,06 · 105
) =5,0
pH = 14 – pOH = 14 - 5,0 = 9,0](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-548-320.jpg)
![NAVARRA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE B / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- a) Hidrólisis del cloruro amónico. Kd NH3 = 1,8 · 10-5
b) Calcule el pH de una disolución 0,4 M de cloruro amónico.
Solución:
4.- Se resuelven simultáneamente los dos apartados:
El cloruro de amonio es una sal, que en disolución se encuentra totalmente disociada en sus
iones:
NH4Cl τ NH4
+
+ Cl-
El ion cloruro, procede del ácido clorhídrico, que es fuerte, luego no experimentará reacción
con el agua; sin embargo, el ion amonio viene de una base débil, el hidróxido de amonio, y sí
reaccionará con el agua:
NH4
+
+ H2O NH4OH + H3O+
Por lo que, al desprenderse protones, la disolución tendrá carácter ácido.
La expresión de Ka para este último equilibrio es:
Ka = ([NH4OH] · [H3O+
]) / [N4H+
]
Y se relaciona con el producto iónico del agua, Kw, mediante la expresión:
Ka = Kw / Kb
Luego basta sustituir en ella los dos valores conocidos:
Kw = 10-14
Kb = 1,8 · 10-5
De donde se obtiene:
Ka = 5,6 · 10-10
Dado que se conocen el valor de Ka y la concentración inicial de amonio, se puede escribir el
equilibrio que tiene lugar, llamando x a los moles / litro que reaccionan.
NH4
+
+ H2O NH4OH + H3O+
[ ]inicial 0,4 -- --
[ ]equilibrio 0,4 – x x x](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-549-320.jpg)
![NAVARRA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE B / CUESTIÓN 4
www.profes.net es un servicio gratuito de Ediciones SM
Y se sustituye en la expresión de Ka, igualando a su valor, anteriormente calculado:
Ka = 5,6 3 10 = x / (0,4 – x)
De donde se tiene:
x = 1,5 · 10-5
M
Esta será, pues, la concentración de protones presente en disolución, a partir de la cual se
determina al valor de pH:
pH = - log [H3O+
] = 4,8
Como ya se había predicho, la disolución presenta carácter ácido.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-550-320.jpg)
![NAVARRA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
/ OPCIÓN A / CUESTIÓN Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- Calcule el pH y el tanto por ciento de hidrólisis de una disolución 0,02 M de acetato
sódico CH3 - COONa; Ka ácido acético (CH3 -COOH) =1,8· 10-5
Solución:
La sal dada está totalmente disociada en sus iones, existiendo de éstos la misma concentración
al final que de sal al comienzo:
CH3COONa τ CH3COO-
+ Na+
[ ]inicial 0,02 -- --
[ ]final -- 0,02 0,02
A su vez, el ión acetato, procedente del ácido acético, débil, reaccionará con el agua:
CH3COO-
+ H2O CH3COOH + OH-
[ ]inicial 0,02 -- --
[ ]equil. 0,02 · (1 - a) 0,02 · a 0,02 · a
Donde es el grado de hidrólisis del ión con el agua.
La expresión de la constante de hidrólisis para una sustancia que procede de un ácido es:
Kh = Kw / Ka
En este caso:
Kh = 10-14
/ 1,8 · 10-5
= 5,55 · 10-9
Kh = ([CH3COOH]· [OH-
]) / CH3COO-
]
Y sustituyendo por los datos conocidos:
5,55· 10-9
= (0,02 · a)2
/ 0,02 · (1- a)
De donde el valor obtenido para a es:
a = 7,45 · 10-5
= 7,45 · 10-3
%
Como en la hidrólisis se desprenden OH-
, se determina primero el pOH:
pOH = -log [OH-
] = 3,82](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-551-320.jpg)

![NAVARRA/ JUNIO 98. COU /QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN 3/P 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- Una disolución acuosa es a la vez 0,1 M en ácido acético y 0,05 M en ácido
nítrico. Cuánto vale el pH de la disolución, el grado de disociación del acético y la
concentración del ion acetato.
Datos: Ka ácido acético = 1,8 · 10
-5
.
Solución:
El ácido nítrico es un ácido fuerte, por ello está totalmente disociado:
HNO3 + H2O à NO3
-
+ H3O+
Por tanto, [ H3O+
] = [ HNO3 ] = 0,05 M
En cambio, el ácido acético es débil y está parcialmente disociado según el equilibrio:
CH3-COOH + H2O ⇔ CH3-COO
-
+ H3O+
Co 0,1 0,05
Cr 0,1· α
Ceq 0,1(1-α) 0,1· α 0,05 + 0,1· α
La constante de disociación de dicho ácido (Ka) será igual a:
Ka = ( [ CH3-COO
-
]eq· [ H3O+
]eq ) / ( [ CH3-COOH ]eq)
Ka = [ 0,1· α ( 0,05 + 0,1· α) ] / [ 0,1(1-α) ] = 1,8· 10-5
Realizando las operaciones y despejando α ( grado de disociación ), se obtiene que:
α = 3,6·10-3
Una vez obtenido α podemos calcular la concentración del ión acetato y el pH de la
disolución:
[ CH3-COO
-
] = 0,1· α = 3,6·10-4
M
Si [ H3O+
] = 0,05 + 0,1· α ≈ 0,05 M
pH = - log [ H3O+
] = 1,3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-553-320.jpg)
![NAVARRA / JUNIO 98. COU / QUÍMICA / CINETICA Y EQUILIBRIO / OPCIÓN 4 /
C-A
www.profes.net es un servicio gratuito de Ediciones SM
A.- Para una reacción cualquiera de la forma: aA + bB ⇔ productos, distingue
claramente entre velocidad de reacción, ley de velocidad de reacción y constante de
velocidad de reacción.
Solución:
- La velocidad de reacción es la variación de la concentración de las sustancias que
intervienen con respecto al tiempo. Se puede definir una única velocidad de reacción que no
dependa del componente dividiendo por los respectivos coeficientes estequiométricos.
En el caso propuesto será: v = (- d[A]) / (a · dt) = (-d[B]) / (b · dt)
- La ley de velocidad es la ecuación, obtenida experimentalmente, que expresa la velocidad de
reacción en función de una constante y de las concentraciones de las sustancias que
intervienen en la reacción elevadas a determinados exponentes.
En el caso propuesto será: v = K [A]α
[B]β
- Constante de velocidad de una reacción es la constante , K, que figura en la ley de velocidad.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-554-320.jpg)

![NAVARRA / JUNIO 98. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN 4 /
P-4
www.profes.net es un servicio gratuito de Ediciones SM
4.- El producto de solubilidad Ks del sulfuro de plata vale a 25 ºC 1,08 · 10-49
. Calcula: a)
la solubilidad de dicho sulfuro en agua pura, y b) en una disolución 3·10-3
M de H2S.
Compara y comenta ambos resultados.
Solución:
El equilibrio de solubilidad del sulfuro de plata es el siguiente:
Ag2S (s) ⇔ 2 Ag+
(aq) + S
-2
(aq)
a) En agua pura, [Ag+
] = 2s y [ S
-2
] = s
La constate de solubilidad será:
Ks = [Ag+
]2
· [ S-2
] = (2s)2
(s) = 4s3
La solubilidad de la sal en agua pura será:
Lmol
K
s s
/10··3
4
10··08,1
4
173
49
3 −
−
===
b) Para conocer la solubilidad del Ag2S en la disolución de H2S, hemos de saber la [ S
-2
] (ión
común) aportados por el H2S, que es un ácido débil.
Por tanto necesitamos considerar, aunque no se aporte este dato en el enunciado, que:
Ka (H2S) = 1· 10-21
El equilibrio de disociación del ácido será:
H2S + 2 H2O ⇔ S
-2
+ 2 H3O+
C0 3·10
-3
Cr 3·10
-3
x
Ceq 3·10
-3
(1-x) x 2x
Sustituyendo en la expresión de Ka, se obtiene:
Ka = ([ S-2
]· [H3O+
]) / [H2S] = 1· 10
-21](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-556-320.jpg)
![NAVARRA / JUNIO 98. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN 4 /
P-4
www.profes.net es un servicio gratuito de Ediciones SM
[x · (2x)2
] / [3·10-3
· (1-x)] ≈ [ 4x3
] / [ 3·10-3
] = 1· 10
-21
de donde, x = [ S-2
] = 9,1· 10
-9
M
Si Ks = [Ag+
]2
· [ S
-2
], entonces:
[ ] [ ] M
S
K
Ag s 21
9
49
2
10··4,3
10··1,9
10··08,1 −
−
−
−
+
===
Si [Ag+
] = 2s, despejando:
S =[Ag+
] / 2 = 1,7· 10
-21
M
Se observa como la solubilidad de la sal ha disminuido considerablemente debido a la
presencia del ión común S2-
(efecto del ión común).](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-557-320.jpg)
![NAVARRA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
4-. El dióxido de azufre se mezcla con el oxígeno en una proporción 2:1, alcanzándose en
presencia de un catalizador el equilibrio:
2 SO2 (g) + O2 (g) 2 SO3 (g) Calcule:
a) El valor de la constante de equilibrio Kp si en el mismo ha reaccionado el
40 % de SO2 a la presión de 5 atm.
b) Si la temperatura se mantiene constante, indique a qué presión el porcentaje de
SO2 que ha reaccionado es el 50%.
Solución:
a) Se escribe el equilibrio, señalando los moles iniciales como”ni”, y en el equilibrio,
refiriéndose al tanto por uno de disociación dado, 0,4.
2 SO2 (g) + O2 (g) 2 SO3 (g)
moles iniciales ni ni --
moles equil. 2 · ni· (1 – 0,4) ni (1 – 0,4) 2 · ni· 0,4
Los moles totales de las tres especies en el equilibrio serán:
Moles totales = 2 · ni· (1 – 0,4) + ni (1 – 0,4) + 2 · ni· 0,4 = 2,6 · ni
Las expresiones de presiones parciales son:
Pi = Ptotal · xi
Siendo xi la fracción molar de cada especie, luego sustituyendo los moles y el valor de
Ptotal = 5 atm dado, se llega a:
P SO2 =5· (2· ni· 0,4) / 2,6 · ni = 0,38 atm.
P O2 = 5 · (ni· 0,6) / 2,6 · ni = 1,15 atm.
P SO3 = 5 · (0,8· ni) / 2,6 · ni = 1,53 atm.
La expresión de la Kp para el equilibrio dado es:
Kp = (P SO3 )2
/ [(P SO2)2
· PO2]
Kp = 1,532
/ (0,382
· 1,15) = 14,09](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-558-320.jpg)
![NAVARRA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN A / CUESTIÓN Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
b) Se escribe el mismo equilibrio, variando solamente los moles en el momento de alcanzarse
éste, pues ahora el grado de disociación es 0,5.
2 SO2 (g) + O2 (g) 2 SO3 (g)
moles iniciales ni ni --
moles equil. 2 · ni· (1 – 0,5) ni (1 – 0,5) 2 · ni· 0,5
Los moles totales de las tres especies en el equilibrio serán:
Moles totales = 2 · ni· (1 – 0,5) + ni (1 – 0,5) + 2 · ni· 0,5 = 2,5 · ni
Las expresiones de presiones parciales son:
Pi = Ptotal · xi
Siendo xi la fracción molar de cada especie, luego sustituyendo los moles y en función de
Ptotal ,que aún se desconoce, se llega a:
P SO2 = P total · (2· ni· 0,5) / 2,5 · ni = P total / 2,5 atm.
P O2 = P total · (ni· 0,5) / 2,5 · ni=0,2· P total atm.
P SO3 = P total · ni)/2,5· ni = 0,4 · P total atm.
La expresión de la Kp para el equilibrio dado es:
Kp = (P SO3 )2
/ [(P SO2)2
· PO2]
Y dado que la temperatura no varía, se toma el valor de Kp del apartado anterior:
14,09 = (0,4 · P total)2
/ [(P total / 2,5)2
· 0,2· P total]
De donde:
P total = 0,35 atm.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-559-320.jpg)


![PAIS VASCO / JUNIO 00. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE A / PROBLEMA 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Se dispone de un litro de disolución de HCl de pH = 2.
a) ¿Qué volumen de agua hay que añadir para que la disolución resulte de pH = 3?
b) Resuelve el mismo problema si en lugar de HCl se trata de Äcido acético.
Datos: Ka (ácido acético) = 1,8·10-5
Solución:
a) El HCl es un ácido fuerte, totalmente disociado.
Recordando que pH = -log [H3O+
], si el pH es 2, es que la concentración de protones es:
[H3O+
] = 10-2
M
Si se quiere conseguir un pH = 3, la nueva concentración de protones ha de ser 10-3
M, es
decir, reducirse 10 veces, para ello al litro inicial de HCl, se le adicionarán 9 litros de agua.
b) El ácido acético es débil, luego está disociado parcialmente según el equilibrio:
CH3COOH + H2O D CH3COO-
+ H3O+
[ ]inic. Ci -- --
[ ]equil. Ci – x x x
Donde Ci es la concentración inicial del ácido, y x es la cantidad de ácido disociado, que
coincide con la concentración de protones presente, que es 10-2
M.
La expresión de la constante de equilibrio es:
Ka = [CH3COO-
] · [H3O+
] / [CH3COOH]
Ka = 1,8·10-5
= x2
/ (Ci – x) = (10-2
)2
/ (Ci – 10-2
)
De donde Ci = 5,56 M
Si se quiere un pH = 3, la [H3O+
] = x = 10-3
M, y del mismo modo, sustituimos en la
expresión de la constante:
Ka = 1,8·10-5
= x2
/ (Ci – x) = (10-3
)2
/ (Ci – 10-3
)
Deduciendo Ci = 0,056 M
Por tanto, se ve que la concentración se ha reducido 100 veces, para lo cual se ha debido de
añadir agua al litro inicial de ácido hasta alcanzar 100 L.
Luego la cantidad de agua adicionada es de 99 litros.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-562-320.jpg)
![PAIS VASCO / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN A / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
A2- Diariamente, una planta industrial vierte a un río 40.000 litros de aguas residuales
de pH = 1,3
a) ¿Cuál es la concentración de iones H+
(H3O+
) de las aguas residuales?
b) ¿Cuántos moles de iones H+
(H3O+
) se vierten cada día al río?
Se pretende neutralizar dichas aguas antes de que lleguen al río.
c) ¿Cuántos moles de hidróxido de sodio se precisan? ¿Y de hidróxido de calcio?
d) Si se utiliza NaOH sólido, cuyo precio es 1 euro/Kg, calcula el coste diario de la
neutralización
Datos: Masas atómicas: H=1 O=16 Na=23
Solución:
a) Como pH = -log [H3O+
], y se conoce el pH, se determina:
[H3O+
] = 10-1,3
= 0,050 moles / L
b) Si en un día se vierten 40000 L, y cada litro contiene 0,050 moles de ácido, la cantidad
total de ácido vertida por día será:
n H3O+
= 0,050 · 40000 = 2000 moles
c) En la neutralización se cumple:
nº equiv. ácido = nº equiv. base
(N·V)a = (N·V)b
La base con la que se va a neutralizar es NaOH:
Nº equiv. Ácido = 0,050 · 40000 = 2000 ( suponiendo que el ácido es monoprótico)
Nº equiv. Base = 2000
La relación entre equivalentes y moles es la siguiente:
Nº Equiv = Nº moles · valencia
En este caso:
2000 equiv. = nº moles · 1
nº moles NaOH = 2000 moles](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-563-320.jpg)

![PAÍS VASCO / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
OPCIÓN B / PROBLEMA Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Se dispone de dos frascos, sin etiquetar, con disoluciones 0,1 M de ácido sulfúrico y
0,1 M de ácido acético. Se mide su acidez, resultando que el frasco A tiene pH = 2,9 Y el
frasco B pH = 0,7
a) Explica qué frasco corresponde a cada uno de los ácidos.
b) Calcula la constante de acidez (Ka ) del ácido acético.
Solución:
a) El ácido sulfúrico es fuerte, luego su concentración inicial será la misma que la de protones
final, ya que su disociación es completa.
Sin embargo, el ácido acético es débil, y aunque su concentración inicial sea la misma que la
del sulfúrico, sólo una parte de ésta se disocia, existiendo en el equilibrio menos protones.
Por ello, al haber más protones en el primer caso, el valor de pH será menor, es decir, más
ácido.
pH = 0,7, corresponde al ácido sulfúrico.
pH = 2,9, corresponde al ácido acético.
b) Si el pH es 2,9 la concentración de protones en el equilibrio será:
[H3O+
] = 10-2,9
= 1,26 · 10-3
M
Luego el equilibrio de disociación del ácido quedaría:
HAc + H2O H3O+
+ Ac-
[ ]inicial 0,1 -- --
[ ]equilibrio 0,1 - x x x
x = 1,26 · 10-3
M
La expresión de Ka es:
Ka = ([H3O+
]· [Ac-
]) / [HAc]
Y sustituyendo:
Ka = (1,26 · 10-3
)2
/ (1 - 1,26· 10-3
)
Ka = 1,6 · 10-5](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-565-320.jpg)


![PAIS VASCO /JUNIO 98, LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
/ OPCIÓN A / Nº 1
www.profes.net es un servicio gratuito de Ediciones SM
1.-En un recipiente cerrado de 100 litros se introducen 2 moles de hidrógeno y cuatro moles de
yodo, y se calientan hasta 400°C. Sabiendo que a dicha temperatura, para el equilibrio:
H2(g) + I2(g) D 2HI(g) ; Kc = 55
a) Determine el número de moles de cada especie que habrá en el recipiente .
b) Si la presión exterior es de 1 atmósfera, y se abre el recipiente, ¿entrará aire o saldrán
gases?. Explíquelo.
Solución:
a) Podemos plantear la siguiente tabla de equilibrio, siendo x los moles reaccionantes:
Equilibrio: H2(g) + I2(g) D 2HI
n0 2 4 0
n r x x
neq 2-x 4-x 2x
[Concen.]eq (2-x)/100 (4-x)/100 2x/100
De este modo podemos calcular la concentración en el equilibrio sustituyendo en la fórmula de la
constante de equilibrio
De ahí se deduce: x = 1,88 moles
De este modo la composición del equilibrio será:
n H2 = 0,12 mol ; n I2 = 2,12 mol ; n HI = 3,76 mol
b) Es necesario calcular la presión en el interior del recipiente suponiendo que la mezcla tiene un
comportamiento ideal, utilizando el número total de moles.
n = 0,12 + 2,12 + 3,76 = 6 moles
PV = nRT P⋅100 = 6 · 0,082 ⋅ (273+400)
P = 3,3 atm
P interior P exterior
)
100
4()
100
2(
)100/2(
55;
]][[
][ 2
22
2
xx
x
IH
HI
Kc
−?−
==](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-568-320.jpg)


![PAÍS VASCO / JUNIO 98. COU / QUÍMICA / CINETICA Y EQUILIBRIO / MÓDULO
B / P-2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Calcule la concentración molar de una disolución de ácido nítrico que tenga el mismo pH
que otra de ácido acético 0,50 M.
Datos :Ka (ac. acético) = 1,8 · 10-5
; masas atómicas: H = 1; C = 12; O = 16;
N = 14 uma.
Solución:
En primer lugar tenemos que averiguar el pH de la disolución de ácido acético (ácido débil), cuya
disociación viene expresada por el siguiente equilibrio:
CH3 – COOH + H2O ⇔ CH3 – COO -
+ H3O+
C0 0,5
Ceq 0,5·x
Ceq 0,5· (1-x) 0,5·x 0,5·x
Puesto que Ka es muy pequeño xà 0 y, por tanto: 0,5· (1-x) ≈ 0,5
0,25·x2
= 9 · 10-6
; despejando x = 6·10-2
mol/l
[H3O+
] = 3·10-3
M
Puesto que ácido nítrico es un ácido fuerte está totalmente disociado según la expresión:
HNO3 + H2O à NO3
-
+ H3O+
Si el pH del ácido nítrico ha de ser el mismo que el del ácido acético, se cumplirá:
[H3O+
] = [HNO3] = 3·10-3
M
5
2
10.8,1
5,0
)5,0( −
==
x
ka](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-571-320.jpg)
![PAÍS VASCO / JUNIO 99. LOGSE / QUÍMICA / CINETICA Y EQUILIBRIO /
BLOQUE A / Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2 - En un recipiente de 10 litros se introduce 1 mol de nitrógeno y 2 moles de hidrógeno
y se calientan hasta 618 K. Una vez alcanzado el equilibrio N2(g) + 3H2(g) ⇔ 2NH3(g) se
obtiene una mezcla que ejerce una presión total de 9,48 atm.
a) determina la composición de la mezcla en equilibrio
b) calcula el valor de Kc y Kp
R = 0,082 atm.l/K.mol
Solución:
a) Se calcula la composición de la mezcla en equilibrio.
N2 + 3H2 D 2NH3
no 1 2 -
nr x 3x -
neq 1-x 2-3x 2x
ntotal = 1-x + 2 -3x + 2x = 3-2x
Se aplica la ley de los gases ideales para obtener los moles totales
P · V = n · R · T
9,48 · 10 = (3-2x) · 0,082 · 618
x = 0,56
ntotal = 1,87
neq N2 = 0,435
neq H2 = 0,306
neq NH3 = 1,12
b) Sustituimos los valores de los moles en equilibrio en la fòrmula de la Kc
Kc = [NH3]2
/ [N2] · [H2]3
Kc = [0,112]2
/ [0,0435] · [0,0306]3
Kc = 10047,4
Sustituimos el valor de la Kc en la fórmula de la Kp junto con los demás datos dados
Kp = Kc (R·T) ∆n
∆n = 2 - 4 = -2
Kp = 10047,4 · (0,082 · 618)2
Kp = 2,58 · 107](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-572-320.jpg)
![PAIS VASCO / JUNIO 99. COU / QUIMICA / CINÉTICA y EQUILIBRIO /
MODULO B / Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- A 20 ml de una disolución acuosa de 0.1 M de NaCl se le añade 0,01 cm3
de nitrato de
plata 0,1 M. Sabiendo que el producto de solubilidad del cloruro de plata es 1·10-10
, se
desearía saber si precipitará cloruro de plata, y si lo hace, en qué cantidad lo hará.
Solución:
Tanto el cloruro sódico como el nitrato de plata son dos sales que se disocian totalmente, de modo
que:
NaCl → Na+
+ Cl-
Moles de (Cl-
) = 0,1 · 0,02 = 2 · 10-3
moles
Ag NO3 → Ag+
+ NO3
-
Moles de (Ag+
) = 0,1 · 10-5
= 1 · 10-6
moles
El volumen total de la disolución es: V = 0,02 + 1 · 10-5
= 0,02001 L
Se formará precipitado de cloruro de plata si el producto iónico Q es mayor que el valor de la
constante de solubilidad Kps.
Q = (Cl-
) · (Ag+
) = ( 2 · 10-3
/ 0,02001 ) · ( 1 · 10-6
/ 0,02001 ) = 0,1.
Como Kps = 1 · 10-10
; Q Kps, podemos afirmar que se formará precipitado.
Para saber la cantidad de precipitado que se forma, nos fijamos en el reactivo limitante,
[Cl-
] = 0,099 mol/L [Ag+
] = 5 · 10-5
mol/L
Reacción de precipitación: Cl-
+ Ag+
→ AgCl
Tenemos cloruro en exceso, el reactivo limitante es la plata, se formarán tantos moles de precipitado
como moles de plata tenemos:
Moles de Ag+
= moles de ↓AgCl = (5 · 10-5
) · 0,02001 = 1 · 10-6
moles
Gramos de precipitado = moles · Pm = (1 · 10-6
) · 143,4 = 1,43 · 10 –4
g = 0,143 mg.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-573-320.jpg)

![PAÍS VASCO / JULIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQ UILIBRIO /
OPCIÓN A / PROBLEMA Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN A
A-2. Sabiendo que la constante de ionización (Ka) del ácido acético vale 1,8 · 10-5
.
Calcula :
a) El grado de disociación de una disolución 0,01 M de ácido acético.
b) Su pH
Solución:
a) Se escribe el equilibrio de disociación del ácido acético, monoprótico (HAc), sustituyendo
el valor de concentración inicial dada, y llamando a al porcentaje disociado:
HAc + H2O Ac-
+ H3O+
[ ]inicial 0,01 -- --
[ ]equilibrio 0,01 · (1 - a) 0,01 · a 0,01 · a
Se escribe la expresión de la constante de acidez, y se sustituyen los datos del equilibrio:
Ka = [Ac-
] · [H3O+
] / [HAc]
Ka = (0,01 · a)2
/ 0,01 · (1 - a) = 1,8 · 10-5
De donde se despeja y se tiene:
a = 0,041 = 4,1 %
b) La expresión del pH es:
pH = - log [H3O+
] = - log (0,01 · 0,041) = 3,37
Como era de esperar el pH es menor que 7, lo que indica que se está ante un ácido.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-575-320.jpg)

![PAIS VASCO / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
OPCIÓN A / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Disponemos de una disolución de ácido acético 5,5 · 10-2
M. Calcula:
a) El grado de disociación del ácido acético.
b) El pH de la disolución.
c) La molaridad que debería tener una disolución de ácido clorhídrico, para que su pH
fuera igual al de la disolución de ácido acético.
d) El volumen de dicsolución 0,1 M de hidróxido de sodio que se necesitará para
neutralizar 200 ml de la disolución de ácido clorhídrico.
Dato: Ka (ácido acético) = 1,86 · 10-5
Solución:
a) Se escribe el equilibrio de disociación del ácido acético, al que se denomina HAc, llamando
a al grado de disociación en tanto por uno:
HAc + H2O H3O+
+ Ac-
[ ]inicial 5,5 · 10-2
-- --
[ ]equil. 5,5 · 10-2
·(1 - a) 5,5 · 10-2
· a 5,5 · 10-2
· a
Se sustituyen las concentraciones en el equilibrio en la expresión de la constante de
disociación del ácido, Ka:
Ka = ([H3O+
]·[ Ac-
]) / [HAc]
Ka = (5,5 · 10-2
· a)2
/ 5,5 · 10-2
· (1 - a)
De donde se tiene:
a = 0,0184 = 1,84 %
b) El pH se determina con la concentración de protones presente en el equilibrio:
[H3O+
] = 1,01 · 10-3
M
pH = - log [H3O+
] = 2,99 = 3
Como era de esperar, es una disolución ácida, con un pH menor que 7.
c) El clorhídrico es un ácido fuerte, totalmente disociado en sus iones, luego la concentración
de ácido inicial, será la misma que la de sus iones tras la disociación; de modo que:
pH = 3](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-577-320.jpg)
![PAIS VASCO / SEPTIEMBRE 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
OPCIÓN A / PROBLEMA 2
www.profes.net es un servicio gratuito de Ediciones SM
De donde:
[H3O+
] = 10-3
M
Y por tanto:
[HCl] inicial = 10-3
M
d) La reacción de neutralización que tendrá lugar será la siguiente:
HCl + NaOH τ NaCl + H2O
En el momento en que se alcanza el punto de equivalencia, se cumple:
(N · V) ácido = (N · V) base
Luego como se conocen:
Va = 200 ml
Na = Ma = 10-3
Nb = Mb = 0,1
Se determina la incógnita, que es el volumen de base:
Vb = 2 ml](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-578-320.jpg)
![PAÍS VASCO SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / OPCIÓN B / PROBLEMA Nº 1
www.profes.net es un servicio gratuito de Ediciones SM
OPCIÓN B
Problema 1
1.- En un recipiente de 10 litros se introducen 0,53 moles de nitrógeno y 0,49 moles de
hidrógeno. Se calienta la mezcla a 527 °C, estableciéndose el equilibrio:
N2 (g) + 3 H2 (g) 2 NH3 (g)
en el que se observa que se han formado 0,06 moles de amoniaco .
a) Determina el valor de la constante de equilibrio, Kc.
b) Calcula la presión total que ejerce la mezcla gaseosa en equilibrio.
Datos: R = 0,082 atm · l/K· mol
Solución:
Se escribe el equilibrio pedido, especificando moles iniciales y en el equilibrio:
N2 + 3 H2 2 NH3
Moles iniciales 0,53 0,49 --
Moles equilibrio 0,53 - x 0,49 - 3· x 2· x = 0,06
Luego se tiene que los moles que reaccionan son:
x = 0,06 / 2 = 0,03 moles
a) La expresión de la constante es:
Kc = ([NH3]2
) / ([N2]· [H2]3
)
Sustituyendo y operando, se tiene:
Kc = 11,25
b) Se tiene una mezcla de gases, luego se cumple:
Ptotal· V total = n totales · R· T
n totales en el equilibrio = 0,96 moles
P total = (0,96 · 0,082· 800) / 10
P total = 6,3 atm](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-579-320.jpg)
![PAÍS VASCO / SEPTIEMBRE 99. LOGSE / QUÍMICA / CINETICA Y EQUILIBRIO /
BLOQUE A / Nº1
www.profes.net es un servicio gratuito de Ediciones SM
1. – El fluoruro de hidrógeno es un ácido que en disolución 0,1 M se disocia en un 10%.
Calcula:
a) el valor de la Ka
b) el pH de una disolución 0,1 M de HF
Solución:
a) La reacción propuesta es:
HF + H2O(l) D F
-
+ H3O
+
0,1 cte -- --
0,1α -- --- Disociado
-- 0,1α 0,1α Formado
0,1 (1-α) 0,1α 0,1α Equilibrio
Sabiendo que:
α (grado de disociación) = % / 100
α = moles disociado / moles iniciales = x / c = 0,1
Aplicando la ley de acción de masas obtengo que:
Ka = ( [ F
-
]·[ H3O
+
] ) / [ HF ] = 0,1α · 0,1α / 0,1·(1-α) = 0,1α2
/ 1-α
como α = 0,10
Ka = [ 0,1· (0,10)2
] / (1-0,10) = 0,001 = 10-3
b) pH = -log [H3O
+
] = -log (0,1· 0,1) = -log 10-2
= 2
pH = 2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-580-320.jpg)
![PRINCIPADO DE ASTURIAS / JUNIO 00. COU / QUIMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 4
www.profes.net es un servicio gratuito de Ediciones SM
4.- 1) El pH de una disolución acuosa saturada de Mg(OH)2 es 10,5, ¿cuál será su
constante del producto de solubilidad?.
2) Explique el efecto del ión común sobre la solubilidad. Aplíquelo a una disolución
acuosa de Mg(OH)2.
Datos: (25ºC) Kw = 1,00·10-14
Solución:
1) Equilibrio de solubilidad del Mg(OH)2
Mg(OH)2 D Mg2+
+ 2 OH-
s s 2 s
Si pH = 10,5, a partir del producto iónico del agua se deduce la concentración de iones
oxhidrilo:
14 = pH + pOH
pOH = 14 – 10,5 = 3,5
[OH-
] = 10-pOH
= 10-3,5
= 3,16·10-4
M
Aplicamos la constante de solubilidad al equilibrio del dihidróxido de magnesio
Ks = [Mg2+
]·[OH-
]2
= s · (2s)2
= 4 s3
[OH-
] = 2 s = 3,16·10-4
M, de donde despejando s, se obtiene:
s = 1,58·10-4
M
Sustituyendo el valor de s en la expresión de Ks:
Ks = 4 · (1,58·10-4
)3
= 1,57·10-11
2) Si a la disolución de Mg(OH)2, le añadimos una sal soluble que contenga un ión común,
por ejemplo MgCl2:
Mg(OH)2 D Mg2+
+ 2 OH-
MgCl2 → Mg2+
+ 2 Cl-
La concentraciónde iones Mg2+
aumenta en el medio, provocando que el equilibrio de
solubilidad del dihidróxido de magnesio se desplace hacia la izquierda, disminuyendo de esta
forma la solubilidad.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-581-320.jpg)
![PRINCIPADO DE ASTURIAS / JUNIO 00. COU / QUIMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- La descomposición del N2O5 en presencia de CCl4 da lugar a NO2 y O2.
Experimentalmente se ha comprobado que la cinética es de primer orden respecto al
reactivo y la constante de velocidad, a 45ºC, vale 6,08·10-4
.
1) Si el tiempo se mide en segundos, ¿qué unidades tiene la constante de velocidad de la
reacción anterior?. ¿Qué entiende por velocidad de reacción?. Determine su valor para
esta reacción a 45ºC si la concentración inicial de N2O5 es 0,100 M. Sin realizar cálculos,
podría decir qué le ocurre a la velocidad si la concentración de N2O5 se duplica.
2) ¿Cómo afecta un aumento de temperatura a la posición de equilibrio y a la velocidad
de reacción?.
Datos (45ºC): ∆H0
f (kJ) (N2O5) = 11; NO2 = 33
Solución:
1) Expresión de la ley de velocidad, sabiendo que la cinética es de primer orden con respecto
al reactivo será:
vr = k [N2O5]
Las unidades de la velocidad de reacción son: mol·L-1
·s-1
Las unidades de la concentración son: mol·L-1
Entonces, unidades k = unidades de vr / unidades de concentración
Unidades de k = (mol·L-1
·s-1
) / (mol·L-1
) = s-1
Velocidad de reacción: Es la variación de la concentración de un reactivo ( o producto) en un
periodo de tiempo determinado, y se expresa como derivada de la concentración respecto del
tiempo:
vr = - d [N2O5] / d t (el signo negativo se debe a que con t va despareciendo el reactivo)
Cuando la concentración de N2O5 se duplica, la velocidad también se duplicará:
vr = k [N2O5]
vr’ = k ·[N2O5]’
[N2O5]’ = 2·[N2O5]
Entonces vr’ = k · 2 [N2O5]
vr’ = 2 · vr](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-582-320.jpg)

![PRINCIPADO DE ASTURIAS / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 3
www.profes.net es un servicio gratuito de Ediciones SM
BLOQUE 3
a) El agua de lluvia más ácida que se ha medido tenía un pH de 2,4.
1) ¿Cuántas veces era mayor su [H+
] que su [OH-
]? (0,5 puntos)
2) Explique por qué se forma este tipo de lluvia. (0,75 puntos)
b) Se precisa una disolución acuosa de pH = 8. Para prepararla, se decide diluir con
agua una disolución de ácido clorhídrico hasta obtener [HCl] = 10-8
M. ¿Se trata de un
procedimiento correcto? Razonar la respuesta. (1,25 puntos)
Solución:
a) 1) las expresiones de pH y pOH son las siguientes:
pH = - log [H3O+
]
pOH = -log[OH-
]
Y además se relacionan entre sí, gracias al producto iónico del agua (Kw):
Kw =[H+
]· [OH-
]= 10-14
Por lo tanto, para el caso propuesto, se tiene:
pH = 2,4
Luego:
[H3O+
]= 10-2,4
M
Y por lo tanto:
[OH-
]= Kw / [H3O+
]
[OH-
]= 10-14
/ 10-2,4
= 10-11,6
M
Por lo que la concentración de protones es notablemente mayor que la de grupos hidroxilo:
[H3O+
] / [OH-
]= 10-2,4
/ 10-11,6
= 109,2
[H3O+
] = 109,2
· [OH-
] = 1,58 · 109
[OH-
]](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-584-320.jpg)
![PRINCIPADO DE ASTURIAS / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 3
www.profes.net es un servicio gratuito de Ediciones SM
2) Los óxidos de azufre (SO2 y SO3), son sustancias altamente tóxicas, que se encuentran en
la atmósfera, procedentes de erupciones volcánicas, y sobre todo, de industrias y fábricas.
Ambos pueden reaccionar con el agua de lluvia, formando los ácidos respectivos: H2SO3 y
H2SO4, que además de poner en peligro la vida animal y vegetal, ocasionan numerosos
deterioros en estatuas, construcciones,..
Algunas de las reacciones que tiene lugar, son:
SO2 + 1/2O2 t SO3
SO2 + H2O t H2SO3
SO3 + H2O t H2SO4
También los óxidos de nitrógeno que contaminan la atmósfera pueden dar lugar, en contacto
con el vapor de agua, a nubes de gotas de ácido nítrico.
b) a) El HCl es un ácido fuerte, totalmente disociado en sus iones, luego la concentración de
ácido coincidirá con la de los iones H3O+
y Cl-
liberados:
HCl + H2O t H3O+
+ Cl-
[HCl]inicial = [H3O+
]final = [Cl-
]final
Al tratarse de una disolución ácida el pH siempre será inferior a 7 y por mucho agua neutra
que se añada (pH = 7) no se conseguirá aumentar el pH hasta 8.
Luego el procedimiento no es correcto. Para lograr lo indicado sería necesario partir de una
disolución de una sustancia básica.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-585-320.jpg)


![PRINCIPADO DE ASTURIAS / JUNIO 99. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 6
www.profes.net es un servicio gratuito de Ediciones SM
Bloque 6
Al calentar CO2 se descompone en CO y O2. En un contenedor con un volúmen de 61,8
dm3
, a 480ºC y 760 Torr (mm de Hg), por cada 1,00 mol de CO2 se obtienen 5,66 · 10-11
mol de O2.
a)Calcule Kc para la descomposición de un mol de CO2 a 480ºC (1 punto).
b)¿En qué consiste el efecto invernadero?. Si le hablan de la posibilidad de evitar el
efecto invernadero mediante la reacción anterior, ¿qué opinión daría usted?. (1,5
puntos).
Solución:
a) La reacción reversible de descomposición es:
CO2 (g) D CO (g) + 1/2 O2 (g)
n0 1
nr x
neq 1-x x ½ x
De la reacción se observa que de CO se obtiene doble número de moles que de O2. Por otra
parte, este valor es tan pequeño que, en el equilibrio, la cantidad de CO2 es prácticamente la
inicial.
Kc = x· (½·x)1/2
/ (1-x)
Según los datos: x = 5,66 · 10-11
Kc = [(2·5,66·10-11
/61,8) · (5,66·10-11
/61,8)1/2
] / (1/61,8)
Kc = 1,08·10-16
Este valor tan pequeño indica que el equilibrio está muy desplazado hacia la izquierda. Esto
es congruente con el dato del enunciado referente a la baja cantidad de O2 obtenida.
b) El efecto invernadero es el sobrecalentamiento atmosférico producido por la alta
concentración en la atmósfera terrestre de gases como el CO2, que dejan entrar la radiación
solar, pero no dejan salir el calor de la Tierra.
El efecto invernadero no se puede evitar mediante la reacción de descomposición del CO2 en
CO y O2, porque la constante de equilibrio es tan pequeña que nos indica que apenas
desaparecería una cantidad apreciable de CO2.
Además, en este proceso se obtiene CO, que es un gas extremadamente tóxico.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-588-320.jpg)
![PRINCIPADO DE ASTURIAS / JUNIO 99. COU / QUIMICA / CINETICA Y
EQUILIBRIO / BLOQUE 1 / CUESTIÓN 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- ¿Cuál será el pH de 100 cm3
de una disolución acuosa 0,010 M de NaOH? (0,75
puntos).
Solución:
Como el hidróxido sódico es una base fuerte, en disolución acuosa se disocia completamente
dando:
Na(OH) → Na+
+ OH-
La concentración de iones OH-
es por lo tanto la misma concentración de la base, es decir
0,010 M
Como el producto iónico del agua Kw = [H3O+
][OH-
]
10-14
= [H3O+
][OH-
]
[H3O+
] = 10-14
/ 0,010 = 1,0·10-12
M
y por lo tanto el pH de la disolución: pH = -log [H3O+
]
entonces el pH = -log (1,0·10-2
) = 12](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-589-320.jpg)
![PRINCIPADO DE ASTURIAS / JUNIO 99. COU / QUIMICA / CINETICA Y
EQUILIBRIO / BLOQUE 1 / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- ¿Precipitará Mg(OH)2 a 25ºC si se mezclan 25cm3
de una disolución acuosa 0,010M
en NaOH con 75 cm3
de otra disolución 0,10 M de MgCl2? (1,75 puntos)
Datos (25ºC): Solubilidad del Mg(OH)2 en H2O = 1,5·10-4
mol/L. Kw = 1,0·10-14
.
Supónganse volúmenes aditivos.
Solución:
A partir de la solubilidad molar, calculamos el producto de solubilidad.
Equilibrio de solubilidad : Mg(OH)2 (s) D Mg2+
(aq) + 2 OH-
(aq)
S 2S
Ks = [Mg2+
]·[OH-
]2
, Ks = S·(2S)2
= 4·S3
Ks = 4· (1,5·10-4
)3
= 1,35·10-11
Una vez conocido este valor, lo comparamos con el valor del producto iónico (Q)
Si Q Ks se formará precipitado
Si Q Ks no se formará precipitado
Si Q = Ks se encuentra en equilibrio.
El volumen total de la disolución será V = 0,025 + 0,075 = 0,1 L, por lo tanto las
concentraciones iónicas, teniendo en cuenta que tenemos una base fuerte NaOH y una sal
MgCl2 que se disocian completamente, serán:
NaOH → Na+
+ OH-
[OH-
] = 0,010 M · (0,025 L / 0,1 L) = 2,5·10-3
mol/L
MgCl2→ Mg2+
+ 2Cl-
[Mg2+
] = 0,10 M · ( 0,075 L / 0,1 L ) = 7,5·10-2
mol/L
Entonces : Q = [Mg2+
]·[OH-
]2
Q = (7,5·10-2
)·(2,5·10-3
)2
= 4,7·10-7
Como Q Ks si se formará precipitado.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-590-320.jpg)
![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 00. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 1
www.profes.net es un servicio gratuito de Ediciones SM
BLOQUE 1
La reacción A + B C es exotérmica, y su ecuación de velocidad es v = k · [A]2
[B].
Centrándose en ella, indique:
1) ¿Cuál es el orden de reacciónglobal? ¿Qué unidades tiene la velocidad de reacción?
(0,5 puntos)
2) ¿Qué le ocurre a la velocidad de reacción si se duplica la concentración de ambos
reactivos? ¿Y si aumenta la temperatura a la que ocurre la reacción? (1 punto)
3) Si la reacción transcurre en presencia de un catalizador positivo, ¿qué le ocurrirá a
la velocidad de reacción?. Dibuje y etiquete adecuadamente el diagrama energético
que lo represente. (1 punto)
Solución:
1) El orden global de una reacción es la suma de los órdenes parciales, que son los exponentes
a que están elevadas las concentraciones de los reactivos, (en general a y b).
v = k · [A]a
[B]b
En este caso: orden global = a + b = 2 + 1 = 3
La velocidad de reacción se define como la variación de la concentración de reactivos o
productos (en moles por litro) en la unidad de tiempo (segundo), luego sus unidades serán:
v = [reactivos o productos] / t
v = (moles / l ) / s = mol · l-1
· s-1
2) Si duplicamos las concentraciones de A y B, las nuevas concentraciones serán:
[A]´= 2[A]
[B]´= 2[B]
Y la nueva expresión de velocidad:
v´ = k · [A]´2
[B]´
v´ = k · (2[A])2
2[B] = k · 8·[A]2
[B] = 8 · v
La velocidad se ha octuplicado.
Un aumento de temperatura, incrementa la agitación de las partícula de reactivos,
favoreciendo la ruptura de sus enlaces, y por tanto, se acelera la reacción.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-591-320.jpg)
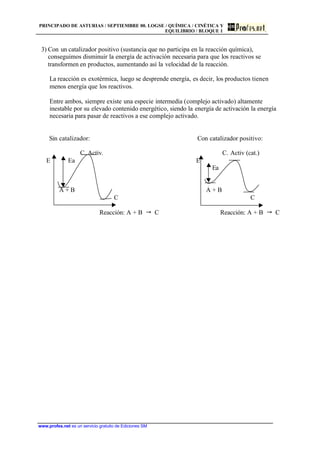
![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 00. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 2
www.profes.net es un servicio gratuito de Ediciones SM
BLOQUE 2
1) ¿A 25ºC, cuál será el pH de 50 cm3
de una disolución acuosa de hidróxido de sodio
0,0158 M ? (0,75 puntos)
2) ¿Qué volumen de una disolución acuosa de tetraoxoclorato de hidrógeno (ácido
perclórico) 0,105 M se necesitará para neutralizar la disolución anterior?.
Describa el material de laboratorio y el procedimiento adecuado para llevar a
cabo la valoración. ¿Cuál será el pH de la disoluciónfinal? Suponga los volúmenes
aditivos. (1,75 puntos)
Solución:
1) El hidróxido de sodio es una base fuerte, estará, por tanto, totalmente disociada en
disolución, siendo su concentración igual a la de cada uno de sus iones.
NaOH Na+
+ OH-
[ ]inicial 0,0158 -- --
[ ]final -- 0,0158 0,0158
Luego el pOH será:
pOH = -log [OH-
] = -log (0,0158) = 1,8
Y el pH será:
pH = 14 – pOH = 12,2
2) Vamos a neutralizar la base anterior con un ácido fuerte (HClO4 ), luego se cumple que:
nº equivalentes ácido = nº equivalentes base
(N · V) ácido = (N · V) base
Se conocen: V base = 50 cm3
M base = 0,0158 mol/L ; que coincide con la normalidad: N = 0,0158 eq/L
M ácido = 0,105 mol/L ; que coincide con la normalidad: N = 0,105 eq/L
Luego se puede determinar el volumen de ácido necesario:
Vácido = (N · V)base / N ácido = (0,0158 · 50) / 0,105 = 7,52 cm3
de ácido HClO4](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-593-320.jpg)

![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 00. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 2
www.profes.net es un servicio gratuito de Ediciones SM
Moles iniciales de : NaOH = 0,0158 · 0,05 = 7,9·10-4
moles
HClO4 = 0,105 · 7,52·10-3
= 7,9·10-4
moles
V final (en litros) = 0,05 + 7,52·10-3
= 0,0575 L
Nuevas concentraciones, tras la mezcla:
[NaOH] = 7,9·10-4
/ 0,0575 = 0,013 M
[HClO4] = 7,9·10-4
/ 0,0575 = 0,013 M
Luego la reacción de neutralización será:
NaOH + HClO4 NaClO4 + H2O
[ ]inicial 0,013 0,013 -- --
[ ]final -- -- 0,013
La sal formada estará totalmente disociada en sus iones:
NaClO4 Na+
+ ClO4
-
[ ]inicial 0,013 -- --
[ ]final -- 0,013 0,013
Ninguno de estos 2 iones procede de ácido o base débiles, por lo que no se hidrolizan, y el
pH = 7 y la disolución resultante es neutra.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-595-320.jpg)
![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 1
www.profes.net es un servicio gratuito de Ediciones SM
BLOQUE 1
La reacción A + B C es exotérmica, y su ecuación de velocidad es v = k · [A]2
[B].
Centrándose en ella, indique:
1) ¿Cuál es el orden de reacciónglobal? ¿Qué unidades tiene la velocidad de reacción?
(0,5 puntos)
2) ¿Qué le ocurre a la velocidad de reacción si se duplica la concentración de ambos
reactivos? ¿Y si aumenta la temperatura a la que ocurre la reacción? (1 punto)
3) Si la reacción transcurre en presencia de un catalizador positivo, ¿qué le ocurrirá a
la velocidad de reacción?. Dibuje y etiquete adecuadamente el diagrama energético
que lo represente. (1 punto)
Solución:
1) El orden global de una reacción es la suma de los órdenes parciales, que son los exponentes
a que están elevadas las concentraciones de los reactivos, (en general a y b).
v = k · [A]a
[B]b
En este caso: orden global = a + b = 2 + 1 = 3
La velocidad de reacción se define como la variación de la concentración de reactivos o
productos (en moles por litro) en la unidad de tiempo (segundo), luego sus unidades serán:
v = [reactivos o productos] / t
v = (moles / l ) / s = mol · l-1
· s-1
2) Si duplicamos las concentraciones de A y B, las nuevas concentraciones serán:
[A]´= 2[A]
[B]´= 2[B]
Y la nueva expresión de velocidad:
v´ = k · [A]´2
[B]´
v´ = k · (2[A])2
2[B] = k · 8·[A]2
[B] = 8 · v
La velocidad se ha octuplicado.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-596-320.jpg)
![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 2
www.profes.net es un servicio gratuito de Ediciones SM
BLOQUE 2
1) ¿A 25ºC, cuál será el pH de 50 cm3
de una disolución acuosa de hidróxido de sodio
0,0158 M ? (0,75 puntos)
2) ¿Qué volumen de una disolución acuosa de tetraoxoclorato de hidrógeno (ácido
perclórico) 0,105 M se necesitará para neutralizar la disolución anterior?.
Describa el material de laboratorio y el procedimiento adecuado para llevar a
cabo la valoración. ¿Cuál será el pH de la disoluciónfinal? Suponga los volúmenes
aditivos. (1,75 puntos)
Solución:
1) El hidróxido de sodio es una base fuerte, estará, por tanto, totalmente disociada en
disolución, siendo su concentración igual a la de cada uno de sus iones.
NaOH Na+
+ OH-
[ ]inicial 0,0158 -- --
[ ]final -- 0,0158 0,0158
Luego el pOH será:
pOH = -log [OH-
] = -log (0,0158) = 1,8
Y el pH será:
pH = 14 – pOH = 12,2
2) Vamos a neutralizar la base anterior con un ácido fuerte (HClO4 ), luego se cumple que:
nº equivalentes ácido = nº equivalentes base
(N · V) ácido = (N · V) base
Se conocen: V base = 50 cm3
M base = 0,0158 mol/L ; que coincide con la normalidad: N = 0,0158 eq/L
M ácido = 0,105 mol/L ; que coincide con la normalidad: N = 0,105 eq/L
Luego se puede determinar el volumen de ácido necesario:
Vácido = (N · V)base / N ácido = (0,0158 · 50) / 0,105 = 7,52 cm3
de ácido HClO4](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-598-320.jpg)

![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 00. COU / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 2
www.profes.net es un servicio gratuito de Ediciones SM
Moles iniciales de : NaOH = 0,0158 · 0,05 = 7,9·10-4
moles
HClO4 = 0,105 · 7,52·10-3
= 7,9·10-4
moles
V final (en litros) = 0,05 + 7,52·10-3
= 0,0575 L
Nuevas concentraciones, tras la mezcla:
[NaOH] = 7,9·10-4
/ 0,0575 = 0,013 M
[HClO4] = 7,9·10-4
/ 0,0575 = 0,013 M
Luego la reacción de neutralización será:
NaOH + HClO4 NaClO4 + H2O
[ ]inicial 0,013 0,013 -- --
[ ]final -- -- 0,013
La sal formada estará totalmente disociada en sus iones:
NaClO4 Na+
+ ClO4
-
[ ]inicial 0,013 -- --
[ ]final -- 0,013 0,013
Ninguno de estos 2 iones procede de ácido o base débiles, por lo que no se hidrolizan, y el
pH = 7 y la disolución resultante es neutra.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-600-320.jpg)



![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 98. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 2
www.profes.net es un servicio gratuito de Ediciones SM
BLOQUE 2
En un matraz de 1,0 dm3
, están en equilibrio 0,20 mol de PCl5 (g), 0,10 de PCl3 (g) y 0,40
de Cl2 (g).
a) En ese momento se añaden 0,10 mol de Cl2, ¿cuál es la nueva concentración de PCl5?.
(1,5 puntos)
b) Indique cómo afectarán al equilibrio las variaciones de: 1.- presión ; 2.- temperatura.
(1 punto)
Datos (25ºC): DHºf (kJ): PCl5= -375; PCl5= -287.
Solución:
Se escribe el equilibrio homogéneo de disociaciónexistente entre las tres especies gaseosas.
Como el volumen total: 1 dm3
= 1 L; coinciden las concentraciones (mol/L) y los moles de
cada especie en el equilibrio.Se calculan dichas concentraciones en el equilibrio, y con ellas la
Kc:
PCl5 (g) ‡ PCl3 (g) + Cl2 (g)
[ ]equil. 0,20 0,10 0,40
Kc = (0,10 · 0,40) / 0,20 = 0,2
a) Al adicionar cloro, el equilibrio responde en el sentido en que se tienda a consumir dicho
gas, es decir, hacia la izquierda, aumentando la concentración de PCl5
Ahora, las concentraciones iniciales de cada gas son las del estado de equilibrio anterior y el
exceso de cloro. En el nuevo estado de equilibrio, tendremos:
PCl5 (g) ‡ PCl3 (g) + Cl2 (g)
[ ]inic. 0,20 0,10 0,40 + 0,10
[ ]reacc. x x
[ ]equil. 0,20 + x 0,10 – x (0,40 + 0,10) - x
Llamamos x a la cantidad de cloro y de PCl3 que reaccionan, que será la cantidad de PCl5
formada.
Como la temperatura no varía, el valor de Kc es el mismo.
Kc = 0,2](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-604-320.jpg)
![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 98. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE 2
www.profes.net es un servicio gratuito de Ediciones SM
0,2 = [(0,10 – x) · (0,50 – x)] / (0,20 + x)
De donde: x = 0,012 moles/l
Por lo que la nueva concentración de PCl5 en equilibrio será:
[PCl5] eq. = 0,20 + 0,012 = 0,212 mol/L
b) Con los valores de entalpías dados, se calcula el de entalpía de la reacción:
DHºreac. = (DHºf PCl3 + DHºf Cl2 ) - ( DHºf PCl5 )= (-287 + 0) - (-375) = 80 kJ
Luego la reacción es endotérmica, transcurre con absorción de calor.
1.- Un aumento de presión, desplazará el equilibrio en el sentido en que disminuyan los
moles, para mantener P·V = cte.
En este caso, si aumenta la presión, se desplaza hacia la izquierda (disminución de volumen),
aumentando la concentración de PCl5.
Lo contrario sucederá si disminuye la presión.
2.- Un aumento de temperatura hace que el equilibrio tienda a absorber calor, desplazándose
en el sentido en que sea endotérmica la reacción.
En este caso, un aumento de temperatura, hace que la reacción se desplace hacia la derecha,
disminuyendo la concentración de PCl5.
Si se reduce la temperatura, se incrementará la concentración de PCl5.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-605-320.jpg)

![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 99.LOGSE / QUIMICA / CINETICA Y
EQUILIBRIO / BLOQUE 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- El CH3OH (g) se fabrica a partir de CO y H2. En un recipiente de 1,5 dm3
se introducen
0,15 moles de CO y 0,30 mol de H2. Al Al alcanzar el equilibrio a 500K, el recipiente
contiene 0,12 mol de CO.
1) A 500K se tiene una mezcla gaseosa 0,02M en CH3OH 0,1 M en CO y 0,1 M en H2,
¿estará en equilibrio? Si no lo está, ¿en que dirección deberá evolucionar la reacción para
alcanzarlo? (1,5 puntos)
2) ¿Cree que un aumento de temperatura tendrá consecuencias sobre el medio ambiente?
(1 punto)
Dato: (500 K) .- ∆H0
reacción = -91 kJ/mol
Solución:
Reacción de formación del metanol:
CO (g) + 2 H2 (g) • CH3OH (g)
Inicialmente (moles): 0,15 0,30 _
Reaccionan: x 2x _
Se forman: _ _ x
Equilibrio: 0,15 – x 0,30 – 2x x
Como en el equilibrio se sabe que hay 0,12 moles de CO (g):
0,15 – x = 0,12
x = 0,03
[CO] = 0,12 / 1,5 = 0,08 M
[H2] = (0,30-2·0,03) / 1,5 = 0,16 M
[CH3OH] = 0,03 / 1,5 = 0,02 M
Aplicando la ley de acción de masas: K = [CH3OH] / [CO]·[H2]2
Kc = 0,02 / [0,08 (0,16)2
] = 9,76
1) Comprobamos que la K permanezca invariable (ya que estamos a la misma temperatura, único
factor que puede hacer variar el valor de la constante de equilibrio), para lo cual hallamos el
coeficiente de concentración (Q):
Q = 0,02 / [0,1 · (0,1)2
] = 20
Como Q Keq , para alcanzar el equilibrio la reacción tendrá que desplazarse hacia la formación de
reactivos, para que así el valor de Keq disminuya.
2) Al aumentar la temperatura, siendo ∆Hf
0
= -91 KJ/mol (reacción exotérmica), el equilibrio se
desplaza a la formación de reactivos, para consumir la energía suministrada. Se formará por lo tanto
CO, monóxido de carbono, sustancia perjudicial para el medio ambiente.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-607-320.jpg)
![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 99.LOGSE / QUIMICA / CINETICA Y
EQUILIBRIO / BLOQUE 4
www.profes.net es un servicio gratuito de Ediciones SM
4.-
1) Calcule la constante de disociación de un ácido débil, HA, sabiendo que 0,1 mol de este
ácido en 250 cm3
de disolución acuosa se disocia en un 1,5 por ciento, ¿cuál será el pH de
la disolución? (1,5 puntos)
2) Indique si son ácidas básicas o neutras las disoluciones acuosas de: I.-cloruro de sodio;
II.-acetato de sodio; III.-cloruro de amonio. . Formule las ecuaciones químicas que
justifiquen su respuesta (1 punto).
Datos.- Kb (amoniaco) = 1,8·10-5
; Ka (ácido acético) = 1,8·10-5
.
Solución:
1) Para este ácido débil HA, su concentración inicial es :
[HA] = 0,01moles / 0,250 L = 0,04 mol/L
α = 1,5% = 0,015
Equilibrio de disociación: HA • H+
+ A-
Concentración inicial (mol/L) 0,04 - -
Se disocia : 0,04 · 0,015 - -
Se forma: - 0,04 · 0,015 0,04 · 0,015
Equilibrio 0,04 ( 1 – 0,015 ) 0,04 · 0,015 0,04 · 0,015
Aplicando la ecuación de la constante de equilibrio:
Ka = [H+
]·[A-
] / [HA]
Ka = ( 6·10-4
)2
/ 0,0394 = 9,13 · 10-6
pH = -log [H+
] = -log (6·10-4
) = 3,22
2) Los tres casos son de sales solubles, las cuales en disolución acuosa pueden o no sufrir hidrólisis.
I .- Cloruro de sodio: NaCl → Na+
+ Cl-
.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-608-320.jpg)

![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 99.COU / QUIMICA / CINETICA Y
EQUILIBRIO / BLOQUE 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- El CH3OH (g) se fabrica a partir de CO y H2. En un recipiente de 1,5 dm3
se
introducen 0,15 moles de CO y 0,30 mol de H2. Al Al alcanzar el equilibrio a 500K, el
recipiente contiene 0,12 mol de CO.
1) A 500K se tiene una mezcla gaseosa 0,02M en CH3OH 0,1 M en CO y 0,1 M en H2,
¿estará en equilibrio? Si no lo está, ¿en que dirección deberá evolucionar la reacción
para alcanzarlo? (1,5 puntos)
2) Si aumrntan la temperatura o la presión de la reacción, ¿lo hará la cantidad de
alcohol obtenido? (1 punto)
Dato: (500 K) .- ∆H0
reacción = -91 kJ/mol
Solución:
Reacción de formación del metanol: CO (g) + H2 (g) • CH3OH (g)
Moles 0,15 0,30
CO (g) + 2 H2 (g) • CH3OH (g)
Inicialmente (moles): 0,15 0,30 _
Reaccionan: x 2x _
Se forman: _ _ x
Equilibrio: 0,15 – x 0,30 – 2x x
Como en el equilibrio se sabe que hay 0,12 moles de CO (g):
0,15 – x = 0,12
x = 0,03
[CO] = 0,12 / 1,5 = 0,08 M
[H2] = (0,30-2·0,03) / 1,5 = 0,16 M
[CH3OH] = 0,03 / 1,5 = 0,02 M
Aplicando la ley de acción de masas: K = [CH3OH] / [CO]·[H2]2
Keq = 0,02 / [(0,16)2
· 0,08] = 9,76](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-610-320.jpg)
![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 99.COU / QUIMICA / CINETICA Y
EQUILIBRIO / BLOQUE 1
www.profes.net es un servicio gratuito de Ediciones SM
1) Calculamos el coeficiente de concentración y comprobamos si coincide o no con la K de el
equilibrio. Como sabemos, la temperatura es el único factor que puede hacer variar el valor de
la constante en el equilibrio.
Q = 0,02 / [(0,1)2
· 0,1] = 20
Como Q Keq concluimos que para alcanzar el equilibrio la reacción tendría que desplazarse
hacia la formación de reactivos (izquierda), para que así el valor de K disminuya.
2) Al aumentar la temperatura, siendo ∆Hf
0
= -91 KJ/mol (reacción exotérmica), el equilibrio
se desplaza hacia la formación de reactivos, para consumir la energía suministrada. Se
formará por lo tanto CO y H2 y no aumentará la cantidad de alcohol.
Si aumenta la presión, dado que ∆n = -2 , la reacción se desplaza hacia el miembro de la
derecha, pues es éste en el que disminuye el número de moles y, por tanto, el volumen. Como
consecuencia, aumenta la cantidad de metanol obtenido.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-611-320.jpg)
![PRINCIPADO DE ASTURIAS / SEPTIEMBRE 99.COU / QUIMICA / CINETICA Y
EQUILIBRIO / BLOQUE 4
www.profes.net es un servicio gratuito de Ediciones SM
4.-
1) Calcule la constante de disociación de un ácido débil, HA, sabiendo que 0,1 mol de
este ácido en 250 cm3
de disolución acuosa se disocia en un 1,5 por ciento, ¿cuál será el
pH de la disolución? (1,5 puntos)
2) Indique si son ácidas básicas o neutras las disoluciones acuosas de: I.-cloruro de
sodio; II.-acetato de sodio; III.-cloruro de amonio. . Formule las ecuaciones químicas
que justifiquen su respuesta (1 punto).
Datos.- Kb (amoniaco) = 1,8·10-5
; Ka (ácido acético) = 1,8·10-5
.
Solución:
1) Para este ácido débil HA, su concentración inicial es :
[HA] = 0,01moles / 0,250 L = 0,04 mol/L
α = 1,5% = 0,015
Equilibrio de disociación: HA • H+
+ A-
Concentración inicial (mol/L) 0,04 - -
Se disocia : 0,04 · 0,015 - -
Se forma: - 0,04 · 0,015 0,04 · 0,015
Equilibrio 0,04 ( 1 – 0,015 ) 0,04 · 0,015 0,04 · 0,015
Aplicando la ecuación de la constante de equilibrio:
Ka = [H+
]·[A-
] / [HA]
Ka = ( 6·10-4
)2
/ 0,0394 = 9,13 · 10-6
pH = -log [H+
] = -log (6·10-4
) = 3,22
2) Los tres casos son de sales solubles, las cuales en disolución acuosa pueden o no sufrir
hidrólisis.
I .- Cloruro de sodio: NaCl → Na+
+ Cl-
.
El NaCl es una sal que se disocia completamente, dando Na+
(ácido débil) que no sufre
hidrólisis, y Cl-
( base débil) que tampoco sufre hidrólisis. El pH de la disolución vendrá dado
por el producto iónico del agua, por lo tanto pH = 7, la disolución es neutra.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-612-320.jpg)




![REGIÓN DE MURCIA /JUNIO 2004. LOGSE / QUÍMICA /CINÉTICA Y
EQUILIBRIO / BLOQUE 2 / CUESTIÓN 8
8. En un recipiente de 5 litros se introducen 1,84 moles de nitrógeno y 1,02 moles de
oxígeno. Se calienta el recipiente hasta 2000 °C estableciéndose el equilibrio:
N2(g) + O2(g) =2 NO (g).
En estas condiciones reacciona el 3% del nitrógeno existente. Calcule:
a) El valor de Kc a dicha temperatura.
b) La presión total en el recipiente, una vez alcanzado el equilibrio. Dato: R= 0,082
atm.l/K.mol
SOLUCIÓN CUESTIÓN 8 (BLOQUE 2)
Se trata de un equilibrio homogéneo en fase gaseosa. Para calcular la constante de equilibrio
Kc, hay que calcular primero las concentraciones en el equilibrio de todas las especies que
intervienen. Teniendo en cuenta que el problema nos dice que en las condiciones en las que se
establece el equilibrio, reacciona el 3% del nitrógeno existente, es decir, el grado de
disociación es α = 0,03. Luego el número de moles que hay en el equilibrio son 1,84 – X
siendo X = 1,84 0,03 = 0,055
Cómo inicialmente había 1,84 moles de nitrógeno y 1,02 moles de oxígeno en el equilibrio
habrá de acuerdo con la estequiometría de la reacción
N2 O2 NO
Concentraciones
iniciales
1,84 moles/5 L 1,02 0
Concentraciones en
el equilibrio
(1,84 – 0,055)/5L
0,357 moles/L
(1,02-0,055)/5L
0,193 moles/L
2 (0,055)/5L
0,022 moles/L
Sustituyendo en la constante de equilibrio:
[ ]
[ ]
( )
( )( )
2 2
2 2
0,022
0,007
0,357 0,193
c
NO
K
N O
= = =
⎡ ⎤⎣ ⎦
(b) Para calcular la presión total necesitamos conocer el número total de moles en el equilibrio
y aplicar la ecuación de los gases perfectos:
nT = 1,785 + 0,965 + 0,11 = 2,86 moles.
2,86 0,082 / 2273,15
106,6 .
5
T
T
n RT moles atmL Kmol K
P a
V L
= = = tm
www.profes.net es un servicio gratuito de Ediciones SM](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-617-320.jpg)
![MURCIA / JUNIO 98.COU / QUÍMICA /CINÉTICA Y EQUILIBRIO/OPCIÓN A / Nº 4
www.profes.net es un servicio gratuito de Ediciones SM
4. Calcule cual de las siguientes sales es la más soluble en un medio 0,1 M en CrO4
2-
:
BaCrO4 (Kps = 1,2 x 10-10
M2
) ó Ag2CrO4 (Kps = 2,5 x 10-12
M3
).
Solución 4:
En ambos casos hemos de tener en cuenta el efecto de ión común y, por ello, la concentración
de iones CrO4
2-
procedentes de su disociación es despreciable frente a 0,1 M.
El equilibrio de solubilidad del BaCrO4 es:
BaCrO4 (s) ⇔ Ba2+
(aq) + CrO4
2-
(aq)
S 0,1
El producto de solubilidad es: Ks =[Ba2+
] [ CrO4
2-
] = 0,1 s
s =
ks
0,1
=
1,2 ⋅10−10
0,1
=1,2 ⋅10
−9
M
Para el Ag2CrO4 el equilibrio de solubilidad es:
Ag2CrO4 (s) ⇔ 2Ag+
(aq) + CrO4
2-
(aq)
2s 0,1
Ks =[Ag+
]2
[ CrO4
2-
] = (2s)2
·0,1 = 0,4· s2
s =
Ks
0,4
=
2,5 ⋅10−12
0,4
= 2,5 ⋅10
−6
M
Por tanto será más soluble el Ag2CrO4 .](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-618-320.jpg)
![REGIÓN DE MURCIA / JUNIO 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE 2 / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- La solubilidad del cromato de plata en medio 0,01 M de cromato sódico es 3,28 g/L.
a) Calcule el producto de solubilidad del cromato de plata.
b) ¿Qué concentración de Ba2+
es necesaria para que comience a precipitar el cromato
de bario en la disolución anterior?. Ks BaCrO4 = 1,6·10-10
M2
.
Solución:
a) El cromato de plata es una sal bastante insoluble en disolución acuosa, esa circunstancia se
puede observar en el valor de su Ks (no facilitado por el enunciado). Su solubilidad es aún
menor en una disolución salina de cromato sódico, debido al efecto del ión común.
La sal soluble está totalmente disociada:
Na2CrO4 2 Na+
+ CrO4
2-
0,01 M 0,02 M 0,01 M
La sal insoluble, con efecto ión común CrO4
2-
, está parcialmente disociada según este
equilibrio de solubilidad:
Ag2CrO4 D 2 Ag+
+ CrO4
2-
s 2 s s + 0,01
Aplicando la ley de acción de masas a este equilibrio heterogéneo deducimos la expresión del
producto de solubilidad:
Ks = [Ag+
]2
·[ CrO4
2-
]
s = 3,28 g/L
Mm Ag2CrO4 = 331,8
Conocemos el dato de la solubilidad del cromato de plata en disolución salina de cromato
sódico:
s = 3,28 / 331,8 = 9,88·10-3
mol/L
Luego:
Ks = (2s)2
· (s + 0,01) = 4s2
· (s + 0,01) = 4 · (9,88·10-3
)2
· (9,88·10-3
+ 0,01)
Ks = 7,75 · 10-6
M2
b) El cromato de bario es otra sal insoluble cuyo equilibrio de solubilidad es:
BaCrO4 D Ba2+
+ CrO4
2-
Ks = [Ba2+
] ·[ CrO4
2-
]](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-619-320.jpg)
![REGIÓN DE MURCIA / JUNIO 00. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE 2 / CUESTIÓN 3
www.profes.net es un servicio gratuito de Ediciones SM
En la disolución anterior la concentración de iones cromato es:
[ CrO4
2-
] real = 9,88·10-3
+ 0,01 = 1,98·10-2
M
Para que comience la precipitación de esta sal se ha de cumplir que:
[Ba2+
]real · [ CrO4
2-
] real Ks
De ahí se deduce la concentración necesaria de iones Ba2+
:
[Ba2+
]real Ks / [ CrO4
2-
] real
[Ba2+
]real 1,6·10-10
/ 1,98·10-2
[Ba2+
]real 8,08·10-9
mol/L](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-620-320.jpg)
![REGIÓN DE MURCIA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
/ BLOQUE SEGUNDO / CUESTIÓN 8
www.profes.net es un servicio gratuito de Ediciones SM
8.- Se añaden 7 g de amoníaco en la cantidad de agua necesaria par obtener 500 mL de
disolución. Calcule:
a) El pH de la disolución resultante (Kb (NH4OH) = 1,85·10-5
)
b) El volumen de ácido sulfúrico 0,1 N necesario para neutralizar 250 mL de la
disolución anterior.
Solución:
a) Se calcula en primer lugar, los moles de amoníaco contenidos en los 7 g con que se prepara
la disolución:
Moles amoníaco = 7 / 17 = 0,411 moles
Como se conoce el volumen final de disolución, se determina su molaridad:
M = moles soluto / V disolución (L)
M = 0,411 / 0,5 = 0,82 M
Se escribe ahora el equilibrio de disociación del hidróxido de amonio formado, que al tener el
dato de Kb será una base débil, parcialmente disociada; especificando la concentración inicial,
y las del equilibrio, llamando x a los moles / L de hidróxido disociados, y por tanto, de iones
en disolución:
NH4OH NH4
+
OH-
[ ]inicial 0,82 -- --
[ ]equilibrio 0,82 – x x x
Como:
Kb = ([NH4
+
] · [OH-
]) / [NH4OH]
Kb = x2
/ (0,82 – x) = 1,85·10-5
De donde:
x = 3,8 ·10-3
M
Como por definición:
pOH = - log [OH-
] = -log (3,8 ·10-3
)
pOH = 2,42](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-621-320.jpg)


![REGIÓN DE MURCIA / JUNIO 02. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
/ BLOQUE SEGUNDO / CUESTIÓN Nº 9
www.profes.net es un servicio gratuito de Ediciones SM
9.- a) Calcule el pH de una disolución 0.01 M de ácido acético (Ka=2,1· 10-5
).
b) ¿Cuántos ml de agua hay que añadir a 10 ml de HCl 10-3
M, para obtener el mismo
pH que en el apartado anterior? Suponga que los volúmenes; son aditivos.
Solución:
a) El ácido acético es débil, parcialmente disociado en equilibrio, luego se escribe éste,
especificando los moles por litro iniciales y los del equilibrio, llamando x a la concentración
disociada:
HAc + H2O Ac-
+ H3O+
[ ]inicial 0,01 -- --
[ ]equilibrio 0,01 - x x x
De la expresión de Ka, se deduce el valor de x, que serán la concentración de protones en
disolución, de la cual se calcula el pH:
Ka = ([H3O+
]· [Ac-
]) / [HAc]
Ka = x2
/ (0,01 - x) = 2 · 10-5
Luego:
x = 4,3 · 10-4
M
pH = - log [H3O+
] = - log 4,3 · 10-4
pH = 3,36
Como era de esperar, el pH es menor que 7, pues se trata de una disolución ácida.
b) Por el contrario, el HCl es fuerte, y se disocia totalmente, luego si su concentración inicial
es 10-3
M, esa misma será la concentración de protones al final, de donde el pH será:
[H3O+
] = 10-3
M
pH = - log [H3O+
] = 3
Como se pretende que el pH sea igual que el de la disolución de acético, se debe diluir el
clorhídrico, consiguiendo así una concentración de protones menor:
nº equivalentes diluida = nº equivalentes concentrada
(N· V) d = (N · V) c](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-624-320.jpg)


![REGIÓN DE MURCIA / JUNIO 03. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
/ BLOQUE PRIMERO / CUESTIÓN 5
www.profes.net es un servicio gratuito de Ediciones SM
BLOQUE 1
CUESTIÓN 5
Dada la reacción química aA + bB t cC + dD; presente una expresión para su
ecuación de velocidad y defina los órdenes de reacción total y parcial.
Solución:
a A + b B t c C + d D
La ecuación de velocidad incluye el producto de una constante (k) por las concentraciones de
los reactivos, elevadas a unos exponentes, llamados órdenes de reacción (uno por reactivo),
que sólo pueden hallarse de forma experimental. Sería, para el caso dado:
V = k · [A]a
· [B]b
Órdenes parciales: exponentes de los reactivos, que no tienen porqué coincidir con los
coeficientes estequiométricos: a y b.
Orden total = a + b.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-627-320.jpg)
![REGIÓN DE MURCIA / JUNIO 98. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
/ BLOQUE II / Nº 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Responda, razonadamente, si son ciertas o no las siguientes afirmaciones. En caso de
no ser ciertas escríbalas en sentido correcto.
a) Hay sales que al disolverlas en agua conducen a disoluciones de pH ácido.
b) Hay sales que al disolverlas en agua conducen a disoluciones de pH básico.
c) La mezcla equimolecular de un ácido débil y su base conjugada siempre conduce a un
pH neutro.
d) Una disolución de HCl 10-6
M muestra un pH de 6.
Solución:
a) Si, este es el caso de ha hidrólisis de una sal de ácido fuerte y base débil.
Ejemplo: La disociación de la sal será: NH4Cl D NH4
+
+ Cl-
NH4
+
+ H2O D NH3 + H3O+
(hidrólisis ácida, pH 7)
b) Si, este es el caso de ha hidrólisis de una sal de ácido débil y base fuerte.
Ejemplo: La disociación de la sal será: NaCH3COO D Na+
+ CH3COO-
CH3COO-
+ H2O D CH3COOH + OH-
(hidrólisis básica, pH 7)
c) Si es cierto, pH = 7. La suma de ambas reacciones de disociación da como resultado el
equilibrio de autoionización del agua.
CH3COOH + H2O D CH3COO-
+ H3O+
CH3COO-
+ H2O D CH3COOH + OH-
2 H2O D H3O+
+ OH-
d) Si es cierto, porque: pH= -log[H3O+
]
Como el HCl es un ácido fuerte, se considera totalmente disociado, asi que la reacción de
disociación del HCl es:
HCl + H2O Cl-
+ H3O+
[HCl] = 10-6
M
[H3O+
] = 10-6
M
pH = -log (10-6
) = 6,00](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-628-320.jpg)
![REGIÓN DE MURCIA / JUNIO 98. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
/ BLOQUE III / Nº 6
www.profes.net es un servicio gratuito de Ediciones SM
6.- ¿Cuál es el pH resultante de mezclar 25mL de anilina, C6H5NH2 , 0,01 M con 25 mL
de HNO3 0,01 M?. Kb de anilina = 4,2·10-10
M .
Solución:
La anilina con el ácido nítrico produce la siguiente reacción:
C6H5NH2 + HNO3 D C6H5NH3
+
+ NO3
-
Al ser iguales los volúmenes y las concentraciones del ácido y la base (anilina), se produce la
neutralización exacta.
V total = 25 + 25 = 50 mL
[C6H5NH3
+
] = [NO3
-
] = (0,01 · 0,025) / 0,050 = 0,005 M
El único ión que puede sufrir hidrólisis es el ión C6H5NH3
+
, por ser conjugado de base débil:
C6H5NH3
+
+ H2O D C6H5NH2 + H3O+
Conc.inicial 0,005
Conc.equil. 0,005-x x x
Kh = Ka = Kw / Kb = 10-14
/ (4,2 · 10-10
) = 2,4 · 10-5
2,4 · 10-5
= x2
/ (0,005-x)
x = [H3O+
] = 3,5 · 10-4
M
pH = -log (3,5 · 10-4
) = 3,5](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-629-320.jpg)
![REGION DE MURCIA / JUNIO 99. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE II / Nº 1
www.profes.net es un servicio gratuito de Ediciones SM
1.- Rellene en su cuadernillo de examen las casillas vacías de la siguiente tabla:
Concentración
Disolución Temperatura ºC [H+
] [OH-
] pH
A 10 10-6
B 60 8
C 60 10-3
10,02
D 10 10-5
10-9,53
Solucion:
a) Como [H+
] = 10-6
, por tanto pH = -log (10-6
) = 6
Teniendo en cuenta el producto iónico del agua a 10 ºC, que se puede calcular con los datos del
apartado d):
Kw (10 ºC) = 10-5
· 10-9,53
= 2,95·10-15
A partir de este valor de Kw se obtiene: [OH-
] = 2,95·10-15
/ 10-6
= 2,96·10-9
b) Si el pH = 8 resulta que [H+
] = 10-8
Del mismo modo que en el apartado a), para calcular [OH-
] hay que conocer el valor de Kw a 60
ºC, lo que se hace mediante los datos del apartado c).
Kw (60 ºC) = 10-3
· 10-10,02
= 9,55·10-14
A partir de este valor de Kw se obtiene: [OH-
] = 9,55·10-14
/ 10-8
= 9,55·10-6
c) Si el pH = 10,02 resulta que [H+
] = 10-10,02
= 9,55·10-11
d) Si [H+
] = 10-5
, se cumple que pH = 5
El cuadro completado es el siguiente:
Concentración
Disolución Temperatura ºC [H+
] [OH-
] pH
A 10 10-6
2,95·10-9
6
B 60 10-8
9,55·10-6
8
C 60 9,55·10-11
10-3
10,02
D 10 10-5
10-9,53
5](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-630-320.jpg)
![REGION DE MURCIA / JUNIO 99. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO /
BLOQUE II / Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- En la reacción N2 + 3H2 à 2NH3 , esta reaccionando N2 a una velocidad de 0,3 M/min :
a) ¿Cual es la velocidad a la que esta desapareciendo el H2 , y cual es la velocidad a la
que se esta formando el NH3?. ¿Podría con estos datos proponer valores adecuados
para x e y en la expresion : velocidad = [N2]x
[H2]y
o necesitaría alguna otra
información?.
b) A 500 K la constante de este equilibrio es 0,9 M-2
. En un recipiente de 2 L sabemos que
hay 1 mol de N2 , 3 moles de H2 y 1 mol de NH3 . ¿Está el sistema en equilibrio?.
Solución :
La reacción reversible de síntesis del amoniaco es:
N2 + 3H2 D 2NH3
a) Dado que 1 mol de N2 reacciona con 3 moles de H2 para producir 2 moles de NH3 , la
velocidad de desaparición del hidrógeno será:
Vd H2 = 3· 0,3 = 0,9 M/min
Para saber los exponentes x e y de la ecuación de velocidad , vr = [N2]x
[H2]y
, es necesario
determinar experimentalmente el orden de reacción.
b) Para saber si el sistema se halla en equilibrio deberemos calcular el valor del cociente de
concentraciones (Q):
Q = [NH3]2
/ [N2][H2]3
= [1/2]2
/ [1/2][3/2]3
= 0,15
Kc = 0,9
Como Q Kc, la reacción no se encuentra en equilibrio, tienen que reaccionar los reactivos para
formar más amoniaco, hasta que se igualen Kc y Q.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-631-320.jpg)




![REGIÓN DE MURCIA / JUNIO 01. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO
/ BLOQUE PRIMERO / CUESTIÓN 2
www.profes.net es un servicio gratuito de Ediciones SM
2.- Relación entre las constantes de equilibrio Kc y Kp para una reacción química.
Solución:
Sea la reacción en equilibrio:
a A + b B c C + d D
La Kc se define como el cociente entre las concentraciones de productos, elevadas a sus
coeficientes estequiométricos y las concentraciones de reactivos, elevadas también a sus
coeficientes estequiométricos; incluyendo sólo las especies gaseosas o en disolución:
Kc = ([C]c
· [D]d
) / ([A]a
· [B]b
)
A su vez, la Kp se define como el cociente entre las presiones parciales de los productos
gaseosos, elevadas a sus coeficientes estequiométricos, y las presiones parciales de reactivos
gaseosos elevadas a los suyos:
Kp = ((P C)c
· (P D)d
) / ((P A)a
· (P B)b
)
Para equilibrios entre gases, gracias a la ecuación de los gases perfectos, se pueden relacionar
Kc y Kp:
P·V = n·R·T
De donde:
P = (n / V) · R ·T = [ ] · R ·T
Luego sustituyendo en la expresión de Kp:
([C] · R · T)c
· ([D] · R · T)d
Kp =
([A] · R · T)a
· ([B] · R · T)b
Y reordenando se llega a:
([C]c
· [D]d
)
Kp = (R · T)c +d –(a +b)
([A]a
· [B]b
)
O lo que es lo mismo:
Kp = Kc · (R · T)Dn
Siendo Dn = S n (g) productos - S n (g) reactivos](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-636-320.jpg)

![REGIÓN DE MURCIA / SEPTIEMBRE 02. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE PRIMERO / CUESTIÓN Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- a) Calcule la constante de disociación del ácido nitroso (HNO2) si una disolución 0,1
M de este ácido tiene un pH de 2,2.
b) ¿El valor de esta constante es independiente de la temperatura?
Solución:
a) Se escribe el equilibrio de disociación del ácido dado, que es débil, puesto que se pide el
valor de su Ka:
HNO2 + H2O H3O+
+ NO2
-
[ ]inicial 0,1 -- --
[ ]equilibrio 0,1 - x x x
Se ha llamado x a la cantidad de ácido disociada, que coincide con la cantidad de protones
formada, cuyo valor se conoce a través del pH:
pH = 2,2
x = [H3O+
] = 10-2,2
= 6,3 · 10-3
M
Luego se sustituye en la expresión de Ka, hallándose dicha constante:
Ka = ([H3O+
]· [NO2
-
]) / [HNO2]
Ka = x2
/ (0,1 - x) = (6,3 · 10-3
)2
/ (0,1 - 6,3· 10-3
) 4,25 · 10-4
b) No es cierto que Ka sea independiente de T, todas las constantes dependen de la
temperatura: Ka = f (T). Dicha variación depende de si la reacción es exotérmica o
endotérmica](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-638-320.jpg)


![REGIÓN DE MURCIA / SEPTIEMBRE 03. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE SEGUNDO / CUESTIÓN Nº 8
www.profes.net es un servicio gratuito de Ediciones SM
BLOQUE 2
8.- Se añaden 10 g de ácido acético (peso molecular = 60) en la cantidad de agua
necesaria para obtener 500 mL de disolución. Calcule:
a) El pH de la disolución resultante (Ka = 1,5 · 10-5
M)
b) ¿Qué volumen de hidróxido sódico 0,1 N se necesitará para neutralizar 250 mL de la
disolución anterior.
Solución:
Se escribe el equilibrio de disociación del ácido débil dado, llamando x a la cantidad
disociada en el equilibrio. Se determina la concentración inicial de ácido hallando los moles
contenidos en los 10 g, y dividiéndolos entre el volumen de agua tomado:
Moles HAc = 10 / 60 = 0,16
M = 0,16 / 0,5 = 0,3
HAc + H2O ‡ Ac-
+ H3O+
[ ]inicial 0,3 -- --
[ ]equil. 0,3 - x x x
La expresión de la Kc para el caso dado es:
Kc = ([Ac-
] · [H3O+
]) / [HAc]
Kc = x2
/ (0,3 - x) = 1,5 · 10-5
De donde se tiene:
x = 3,87 · 10-3
M = [H3O+
]
Y recordando la expresión de pH:
pH = - log [H3O+
] = 2,41
Es menor que 7, como era de esperar la disolución es ácida.
b) En una valoración ácido - base, se cumple:
nº equivalentes ácido = nº equivalentes base
O lo que es lo mismo:](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-641-320.jpg)

![REGIÓN DE MURCIA / SEPTIEMBRE 03. LOGSE / QUÍMICA / CINÉTICA Y
EQUILIBRIO / BLOQUE SEGUNDO / CUESTIÓN Nº 9
www.profes.net es un servicio gratuito de Ediciones SM
BLOQUE 2
9.- Dada la reacción en equilibrio MnNm (s) ‡ n Mm+
(ac) + m Nn-
(ac)
exprese su constante de equilibrio en función de las concentraciones (Kc) y de ahí
deduzca la constante del producto de solubilidad (Kps). Desarrolle una expresión que
relacione la solubilidad del compuesto (s) con Kps.
Solución:
La expresión de la constante de equilibrio en función de las concentraciones es un cociente
entre el producto de las concentraciones de los productos, elevadas a sus coeficientes
estequiométricos, y el producto de las concentraciones de los reactivos, igualmente elevadas a
sus coeficientes estequiométricos; pero las especies (reactivos y productos) que se incluyen en
dicha constante, han de ser especies en disolución o en estado gaseoso.
Para elcaso dado:
MnNm (s) ‡ n Mm+
(ac) + m Nn-
(ac)
Sólo se podrían incluir en la expresión de Kc los dos iones en disolución, y no la sal sólida.
Sería:
Kc = [Mm+
]n
· [Nn-
]m
El producto de solubilidad, tendría la misma expresión:
Kps = [Mm+
(ac)]n
· [Nn-
(ac)]m
La solubilidad, s, en mol / L, será la concentración de los n moles de Mm+
disueltos, y de
los m moles de Nn-
disueltos:
MnNm (s) ‡ MnNm (disuelta) ‡ n Mm+
(ac) + m Nn-
(ac)
s n · s m · s
Kps = [Mm+
(ac)]n
· [Nn-
(ac)]m
Kps = (n · s)n
· (m · s) m
Kps = nn
· mm
· sn + m
Y despejando s:
s = n + m
(Kps / (nn
· mm
))](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-643-320.jpg)
![REGIÓN DE MURCIA / JUNIO 98. LOGSE / QUÍMICA / ESTEQUIOMETRÍA /
BLOQUE III /
Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- Calcule:
a) Los gramos de NaOH necesarios para obtener 250 mL de disolución de pH =10.
b) Los gramos de disolución de HCl del 36% en peso y densidad =1,2 g/mL que hay que
añadir a 250 mL de NaOH 0,2 M para obtener una disolución de pH=3.
Solución:
a) Según la definición de pH: pH= -log[H3O+
]
pOH= -log[OH-
]
pH + pOH = 14
Si el pH=10 , pOH = 4
[OH-
]= 10-4
M .
La reacción de disociación del NaOH es: NaOH → Na+
+ OH-
[NaOH] = 10-4
M
Esto significa que hay 10-4
moles de NaOH por cada litro de disolución, es decir, se necesitan:
(10-4
/ 4) moles de NaOH en 250 mL de disolución.
Mm NaOH = 40 g/mol.
m = (10-4
/ 4) · 40 = 10-3
g = 1 mg de NaOH
b) Hallamos los moles de NaOH que hay en los 250 mL de disolución 0,2 M:
n NaOH = 0,2 · 0,250 = 0,05 moles
Llamaremos x a la masa de HCl del 36% y d = 1,2 mg/L, que hay que añadir a la disolución
anterior para alcanzar pH = 3.
V = m / d = x / 1,2
n HCl = (m / Mm) · % = (x / 36,5) · 0,36 moles
Al mezclar ambas disoluciones, el volumen final será: Vt = 250 + (x / 1,2) mL
Los moles de HCl, y por tanto de H3O+
, que quedan tras haber sido neutralizados los 0,05
moles de iones hidronio por la disolucion de sosa, son:
n H3O+
= ((x / 36,5) · 0,36) – 0,05) moles sin neutralizar
Como pH = 3, se cumple que: [H3O+
] = 10-3
mol/L
De la siguiente ecuación deducimos el valor de x:
1000 mL / 10-3
= [250 + (x / 1,2)] / [(x / 36,5) · 0,36) – 0,05]
x = 5,0 g de disolucion HCl del 36%](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-644-320.jpg)
![REGION DE MURCIA / SEPTIEMBRE 99.LOGSE / QUIMICA / CINETICA Y
EQUILIBRIO / BLOQUE III / Nº 7
www.profes.net es un servicio gratuito de Ediciones SM
7.- 100 mL de una disolución de ácido acético se mezclan con 50 mL de agua.
a) Si el pH resultante es 3 ¿cuál es la concentración inicial de la disolución de ácido?
b) Calcule el grado de disociación, en tanto por ciento, del ácido acético y su
concentración sin disociar en el equilibrio.
Solución:
a) Tenemos 100 mL de CH3-COOH, y se mezclan con 50 mL de agua, de modo que el
volumen final es V = 150 mL = 0,150 L. Si el pH resultante es pH = 3, significa que la
concentración de protones es [H3O+
] = 10-3
M.
Por lo tanto, sabiendo que el ácido acético es un ácido débil cuya constante es Ka = 1,45 · 10-5
,
planteamos el equilibrio, para poder calcular la concentración inicial de ácido.
CH3-COOH + H2O D CH3-COO-
+ H3O+
Concentración inicial: C0 _ _
Se disocia x _ _
Equilibrio C0 – x x x
Aplicando la constante de disociación del ácido:
Ka = [CH3-COO-
] · [H3O+
] / [CH3-COOH] ; 1,45 · 10-5
= x · x / (C0 – x)
1,45 · 10-5
= x2
/ (C0 – x).
Como sabemos que el pH = 3, la concentración en el equilibrio de los iones H3O+
y
CH3-COO-
, puesto que estas son iguales, será 10-3
M, es decir x = 10-3
M.
1,45 · 10-5
= (10-3
)2
/ (C0 – 10-3
)
1,45 · 10-5
· (C0 – 10-3
) = 10-6
C0 = (10-6
/ 1,45 · 10-5
) + 1,45 · 10-8
C0 = 0,0699 M, esta es la concentración del ácido una vez añadidos los 50 mL de agua.
Cálculo de el número de moles:
nº moles de CH3-COOH = M · V = 0,0699 · 0,15 = 0,0105 moles
Por lo tanto la concentración inicial del ácido antes de añadir agua sería:
[CH3-COOH] = 0,0105 / 0,1 = 0,105 M.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-645-320.jpg)
![REGION DE MURCIA / SEPTIEMBRE 99.LOGSE / QUIMICA / CINETICA Y
EQUILIBRIO / BLOQUE III / Nº 7
www.profes.net es un servicio gratuito de Ediciones SM
b) Considerando ahora el ácido acético sólo, sin mezclar con los 50mL de agua tenemos:
CH3-COOH + H2O D CH3-COO-
+ H3O+
Concentración inicial: 0,105 M _ _
Se disocia: 0,105 α _ _
Equilibrio: 0,105·(1 - α) 0,105α 0,105α
Aplicando la constante de disociación:
Ka = [CH3-COO-
] · [H3O+
] / [CH3-COOH]
1,45 · 10-5
= 0,105α · 0,105α / 0,105 (1- α)
1,45 · 10-5
= (0,105α)2
/ 0,105(1- α)
1,52 · 10-6
–1,56 · 10-6
α = 0,011025 α2
1,1025 · 10-2
α2
+ 1,52 · 10-6
α - 1,52 · 10-6
= 0
Resolviendo esta ecuación de segundo grado se obtienen los valores siguientes:
α = 1,16 · 10-2
α = - 1,18 · 10-2
(no tiene sentido químico, el grado de disociación no puede ser negativo).
Por lo tanto: α = 1,16 · 10-2
= 1,16 %, un grado de disociación muy pequeño, ya que es un
ácido débil.
La concentración sin disociar del ácido es: [CH3-COOH] = 0,105 · (1 - α)
[CH3-COOH] = 0,105 ( 1 – 1,16·10-2
) = 0,103 M sin disociar en el equilibrio.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-646-320.jpg)
![MURCIA / SEPTIEMBRE 99. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / BLOQUE
2/ Nº 3
www.profes.net es un servicio gratuito de Ediciones SM
3.- El producto de solubilidad del hidróxido de magnesio es 3 ·10–11
. Calcule:
a) La solubilidad en agua de dicha sal.
b) La solubilidad de la sal si el pH cambia a pH= 7.
Solución:
a) El equilibrio de solubilidad del hidróxido de magnesio es:
Mg(OH)2 D Mg2+
+ 2 OH-
s s 2s
Llamando s a la solubilidad del compuesto, según la estequiometría se cumple que:
Ks = [ Mg 2+
] · [ OH -
]2
= s · (2s)2
= 4s3
= 3·10–11
s = 1,95·10-4
mol / L
b) Si pH = 7
Deducimos: pH + pOH = 14 ; pOH = 7
[OH-
] = 10–7
3·10–11
= s´ · (10–7
)2
s´= 3·103
mol / L
Es decir, a pH = 7 disminuye la concentración de iones oxhidrilo y el equilibrio se desplaza hacia
la derecha, aumentando la solubilidad del compuesto.](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-647-320.jpg)

![MURCIA / SEPTIEMBRE 99. COU / QUÍMICA / CINÉTICA Y EQUILIBRIO / BLOQUE
3 / Nº 5
www.profes.net es un servicio gratuito de Ediciones SM
5.- El valor de Kp a 25º para el equilibrio 2CO (g) D C (s) + CO2 (g) es 2,046.
a) ¿Cuál es el valor de Kc?
b) ¿Cuáles serán las concentraciones en el equilibrio si se mezclan 3 moles de CO y 2 moles
de CO2 en un recipiente de un litro?
Solución:
a) Sabemos que la relación entre Kc y Kp es la siguiente:
Kp = Kc · ( R · T) ∆n
Como ∆n = 1 - 2
Sustituyendo se obtiene que: Kc = 2,046 · (0,082 · 298)-1
Kc = 0,0837 (mol / L)-1
b) Se trata de un equilibrio heterogéneo en el que V = 1 litro:
2 CO (g) D C (s) + CO2 (g)
[ ] o 3 2
[ ] r x 0,5x 0,5x
[ ]eq 3-x 0,5x 2 + 0,5x
Kc = [CO2] / [CO]2
Sustituyendo: 0,0837 = (2 + 0,5x) / (3-x)2
x = 0,07
Composición del equilibrio:
3- 0,07 = 2,93 moles de CO
0,07 / 2 = 0,035 moles de C](https://image.slidesharecdn.com/cineticayequilibrio-160119155810/85/Cinetica-y-equilibrio-649-320.jpg)
