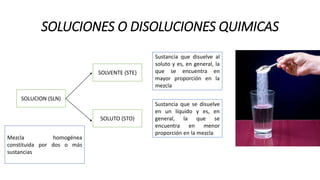
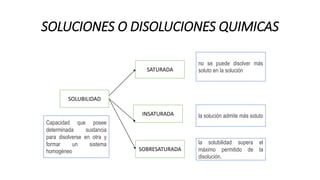
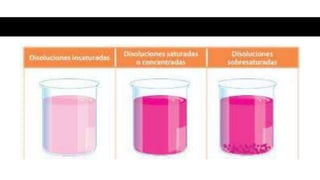
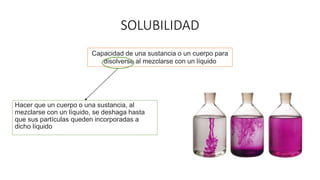
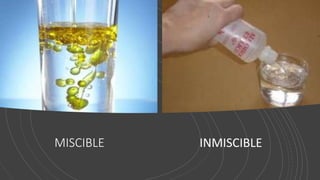
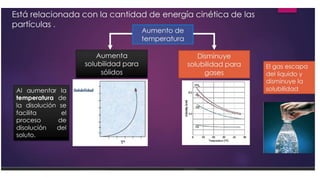
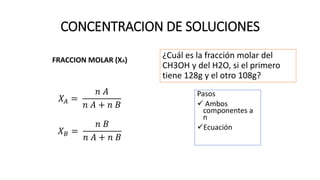
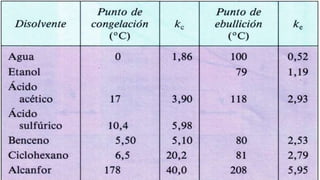
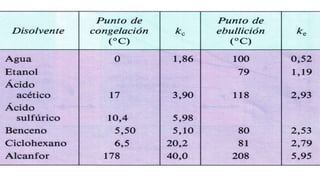
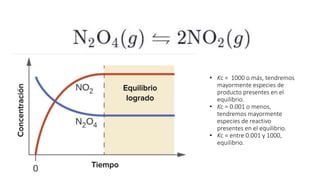
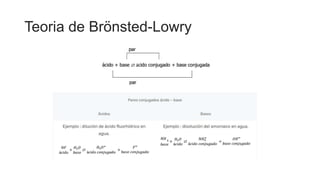
Este documento proporciona información sobre soluciones químicas y concentraciones de soluciones. Define términos clave como solvente, soluto, solubilidad y diferentes tipos de concentraciones como molalidad, fracción molar, molaridad y porcentajes. También explica propiedades coligativas como abatimiento de la presión de vapor, elevación del punto de ebullición, depresión del punto de congelación y presión osmótica. Finalmente, presenta información sobre la cinética de reacciones químicas y diferentes teorías de