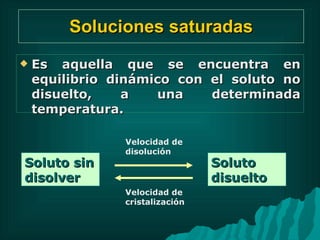
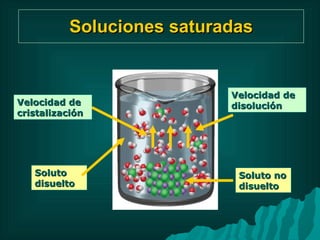
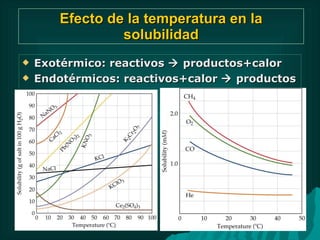
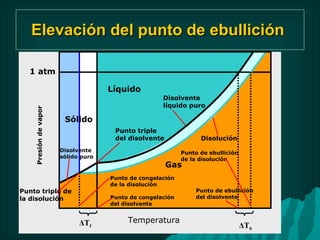
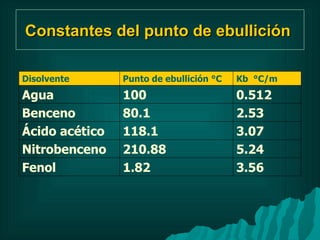
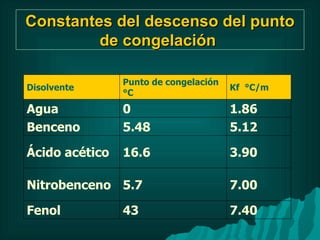
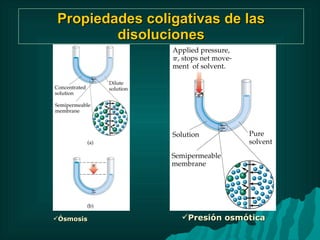
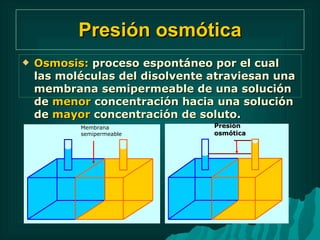
Este documento presenta información sobre soluciones y sus propiedades. Explica diferentes formas de expresar la concentración de soluciones, así como conceptos como solubilidad, saturación e insolubilidad. También describe propiedades coligativas como abatimiento de punto de ebullición y congelación, y presión osmótica. Finalmente, incluye ejemplos de cálculos relacionados a estas propiedades.