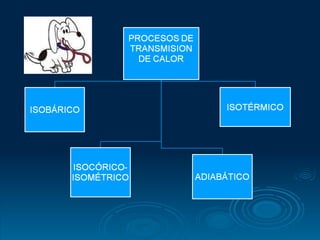
El documento trata sobre conceptos básicos de termodinámica como temperatura, calor, transferencia de calor, y diferentes procesos termodinámicos como procesos isobáricos, isotérmicos y adiabáticos. Incluye ejemplos y problemas resueltos sobre estos temas.