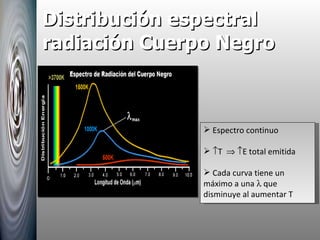
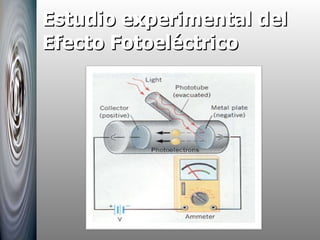
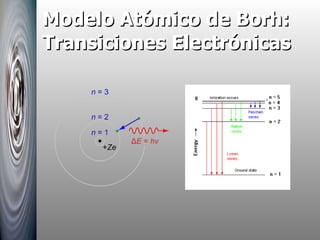
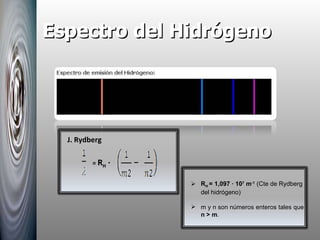
El documento resume las principales contribuciones al desarrollo de la física cuántica, incluyendo la hipótesis de Planck sobre la cuantización de la energía, la interpretación del efecto fotoeléctrico por Einstein, el modelo atómico de Bohr y su explicación de los espectros atómicos, y la hipótesis de De Broglie sobre la dualidad onda-corpúsculo.