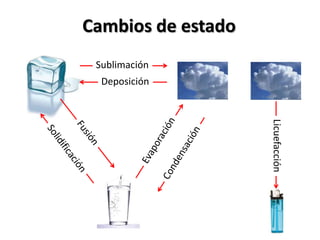
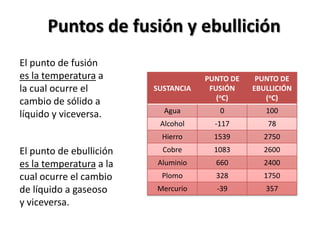
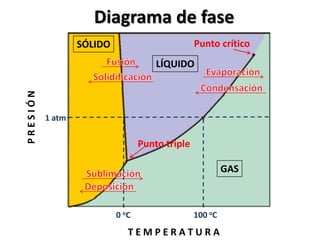
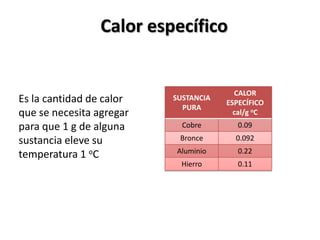
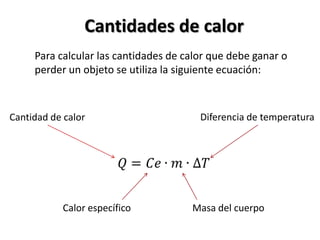
El documento describe los conceptos de puntos de fusión y ebullición, así como cómo se pueden ver afectados por impurezas y la presión. También explica las unidades de calor como calorías y cómo calcular la cantidad de calor involucrada en los cambios de temperatura usando la fórmula de calor específico.