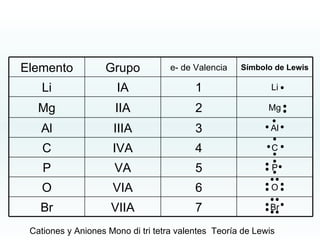
El documento describe los diferentes tipos de enlaces químicos. 1) El enlace iónico se produce por la transferencia de electrones entre átomos, formando cationes y aniones unidos por fuerzas electrostáticas. 2) El enlace covalente ocurre cuando átomos comparten parejas de electrones, pudiendo ser simple, doble o triple. 3) Las fuerzas intermoleculares incluyen las fuerzas de van der Waals, dipolo-dipolo y puentes de hidrógeno.