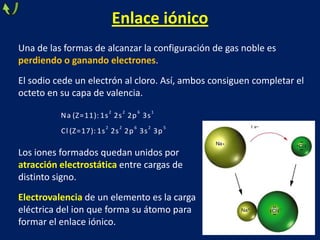
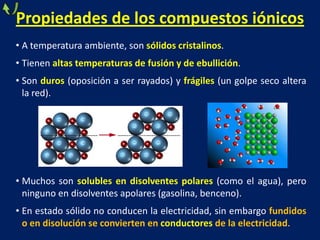
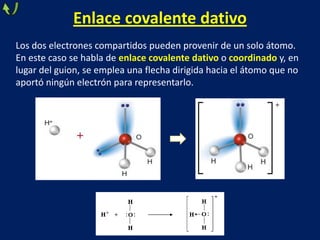
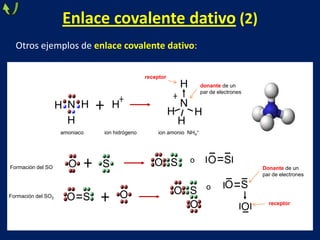
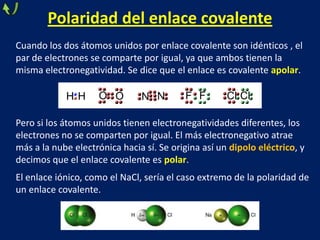
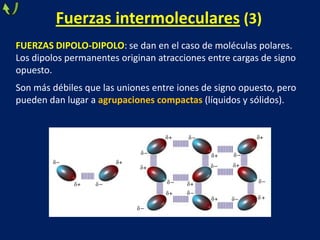
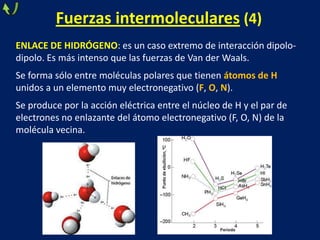
Este documento trata sobre los diferentes tipos de enlaces químicos, incluyendo enlace iónico, covalente y metálico. Explica las características de cada tipo de enlace, como la formación de iones, el compartir de electrones y la liberación de electrones de valencia. También describe las propiedades de los compuestos formados por cada tipo de enlace, como su estado físico, solubilidad, conductividad eléctrica y más.