El documento trata sobre el enlace covalente. Explica las estructuras de Lewis, la regla del octeto y formas resonantes. También cubre la geometría molecular según la teoría VSEPR y la polaridad de moléculas. Por último, introduce los orbitales atómicos hibridados y los enlaces sigma y pi.






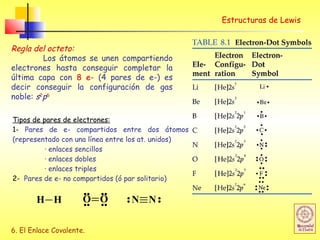








![6. El Enlace Covalente.
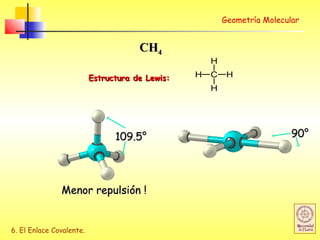
Geometría Molecular
Forma molecular está determinada por:
» Distancia de enlace ⇒ Distancia en línea recta, entre los
núcleos de los dos átomos enlazados.
» Angulo de enlace ⇒ Angulo formado entre dos enlaces
que contienen un átomo en común.
FormaForma MolecularMolecular
Modelo de Repulsión de los Pares de Electrones de la Capa de Valencia
La geometría molecular puede predecirse fácilmente basándonos en la
repulsión entre pares electrónicos. En el modelo de RPECV, [Valence Shell Electron
Pair Repulsion Theory (VSEPR)] los pares de e- alrededor de un átomo se repelen
entre sí, por ello, los orbitales que contienen estos pares de e-, se orientan de
forma que queden lo más alejados que puedan unos de otros.](https://image.slidesharecdn.com/enlaces-130527194030-phpapp01/85/Enlaces-16-320.jpg)