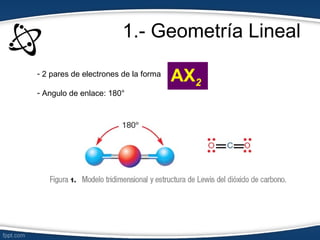
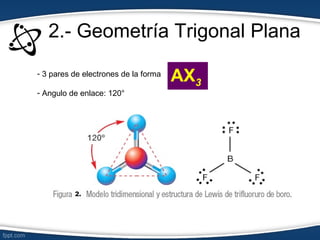
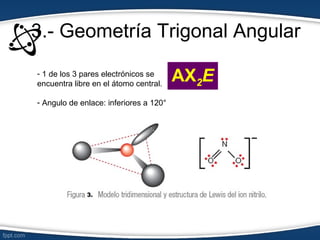
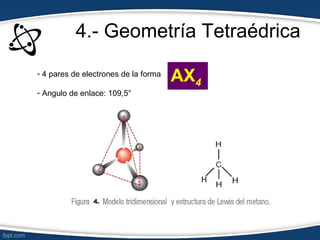
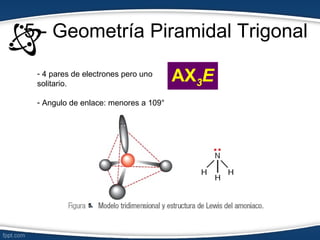
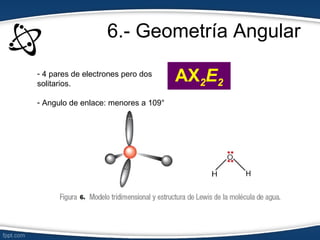
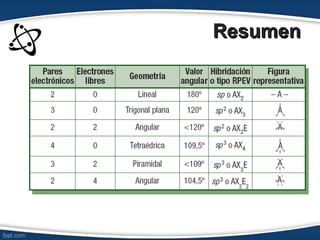
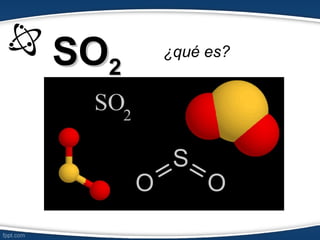
El documento describe el modelo de repulsión de pares de electrones de valencia (RPEV) para predecir la geometría molecular. Explica que los electrones de valencia tienden a ubicarse en posiciones que minimizan la repulsión, y presenta seis geometrías básicas (lineal, trigonal plana, trigonal angular, tetraédrica, piramidal trigonal, angular) definidas por el número de átomos unidos y pares de electrones libres alrededor del átomo central.