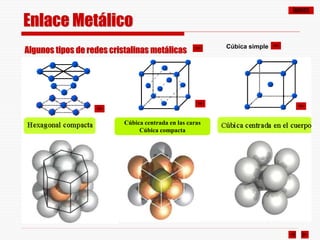
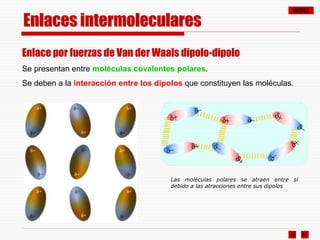
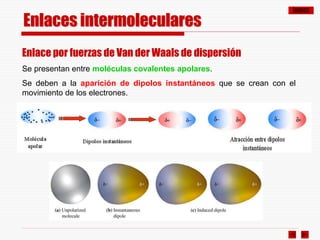
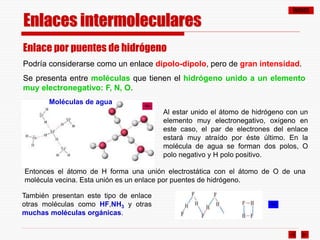
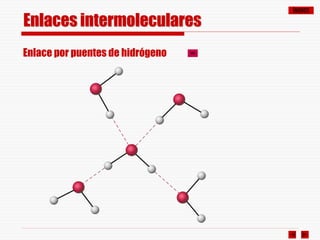
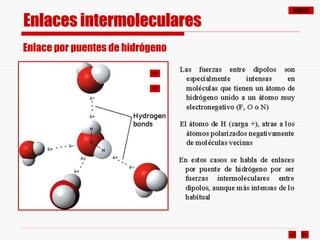
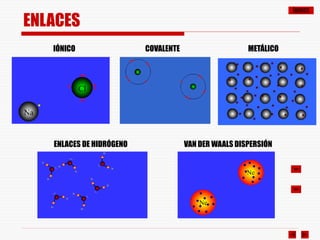
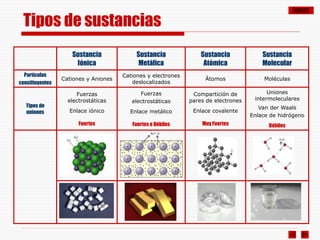
El documento resume los diferentes tipos de enlaces químicos, incluyendo enlace iónico, covalente, metálico y enlaces intermoleculares. Explica que el enlace iónico involucra la transferencia de electrones entre átomos, el enlace covalente implica la compartición de electrones, y el enlace metálico se forma entre átomos metálicos que dejan electrones libres. También describe los enlaces intermoleculares débiles como las fuerzas de Van der Waals y los puentes de hidrógeno.



![ÍNDICE
NaCl
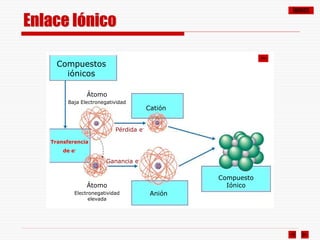
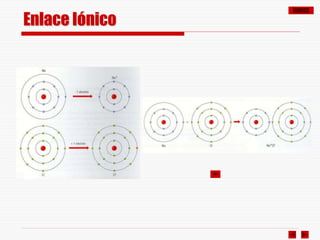
Enlace Iónico
El enlace iónico se establece por cesión de electrones (uno o más) de un
átomo metálico (baja EN, tendencia a ceder electrones) a un átomo no
metálico (EN elevada, tendencia a captar electrones).
El átomo metálico se convierte así en un catión y el no metálico en un anión.
Estos iones quedan unidos por fuerzas de atracción electrostática.
En la mayoría de los casos, el número de electrones ganados o perdidos
es tal que cada uno de los iones resultantes adquiere la configuración
electrónica de gas noble, es decir completa su octeto.
•
•
••
•
•
•
• ]2-
••
••
•
• •
•
[
[ ]2+](https://image.slidesharecdn.com/clase-220517035737-039e77bd/85/Enlaces-quimicos-5-320.jpg)