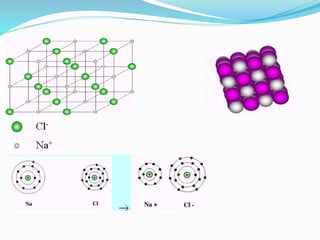
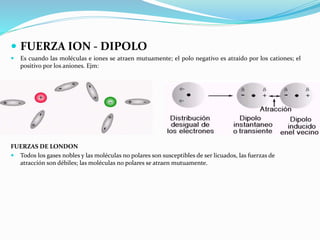
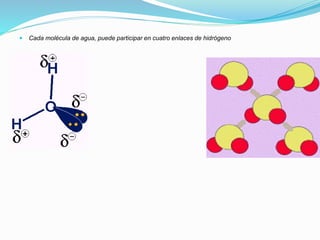
Este documento describe los cinco tipos principales de enlaces químicos: iónico, covalente, metálico, polaridad de enlaces y enlace de hidrógeno. Explica las características clave de cada tipo de enlace, incluyendo cómo se forman, las fuerzas involucradas y las propiedades resultantes de los compuestos. También cubre conceptos como electrovalencia, covalencia, fuerzas intermoleculares y la importancia de la electronegatividad en la polaridad de los enlaces.