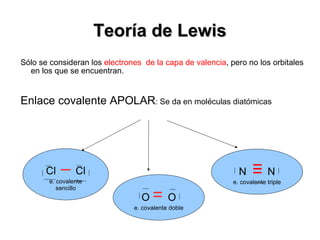
El documento resume los diferentes tipos de enlaces químicos, incluyendo enlaces iónicos, covalentes, metálicos e intermoleculares. Explica que los enlaces mantienen unidos los átomos y moléculas mediante el intercambio o compartición de electrones. Describe las características y propiedades de cada tipo de enlace.