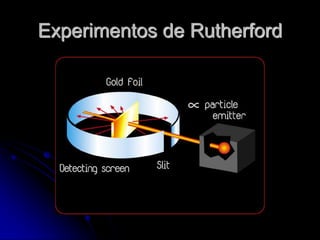
Este documento resume la evolución histórica de la teoría atómica desde Demócrito hasta el modelo atómico moderno. Comienza con la teoría atomista de Demócrito en el siglo IV a.C., luego pasa a la teoría atómica de Dalton en el siglo XIX que introdujo una base científica. Más adelante, experimentos de Thomson, Rutherford y otros llevaron al descubrimiento del electrón y al modelo nuclear del átomo. Finalmente, el trabajo de Bohr explicó la estructura electrónica del á