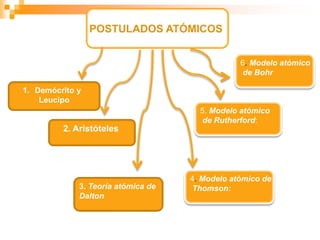
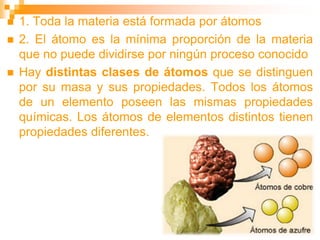
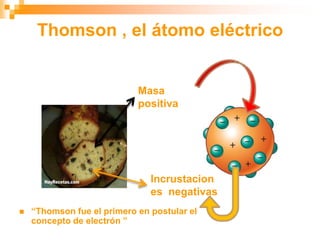
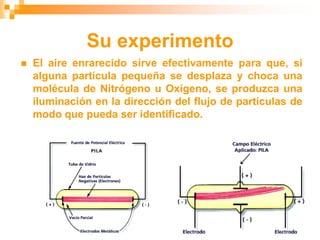
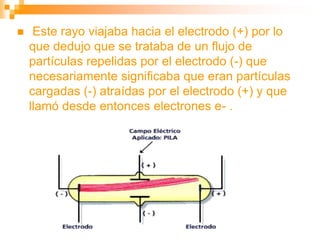
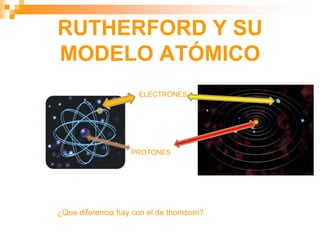
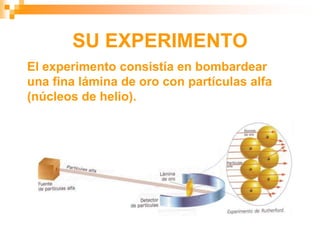
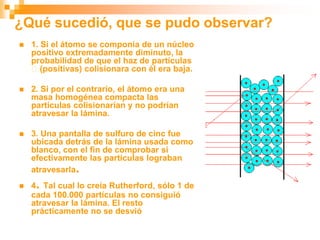
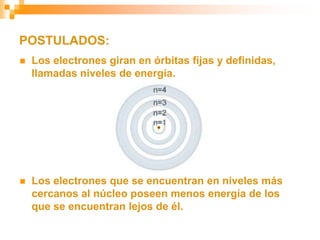
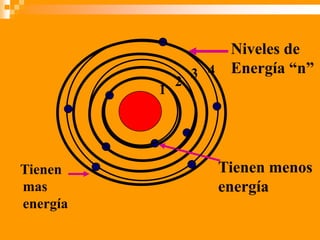
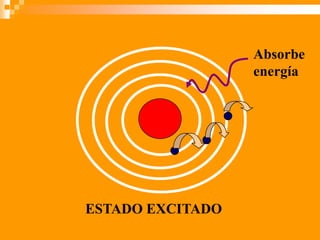
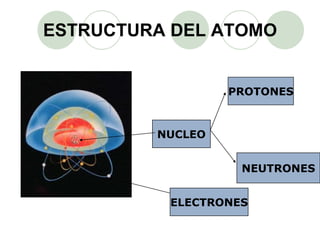
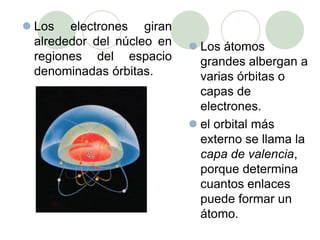
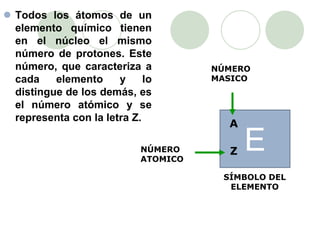
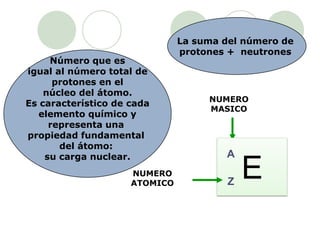
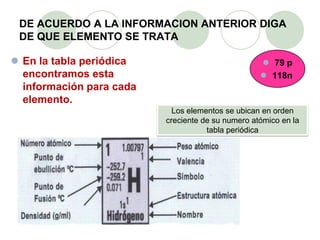
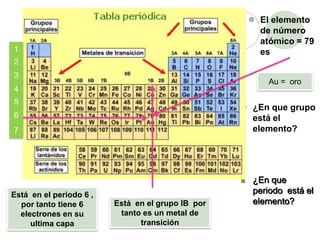
Este documento presenta información sobre los modelos atómicos a través de la historia, incluyendo los modelos de Thomson, Rutherford y Bohr. Explica que Thomson propuso que el átomo consiste en una esfera positiva con electrones incrustados, mientras que Rutherford determinó que el átomo tiene un núcleo pequeño y denso rodeado por electrones a distancia. Finalmente, Bohr sugirió que los electrones orbitan en niveles de energía fijos alrededor del núcleo.