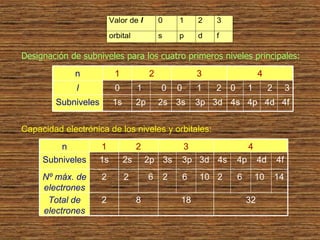
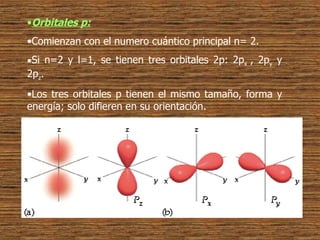
1) La estructura atómica ha sido estudiada desde la antigua Grecia, proponiéndose modelos como el de los átomos indivisibles o el de Demócrito.
2) En el siglo XIX, Dalton propuso la teoría atómica moderna donde los átomos son partículas indivisibles y los elementos químicos están formados por átomos de una sola clase.
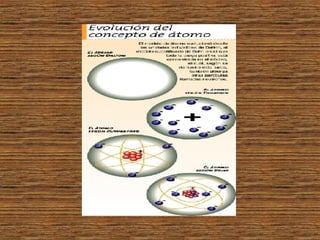
3) Experimentos como los de Thomson, Rutherford y Bohr llevaron a la conclusión de que el átomo está formado por un n






















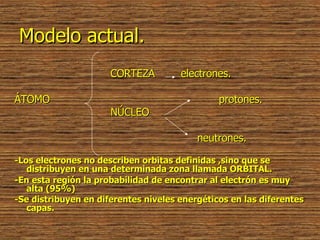
















![Ejemplos de formación de iones más probables. 17 Cl 17 Cl=1s 2 2s 2 2p 6 3s 2 3p 5 +1electrón 17 Cl - 1s 2 2s 2 2p 6 3s 2 3p 6 [Ar]](https://image.slidesharecdn.com/estructura-atmica3498/85/Estructura-Atomica-41-320.jpg)