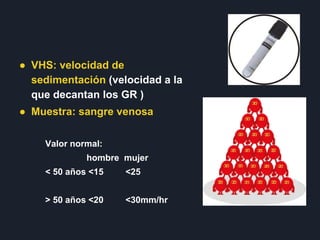
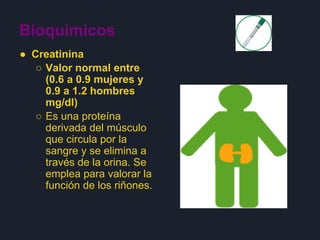
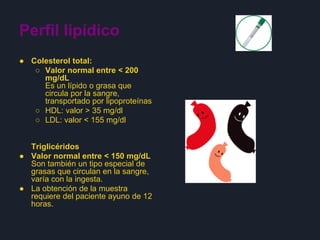
Las tres oraciones resumen lo siguiente:
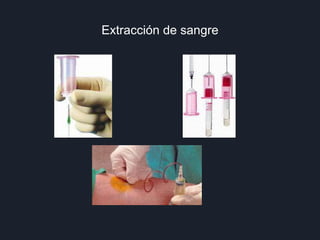
1) El documento proporciona instrucciones sobre los aspectos administrativos generales de los exámenes de laboratorio, incluida la coordinación con el laboratorio central y la obtención correcta de muestras.
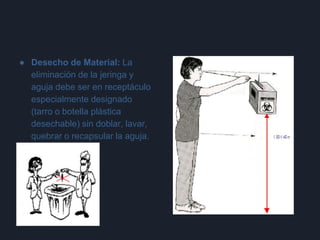
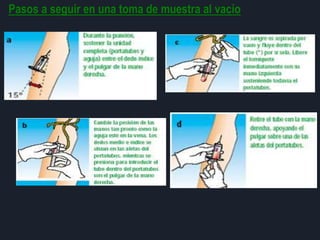
2) También describe las consecuencias de una mala técnica al tomar muestras, como daño al paciente, pérdida de tiempo y confianza, y alteración de resultados.
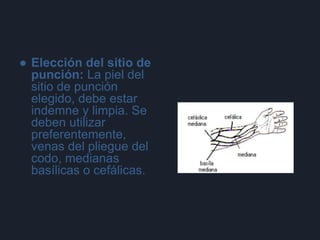
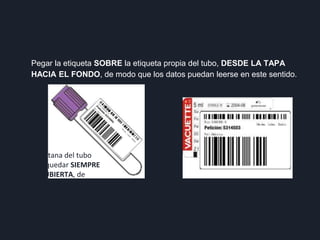
3) Por último, establece normas sobre el personal capacitado, materiales estériles de un solo uso, lavado