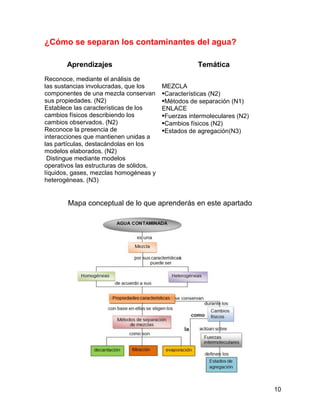
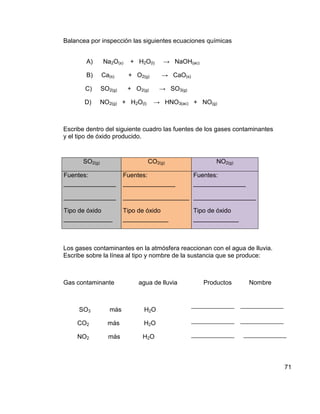
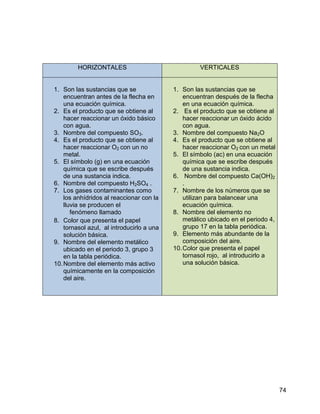
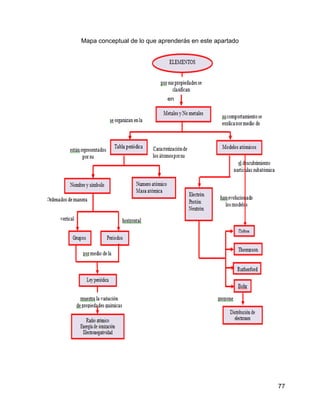
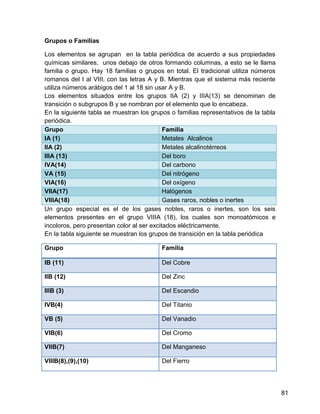
El agua se contamina fácilmente porque es una sustancia que forma mezclas homogéneas
llamadas disoluciones con otras sustancias. Las disoluciones son mezclas en las que el agua,
como disolvente, dispersa de manera uniforme las otras sustancias en forma molecular o iónica
llamadas solutos. Debido a que el agua puede mezclarse uniformemente con muchas otras
sustancias, se contamina con facilidad cuando entran contaminantes en ella.