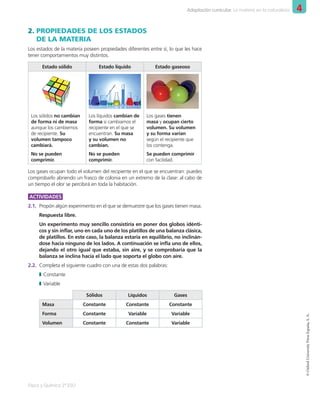
Este documento presenta la unidad sobre los estados de la materia en la naturaleza. Explica los tres estados de agregación de la materia (sólido, líquido y gaseoso), sus propiedades características y cómo la teoría cinético-molecular justifica estas propiedades en función del movimiento y las interacciones entre las partículas que componen la materia. También introduce conceptos como los cambios de estado, las mezclas y los métodos para separar sus componentes.