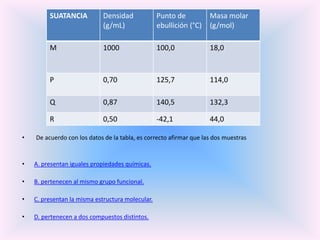
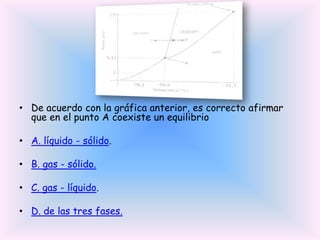
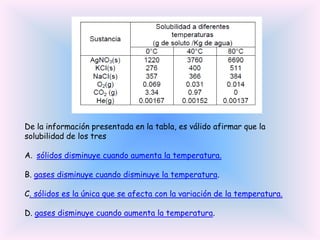
El documento trata sobre la formación de enlaces entre elementos de diferentes regiones de la tabla periódica. Explica que estos enlaces presentan alta polaridad e incluso carácter iónico debido a la diferencia de electronegatividad entre los dos elementos.