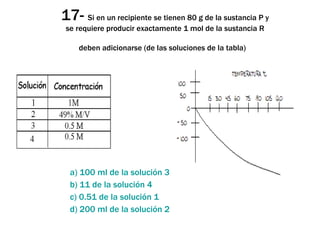
El documento presenta 25 preguntas de opción múltiple sobre conceptos básicos de química. Las preguntas abarcan temas como las características que definen una disciplina científica, el orden lógico del proceso de investigación científica, elementos de la tabla periódica, cambios de estado de la materia, reacciones químicas, leyes de los gases ideales y solubilidad.