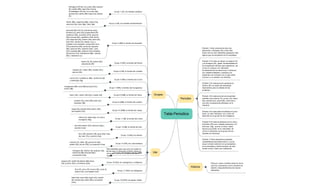
El documento describe la tabla periódica de los elementos, incluyendo los grupos principales que comprenden cada familia de elementos, así como los periodos. Se dividen los elementos en 18 grupos según sus propiedades químicas y electrónicas. También se explica brevemente la historia de la tabla periódica y cómo ha ido evolucionando con nuevos descubrimientos.