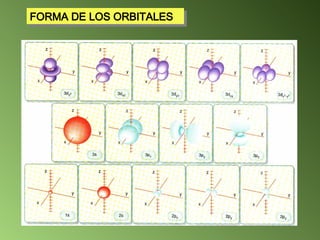
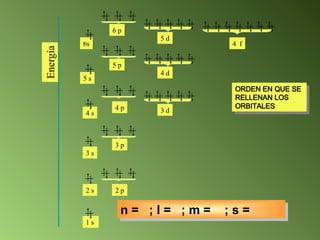
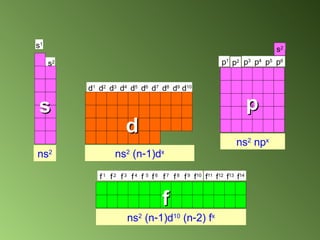
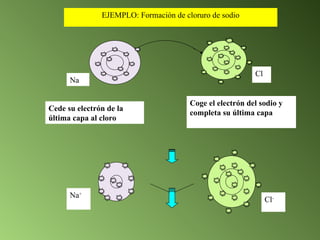
El documento detalla el desarrollo de la teoría atómica desde la proposición de John Dalton en 1808, que estableció que la materia está compuesta por átomos indivisibles de masa uniforme para cada elemento. Se describen los avances significativos en el estudio de la estructura atómica por científicoss como J.J. Thomson, Ernest Rutherford, y Niels Bohr, quienes contribuyeron a la comprensión del núcleo, electrones y configuraciones electrónicas. Por último, se menciona la organización de los elementos en la tabla periódica según su número atómico y propiedades químicas relacionadas.