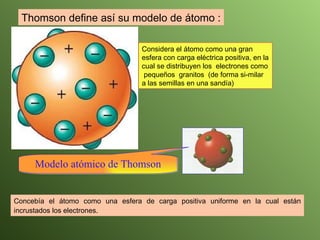
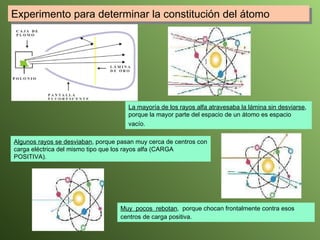
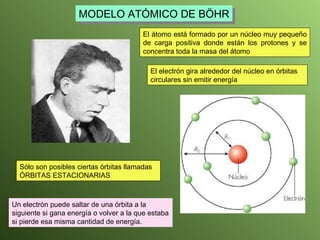
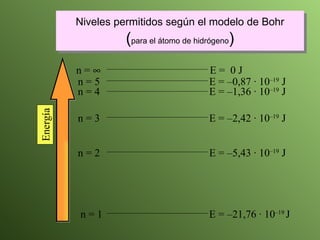
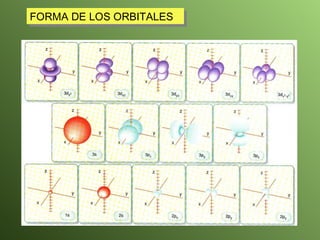
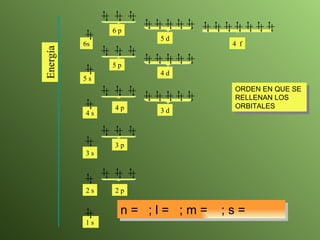
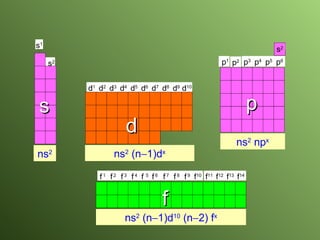
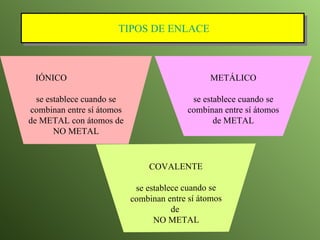
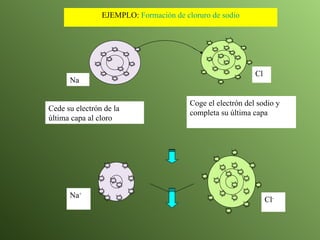
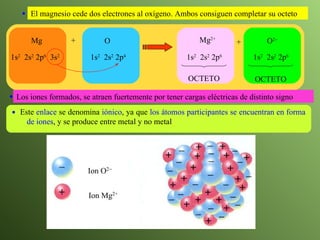
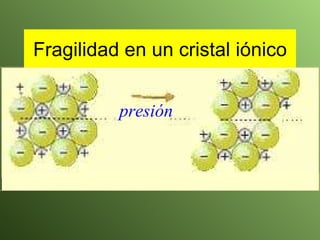
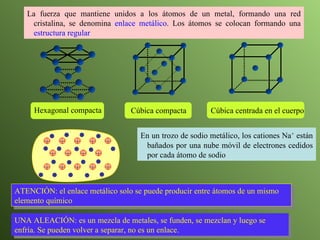
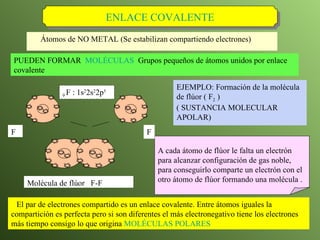
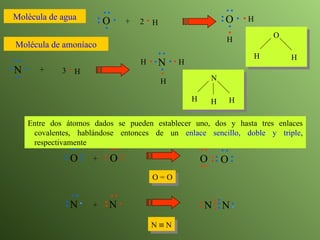
El documento describe la evolución del modelo atómico a lo largo de la historia, desde la teoría atómica de Dalton hasta el modelo actual. Se introducen los descubrimientos clave de Thomson, Rutherford, Bohr y otros que llevaron al entendimiento moderno del átomo como un núcleo rodeado por electrones en diferentes orbitales. También se explica la tabla periódica y cómo ordena los elementos según sus configuraciones electrónicas.