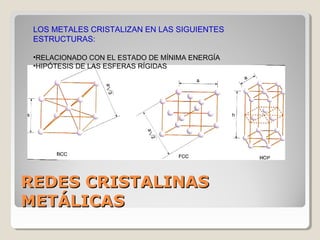
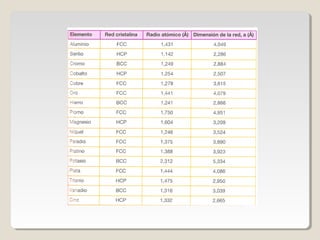
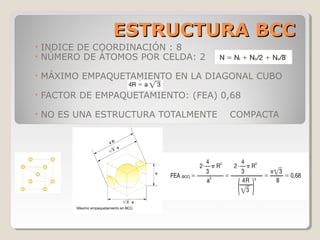
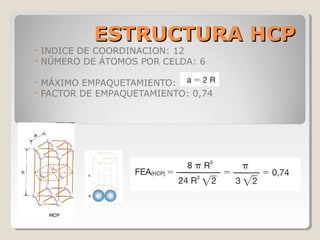
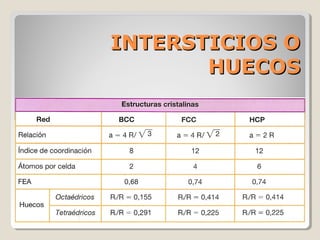
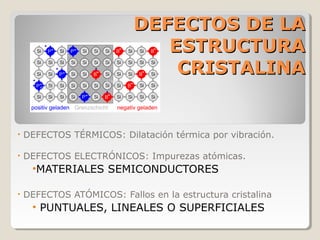
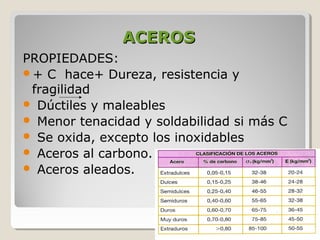
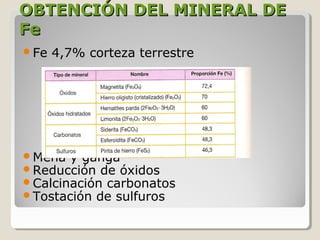
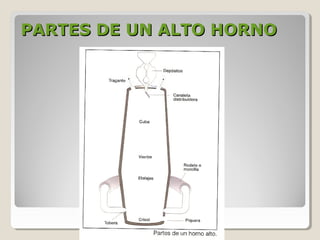
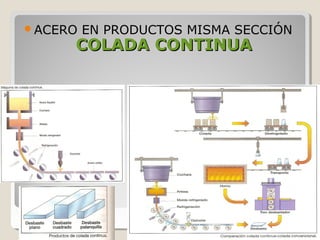
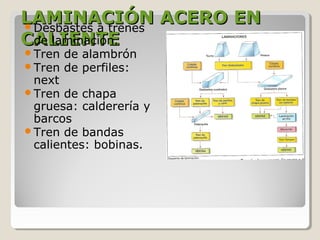
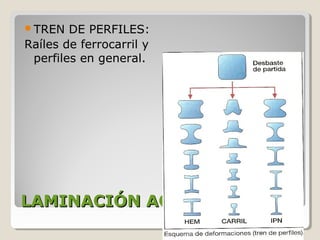
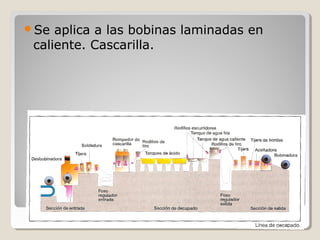
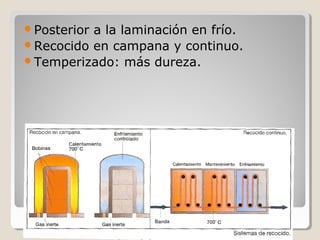
Este documento describe las propiedades y la estructura interna de los metales. Explica que las propiedades de los metales como su alta conductividad térmica y eléctrica derivan del enlace metálico, el cual forma una nube electrónica que permite la gran movilidad de los electrones. También describe las diferentes estructuras cristalinas de los metales como la CFC y BCC, y cómo defectos en la red como dislocaciones y granos afectan sus propiedades. Finalmente, analiza tratamientos térmicos y de aleación que modific