1. La mullita tiene la fórmula 3Al2O3.2SiO2. Contiene un 79.71% de alúmina y un 21.28% de sílice. Se necesitan 85.1076 kg de alúmina para producir 1500 kg de mullita a partir de óxidos puros.
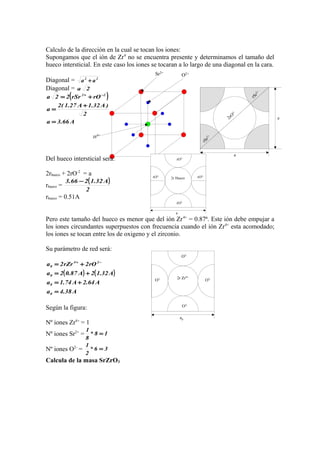
2. El SrZrO3 tiene una estructura perovskita. Los iones se tocan entre los iones de oxígeno y zirconio a lo largo de las diagonales de la cara cúbica. Su parámetro de red es 3.84 Å y


![Pb2+ :en el vertice
O2-
:en el centro de las caras
Ti4+
:en el centro del cubo
( )
3
38
20
3
cm/g90.5
celda/cm10x28.4
celdas75.28/10x33.1
celda/a
Celdasºn/mFeO
=
==
−
−
ρ
ρ
3. La densidad del PbTiO3 cúbico es 7.5 g/cm3
¿Cuál es el tamaño de la red de la
celda unitaria. Cual es el factor de empaquetamiento.
Solución:
El PbTiO3 (titanato de Pb) este tipo de cerámica tiene una estructura tipo AmBnXp, la
estructura es del tipo ccc (centrada en las caras) Según la figura:
La estructura tiene coordinación NC = 6 con respecto al O2-
Datos:
r(O2-
) = 1.40 A P.A. =16
Densidad = 7.5 g/cm3
r(Ti4+
) = 0.68 A P.A. = 47.9
r(Pb2+
) = 1.2 A P.A = 207.2
N= 6.023x1023
Primero calculamos el Nº de iones en la celda unitaria
Nº de iones Pb2+
: vértice: 18*
8
1
=
Nº de iones O2-
: en el centro de las caras: 36*
2
1
=
Nº de iones Ti4+
: en el entro del cubo: 1
Sabemos que
v
m
D =
⇒ la masa se calcula como sigue:
( )[ ] ( )[ ] ( )[ ] )1...(
avogradodeºN
atm/gTi.A.PTiºnatm/g.oxig.A.POºnatm/gPb.A.PPbºn
m
422 +−+
++
=
Reemplazando valores en la ecuación (1)
( )[ ] ( )[ ] ( )[ ]
g10x032.5m
10x023.6
atm/g90.471atm/g163atm/g2.2071
m
22
23
−
=
++
=
Calculamos el volumen para calcular “a”
Como sabemos V = a3
⇒ a =
3/1
densidad
m
](https://image.slidesharecdn.com/grupodeejerciciosn1-150324175700-conversion-gate01/85/Grupo-de-ejercicios-n-1-3-320.jpg)