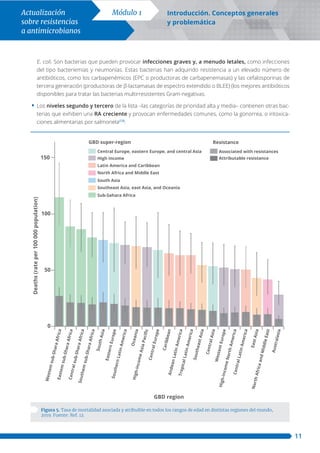
La resistencia a los antimicrobianos (RA) se ha convertido en una prioridad de salud pública a nivel global, con un aumento notable en la prevalencia de infecciones resistentes que plantea riesgos significativos para la salud humana, la economía y los avances médicos. Cada año, miles de muertes y un alto costo económico asociado se atribuyen a esta crisis sanitaria, exacerbada por el uso inadecuado de antimicrobianos en humanos y animales. La identificación rápida de microorganismos resistentes es crucial para el control de la RA y la preservación del uso efectivo de tratamientos antimicrobianos.