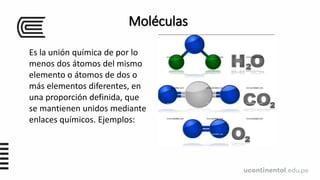
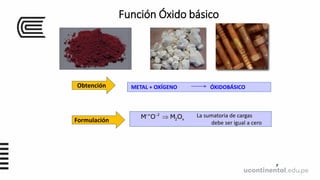
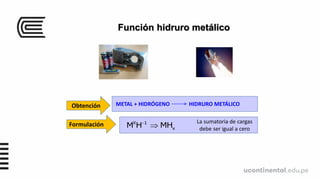
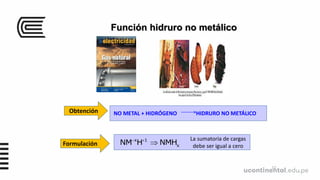
Este documento presenta información sobre moléculas, iones y funciones inorgánicas. Define moléculas como la unión química de dos o más átomos, iones como átomos o grupos de átomos con carga eléctrica, y formulas químicas como representaciones gráficas de moléculas y compuestos iónicos. También describe varios tipos de compuestos inorgánicos como óxidos, hidruros, sales y sus funciones.