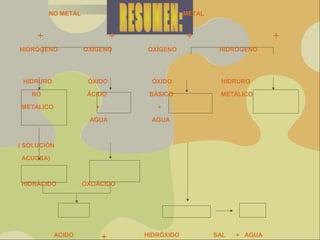
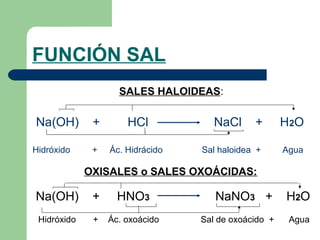
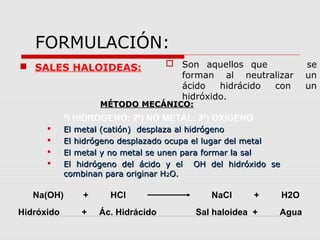
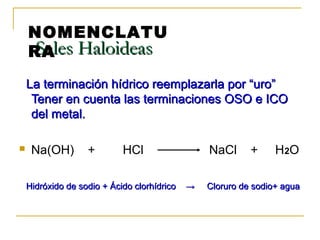
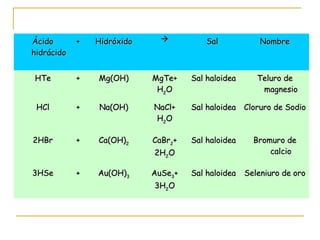
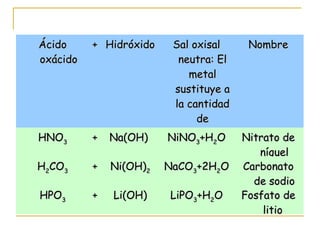
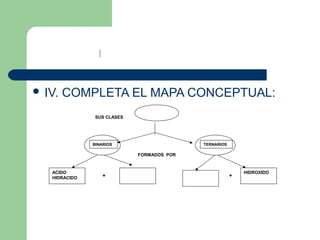
Este documento proporciona información sobre las funciones químicas inorgánicas, en particular sobre las sales. Explica que las sales se forman cuando un ácido reacciona con un hidróxido, produciendo una sal y agua. Las divide en sales haloideas, que se forman a partir de ácidos hidrácidos, y sales oxisales, que se forman a partir de ácidos oxoácidos. También describe las propiedades comunes de las sales y proporciona ejemplos de reacciones químicas que forman diferentes sales.