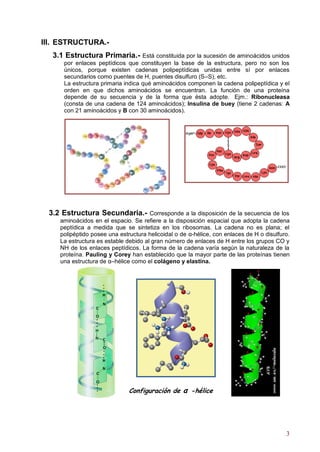
Las proteínas son polímeros lineales de aminoácidos unidos por enlaces peptídicos que cumplen funciones estructurales y metabólicas esenciales en los seres vivos. Constituyen alrededor del 50% del peso seco de las células animales y desempeñan un papel fundamental en la estructura, función y metabolismo celular. Las proteínas se clasifican según su solubilidad, origen y función, y presentan estructuras primaria, secundaria, terciaria y cuaternaria que determinan su forma