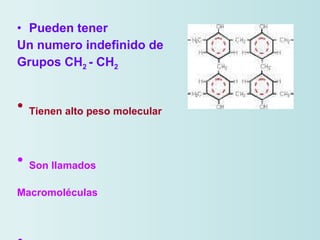
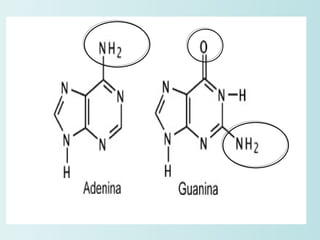
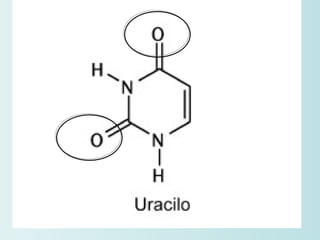
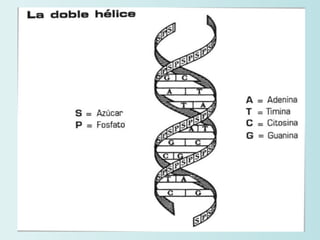
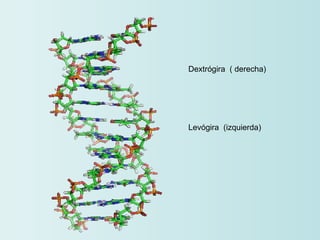
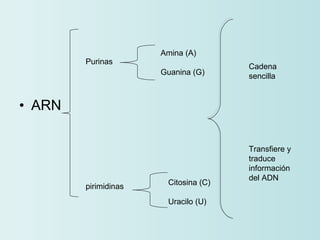
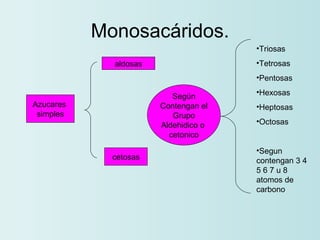
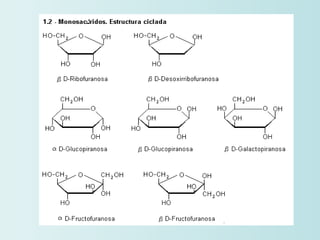
El documento habla sobre los polímeros naturales como la celulosa, el almidón y las proteínas. Explica que las proteínas están formadas por cadenas de aminoácidos y desempeñan funciones estructurales, reguladoras y enzimáticas. También describe la estructura y clasificación de los ácidos nucleicos ADN y ARN, así como la composición y funciones de los carbohidratos como la glucosa.