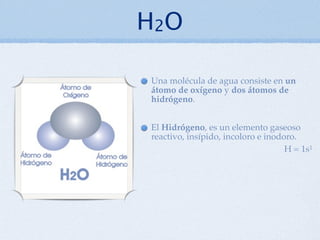
El documento describe las propiedades fundamentales del agua. Explica que una molécula de agua consiste en un átomo de oxígeno y dos átomos de hidrógeno unidos por enlaces covalentes. Debido a que el oxígeno es más electronegativo, la molécula de agua es polar, con una carga parcial negativa alrededor del oxígeno. Esto permite que las moléculas de agua formen puentes de hidrógeno, dándole propiedades únicas como su alta capacidad de disoluc