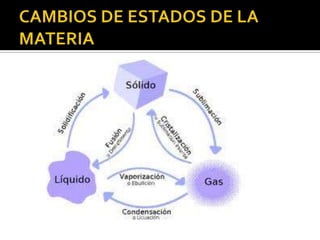
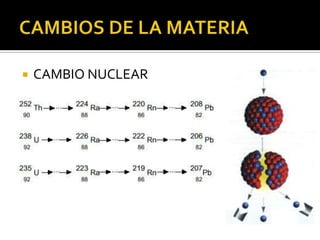
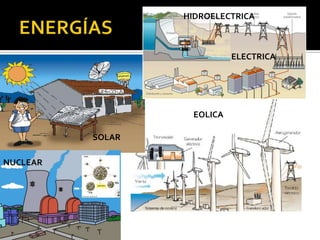
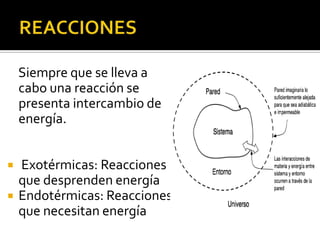
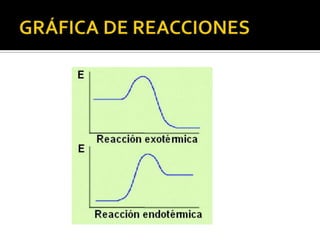
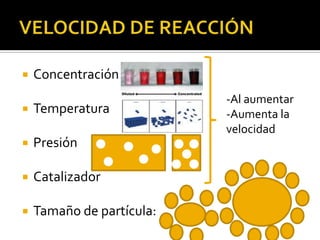
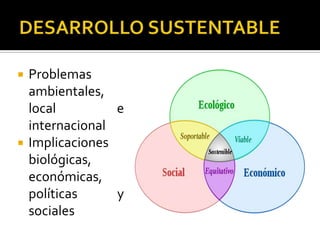
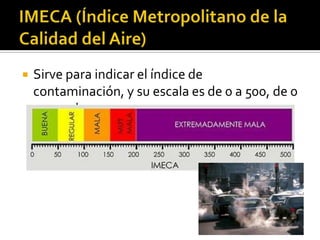
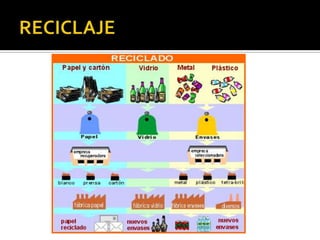
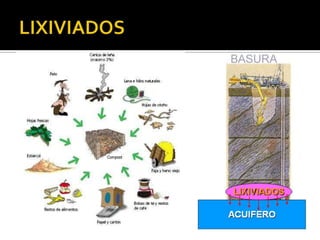
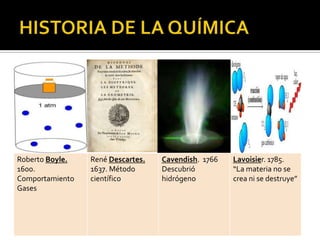
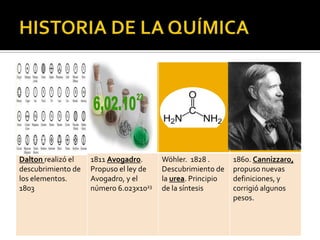
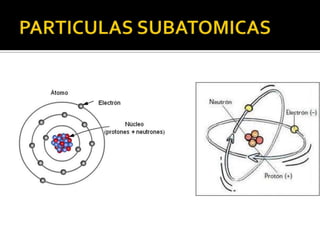
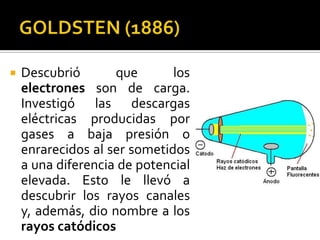
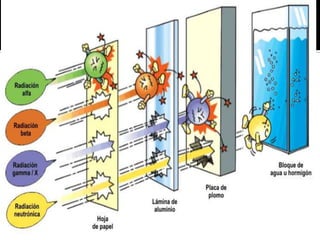
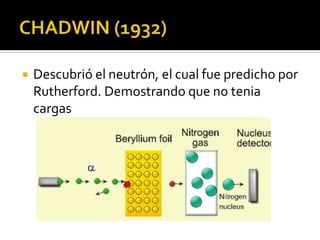
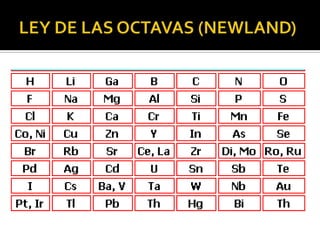
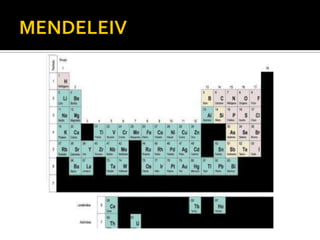
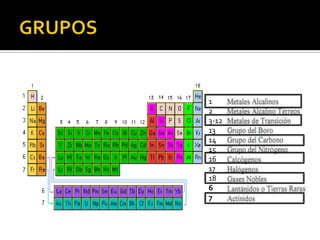
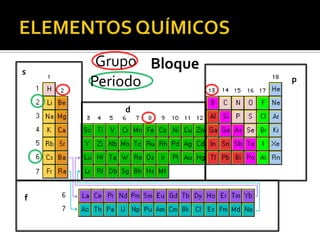
El documento describe los principales conceptos de la química. Se divide en 8 bloques que cubren temas como el método científico, el modelo atómico, la tabla periódica, las interacciones intermoleculares, la nomenclatura inorgánica, las reacciones químicas, la materia y la energía, y la cinética de reacciones. También incluye ejemplos prácticos de conceptos químicos y una lista de premios Nobel relacionados con avances en esta ciencia.














































































![NaI + HClO NaIO3 + HCl
Na+ I - + H+ (ClO)- Na+ (IO3)- + H+Cl-
3[(Cl+O-2) -+ 2e- Cl- ]
I- - 6e- (I+5O-23)-
-----------------------------------
3ClO3- + I- 3Cl- + IO3-
NaI + 3HClO NaIO3 + 3HCl](https://image.slidesharecdn.com/quimica1-121025184824-phpapp02/85/Quimica-1-122-320.jpg)