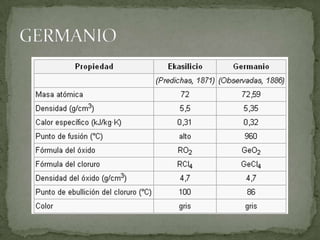
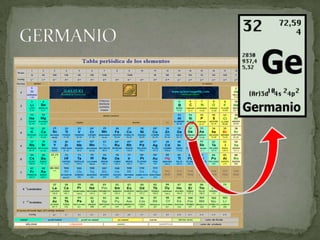
Este documento lista tres sólidos: silicio, germanio y galio. El silicio es un elemento semi-metálico gris azulado a temperatura ambiente. El germanio es un metaloide blanco grisáceo y quebradizo. El galio es un metal blando que se funde justo por encima de la temperatura ambiente y flota en su forma líquida.










![El germanio se encuentra muy distribuido en la corteza
terrestre con una abundancia de 6.7 ppm.
Se encuentra en la argirodita, en la canfieldita
[4Ag2S.(Sn,Ge)S2], germanita, ranierita*, minerales de
cinc, carbón,..
Isótopos:
5 naturales:
También se obtiene como subproducto en los procesos
•70-Ge (21%)
de obtención de cobre, cinc y en las cenizas de ciertos
•72-Ge (27%)
carbones.
•73-Ge 8%)
•74-Ge (36%)
•76-Ge (7,5%)
27 inestables con período de
semidesintegración entre 40
milisegundos y 270,8 días.
La ranierita es: sulfuro de cobre, hierro, cinc y
arsénico con hasta un 7% de germanio](https://image.slidesharecdn.com/solidoscristalinos-120810033638-phpapp02/85/Solidos-cristalinos-12-320.jpg)