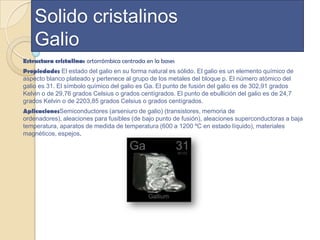
El documento describe las propiedades cristalinas del silicio, germanio y galio. El silicio presenta un enlace covalente donde cada átomo comparte electrones con cuatro átomos vecinos formando una estructura cristalina. Se utiliza en electrónica, cerámica y vidrio. El germanio tiene una estructura cúbica centrada en las caras y se emplea en fibra óptica, electrónica y óptica infrarroja. El galio cristaliza en una estructura ortorrómbica y se aplica en