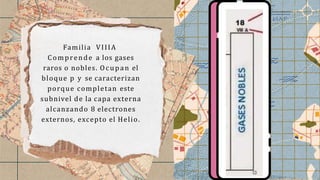
Este documento proporciona una descripción general de la organización de la tabla periódica. Explica que la tabla contiene 18 grupos principales (A) y secundarios (B) que abarcan los elementos representativos y de transición. También describe las características generales de los períodos y bloques, incluido que los períodos varían en longitud y los bloques se dividen según el tipo de electrones de valencia.