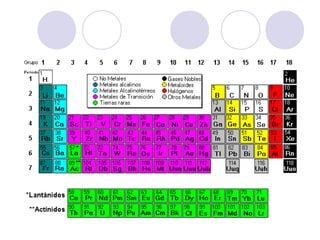
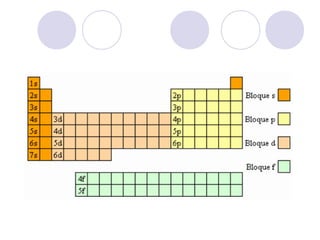
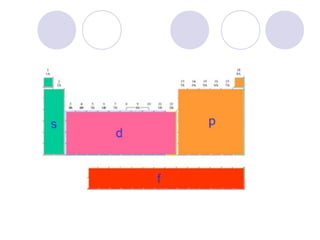
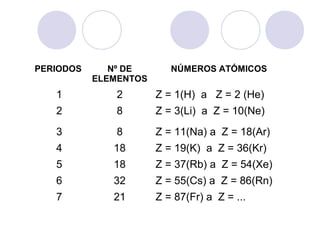
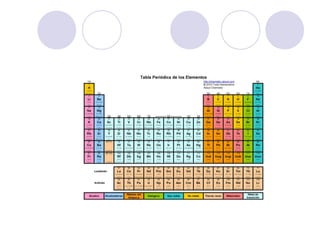
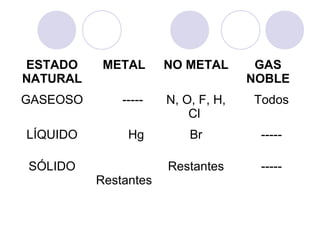
Este documento resume la tabla periódica moderna. Explica que clasifica los elementos en períodos y grupos, con los períodos representando el número de niveles de energía y los grupos indicando propiedades químicas similares. Describe las cuatro regiones de la tabla (s, p, d, f) y los diferentes grupos de elementos, incluyendo los representativos, de transición y tierras raras. También cubre el estado natural y abundancia de los elementos.