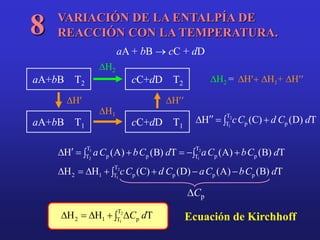
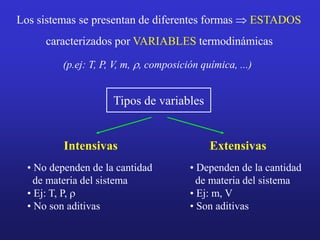
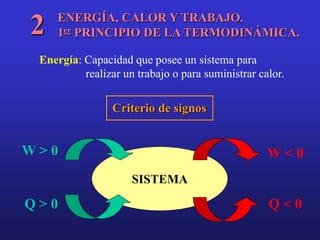
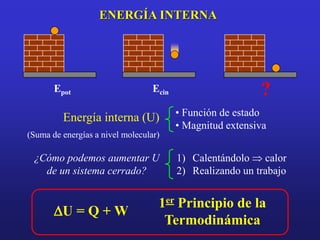
El documento presenta información sobre la termoquímica. Explica conceptos como sistema, variable, proceso, energía, calor, trabajo y la primera ley de la termodinámica. También define entalpía y explica cómo se pueden determinar las entalpías de reacción a través de métodos como medir el calor de reacción, aplicar la ley de Hess o usar entalpías estándar de formación y de enlace. Finalmente, introduce conceptos como capacidad calorífica.









![TRABAJO
r
d
F
d
W Unidad S.I.: Julio
Trabajo de expansión/compresión de los gases
Pint Pext
dV
V
P
W ext d
d
[Levine, pg 42]
2
1
V
V ext V
P
W d](https://image.slidesharecdn.com/tema3-221123023757-36061612/85/Tema3-ppt-15-320.jpg)
![Casos particulares
V
P
)
V
V
(
P
V
P
V
P
W ext
1
2
ext
V
V
ext
V
V ext
2
1
2
1
D
d
d
1) Expansión frente a una Pext constante
2) Expansión en el vacío
Pext = 0 W = 0 [Segal, pg 590]
No es una propiedad característica del sistema.
No es algo que posea el sistema.
Es una forma de intercambio de energía, una “energía en tránsito”
El trabajo no es función de estado](https://image.slidesharecdn.com/tema3-221123023757-36061612/85/Tema3-ppt-16-320.jpg)




![CALOR DE REACCIÓN. LEY DE HESS.
4
Reacciones
químicas
• Exotérmicas (Q < 0)
• Endotérmicas (Q > 0)
El calor de reacción se mide con un calorímetro
[Petrucci, pg 227]
Qv = DU = Uprod - Ureac
Qp = DH = Hprod - Hreac
DH = DU + D(PV)
DH @ DU
¿Intervienen
gases?
No
Sí
DH = DU + D(nRT)
DH = DU + RTDn
Si T=cte](https://image.slidesharecdn.com/tema3-221123023757-36061612/85/Tema3-ppt-22-320.jpg)



![Método 4 A partir de DHfº
)
reac
(
H
)
prod
(
H
H o
f
reac
reac
o
f
prod
prod
o
D
D
D
[Levine, pg 147]
Tabular DHfº para cada sustancia](https://image.slidesharecdn.com/tema3-221123023757-36061612/85/Tema3-ppt-26-320.jpg)