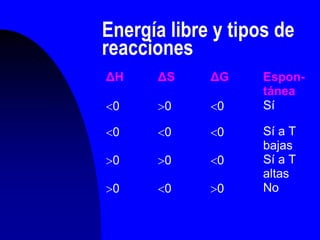
El documento describe conceptos básicos de termodinámica. Explica que la termodinámica estudia la transferencia de energía entre sistemas y su entorno a través del trabajo y el calor. También describe las leyes de la termodinámica, incluida la relación entre la variación de energía interna de un sistema y la energía transferida como trabajo y calor. Finalmente, introduce conceptos como la entalpía, la entropía y la energía libre de Gibbs para predecir la espontaneidad de las reacciones químicas.